发酵床微生物群落构成及其对圈养绿狒狒的影响
2019-08-19潘麒嫣朱迎娣耿广耀徐艳春王爱善杨淑慧
潘麒嫣 朱迎娣 耿广耀 徐艳春,3,4 王爱善* 黄 晶 杨淑慧*
(1.东北林业大学野生动物资源学院,哈尔滨,150040;2.上海动物园,上海,200335;3.国家林业和草原局野生动物保护与利用工程技术研究中心,哈尔滨,150040;4.国家林业和草原局野生动植物检测中心,哈尔滨,150040)
目前,大多数动物园灵长类的笼舍都使用水泥等硬质地面,其优点是方便清理、冲洗和消毒,也减少饲料的污染。但是,室内供暖设施通常不在地面,而是设置在空中,冬季虽然室内温度能够达到动物的要求,地面温度仍然很低。尤其是在清理或消毒时经过用水冲洗,地面更加潮湿和寒冷。灵长类直接接触地面,不可避免地遭受寒冷侵袭,甚至引起疾病。此外,这种地面也大大影响展示效果。
发酵床技术是一种利用复合菌剂就地转化动物排泄废物的新型生态环保养殖技术,通过微生物的分解作用将动物粪、尿降解,从而节省清理成本,并达到节水、节能,低污染低排放[1-2]。更重要的是,微生物发酵过程中会产生一定的热量[3],在冬季有助于提高动物福利[4]。因而广泛应用于生猪、牛以及禽类养殖[5-6]。
为了改进灵长类笼舍环境,我们在畜禽类发酵床技术的基础上,设计了灵长类发酵床,并在上海动物园进行了试验研究。发酵床以木屑、米糠和黄土作为基本垫料,采用发酵床微生物合剂进行发酵,发酵床群落达到顶极后作为山魈(Mandrillussphinx)笼舍的地面。行为监测显示,相比普通笼舍,从12月至翌年2月,山魈地坐息时间降低了约50%,且坐息行为大部分都发生在垫料上面。活跃时间提高了近10倍,其中探究行为占49%,咀嚼行为占23%,大大降低了刻板行为的频率[7]。
但是,微生物发酵会产生氨、氧化亚氮、甲烷、二氧化硫等有害气体[3],细菌群落中也含有细菌毒素,在山魈实验中虽然未观察到动物健康下降的情况,但仍有可能对动物健康造成不利影响。本研究采用这一发酵床技术,以绿狒狒(Papioanubis)为实验动物,检测发酵床不同深度细菌群落结构,观察细菌群落对动物的安全性。
1 材料与方法
1.1 发酵床的制备
本研究于2018年于2月18日—3月20日在上海动物园进行。选定一间长5.1 m、宽3.6 m、高 3.4 m长方形室内展区。发酵床基质厚约75 cm,由木屑、米糠和黄土按质量比5∶4∶1混合,用益加益发酵床专用菌种(益加益生物工程有限公司,郑州)与垫料充分混合,垫料的湿度控制在50%左右(图1)。发酵床专用菌种由乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、放线菌属(Actinomyces)、酵母菌属(Saccharomyces)、光合细菌、丝状真菌中的多种有益微生物菌群及其代谢产物复配而成。发酵床铺设完毕后,在其表面铺设一层塑料薄膜,发酵2 wk,待其微生物群落稳定期后,移除地膜。24 h后把2只绿狒狒放入笼舍饲养和展出。该笼舍与其他笼舍一样设有暖气和丰容设施(主要是倒木)。日常管理仅对于饲料台、玻璃等部分用少量水冲洗,移除粪便。每隔7 d把发酵床人工翻动一次。笼舍内和笼舍外的参观通道均设置温度计和湿度计,定时监测发酵床的含水量,适时补充水分,使之保持较为稳定的状态。
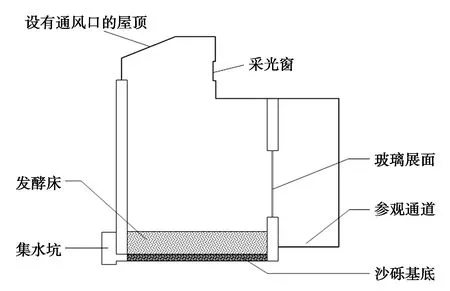
图1 发酵床结构示意图Fig.1 Schematic diagram of fermentation bed
1.2 温度的监测
发酵床温度稳定后,自2月18日—3月20日期间,每日12:00对发酵床笼舍的垫料中层(25 cm处)、笼舍内的温度(距地面2.0 m)和笼舍外参观通道的温度进行记录。
1.3 发酵床不同深度的细菌群落结构分析
在发酵床中心点以及该点到四角距离的1/2处各选取1个点,每个点分别在表面(0 cm)、25 cm、50 cm和75 cm深度各挖取垫料样本约200 g,将5个采样点同一深度的样品等量混合均匀,然后分成3份,作为该深度的3个生物学重复,共得到12份样品。所有样品都采用1.5倍体积的DET保存液(含有0.25 mol/L的EDTA、20%的DMSO、0.1mol/L的Tris(pH 7.5)和饱和的NaCl)常温保存备用。
在无菌条件下采用CTAB法分别提取各垫料样本的总DNA,于-20℃冰箱冻存备用。采用原核生物16S rDNA V4区的通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对各垫料样本的总DNA进行PCR扩增。PCR扩增体系(30 μL)包括2×Phusion Master Mix 15 μL、Primer(2 μmol/L)3 μL、总DNA(1 ng/μL)10 μL、去离子水2 μL。扩增程序为:98℃预变性1 min;98℃变性10 s、50℃退火30 s、72℃延伸30 s,共30个循环;72℃继续延伸5 min。扩增产物采用GeneJET 胶回收试剂盒(Thermo Scientific,美国)纯化回收。用TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒(Illumina,美国)进行文库的构建,用HiSeq 2000(Illumina,美国)平台进行测序。
用Cutadapt软件将经过16S rDNA扩增子测序的原始数据进行过滤,并按barcode拆分样本,切除barcode 和引物序列后,使用FLASH软件进行序列拼接,对序列进行质控和过滤,去除其中的嵌合体序列得到最终的有效数据,然后用Uparse 软件在97%的相似性阈值下,将剩余的序列聚类为操作分类单元(OTU),并对OTUs进行物种注释,用Mothur软件计算常用的生物多样性指数。
2 结果
2.1 温度变化与动物行为
监测期间,发酵床中层温度、笼舍温度和参观通道温度的变化如图2所示。参观通道相对开放,因此,此处的温度受到天气温度的影响比较明显,2月中旬到3月中旬保持在4.6℃—11.8℃,略有波动。到3月15—19日出现一次升温,20日又回落到正常水平。笼舍内的温度也受到天气升温的影响,但总体上比参观通道高1℃—7.9℃。发酵床中层的温度没有受到室温和天气的影响。制备初期,笼舍温度低于10℃的情况下,发酵床的温度达到20℃—25℃,随着发酵程度的加深,温度在3 d之内就升到最高峰45℃,随后缓慢回落,到3月中旬达到稳定期,处于28℃—30℃。虽然外界气温和笼舍的温度有所变化,但发酵床的温度保持稳定,为绿狒狒提供温暖的地面环境。
监测期间,绿狒狒未观察到临床上的不良状态。采用发酵床之前绿狒狒大部分时间都挤在取暖设备附近。采用发酵床后,绿狒狒大部分时间都在发酵床上活动,主要是翻动发酵床寻找里面滋生的各种甲虫和蠕虫,并放到口中咀嚼。绿狒狒可将发酵床翻动至25 cm深度,有机会接触从表面到这一深度的各类微生物,并通过采食甲虫等,将发酵床微生物与肠道微生物建立联系。
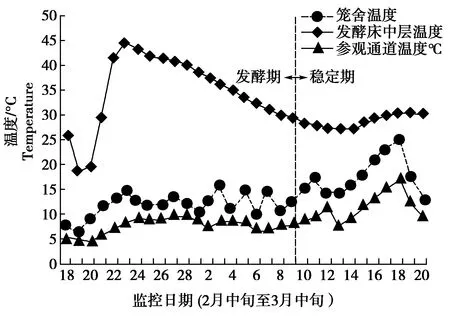
图2 2月下旬至3月中旬发酵床中层(深25 cm处)、笼舍和参观通道的温度波动Fig.2 Temperature dynamics of fermentation substrate middle layer(at 25 cm in depth),enclosure and visitor passageway
2.2 发酵床不同深度的细菌群落结构
2.2.1 OTU聚类分析
经过16S rDNA扩增子测序,获得999 077条原始序列数据。根据overlap关系进行拼接和质控过滤,共得到956 205个符合质量标准的序列。稀释曲线(rarefaction curve)显示,当测序深度达到40 000 reads以上时,OTU数趋于稳定,表明测序深度已经足够覆盖样品中所有的细菌物种。在12个样本中,共确定3 564个真细菌和古菌操作分类单元(OTU)。S0、S25、S50、S75各层分别有2 644、2 217、2 270和2 189个OTU。
2.2.2 门水平上细菌群落的结构特点
以上OTU数据从4个不同深度的发酵床样品中共确定41个门的细菌,占总OTU数的98.26%。图3显示相对丰度排序前28的门,其中相对丰度最高的为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),占总相对丰度的94.73%。
这4个门在发酵床不同深度的样品中相对丰度存在明显的差异。如图3所示,发酵床表层(S0组)共注释到34个门,变形菌门、放线菌门、拟杆菌门和厚壁菌门的相对丰度分别为37.01%、27.34%、19.33%和9.94%;25 cm处(S25组)共注释到30个门,放线菌门优势最为明显,相对丰度占55.31%,而厚壁菌门、变形菌门和拟杆菌门的相对丰度分别为16.64%、16.37%和10.50%。50 cm处(S50组)共注释到31个门,以变形菌门和放线菌门为主,相对丰度分别为38.89%和33.45%,拟杆菌门和厚壁菌门相对丰度分别为 18.46%和5.22%;相比S0而言,放线菌门的相对丰度有所增加,而厚壁菌门的相对丰度有所下降;75 cm处(S75组)处于发酵床的最底层,共注释到37个门,变形菌门占绝对优势,相对丰度达到64.48%,而放线菌门、拟杆菌门和厚壁菌门都明显减小,分别为 10.80%、8.81%和5.35%。总体上看,S25、S50、S75组表现出随着深度的增加,变形菌门相对丰度逐渐增加,而放线菌门和拟杆菌门的相对丰度逐渐降低的趋势,但S0组的群落结构不符合这一规律,说明S0组细菌的生境与其他深度有明显的异质性。
2.2.3 属水平上细菌群落的结构特点
4组不同深度的发酵床样品中共确定574个属,占总OTU数的97.29%。图4显示相对丰度排序前28的属,其中优势属主要包括Glutamicibacter、解木聚糖微菌属Xylanimicrobium、藤黄色杆菌属(Luteibacter)、糖多孢菌属(Saccharopolyspora)、Arachidicoccus、链霉菌属(Streptomyces)、葡萄球菌属(Staphylococcus)、黄杆菌属(Flavobacterium)、芽孢杆菌属、德沃斯氏菌属(Devosia)和Taibaiella等11个属,总相对丰度占所有属分类水平的64.86%。
不同深度发酵床样品中属水平细菌群落结构存在显著差异:S0组中Glutamicibacter占有绝对优势,相对丰度占24.24%;S25组糖多孢菌属占有优势,相对丰度占16.91%,链霉菌属和葡萄球菌属相对丰度也较高,分别为10.40%和7.52%;S50组中Xylanimicrobium占有优势,相对丰度占S50组的17.46%,其次为Arachidicoccus属,相对丰度为10.02%;S75组中除藤黄色杆菌属相对丰度较高外,占到S75组的13.94%,德沃斯氏菌属相对丰度也较高,为6.68%。
观察发现,绿狒狒经常翻动发酵床,但是翻动深度在0—25 cm范围内。因此,把S0和S25两个深度的样品合并分析。结果显示,S0组和S25组总相对丰度超过1%的属共17个,排在前5位的有Glutamicibacter、糖多孢菌属、链霉菌属、葡萄球菌属和芽孢杆菌属,占到总相对丰度的34.31%。其中主要以有益菌为主的属有13个,总相对丰度为42.26%;以致病菌为主的属有4个,总相对丰度为11.08%。两组合并后,总相对丰度超过1%的属有17个,占总相对丰度的53.54%(图5)。
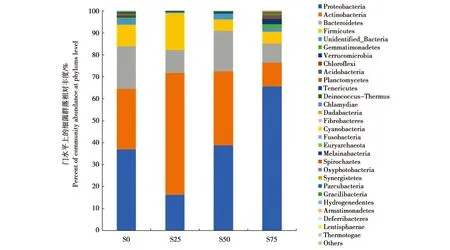
图3 发酵床不同深度的细菌在门水平上的群落组成Fig.3 Variation of bacterial community composition of the fermentation substrate among different depths at phylum levelS0:表层;S25:25 cm深处;S50:50 cm深处;S75:75 cm深处S0:surface layer of the fermentation substrate.S25:25 cm in depth.S50:50 cm in depth.S75:75 cm in depth
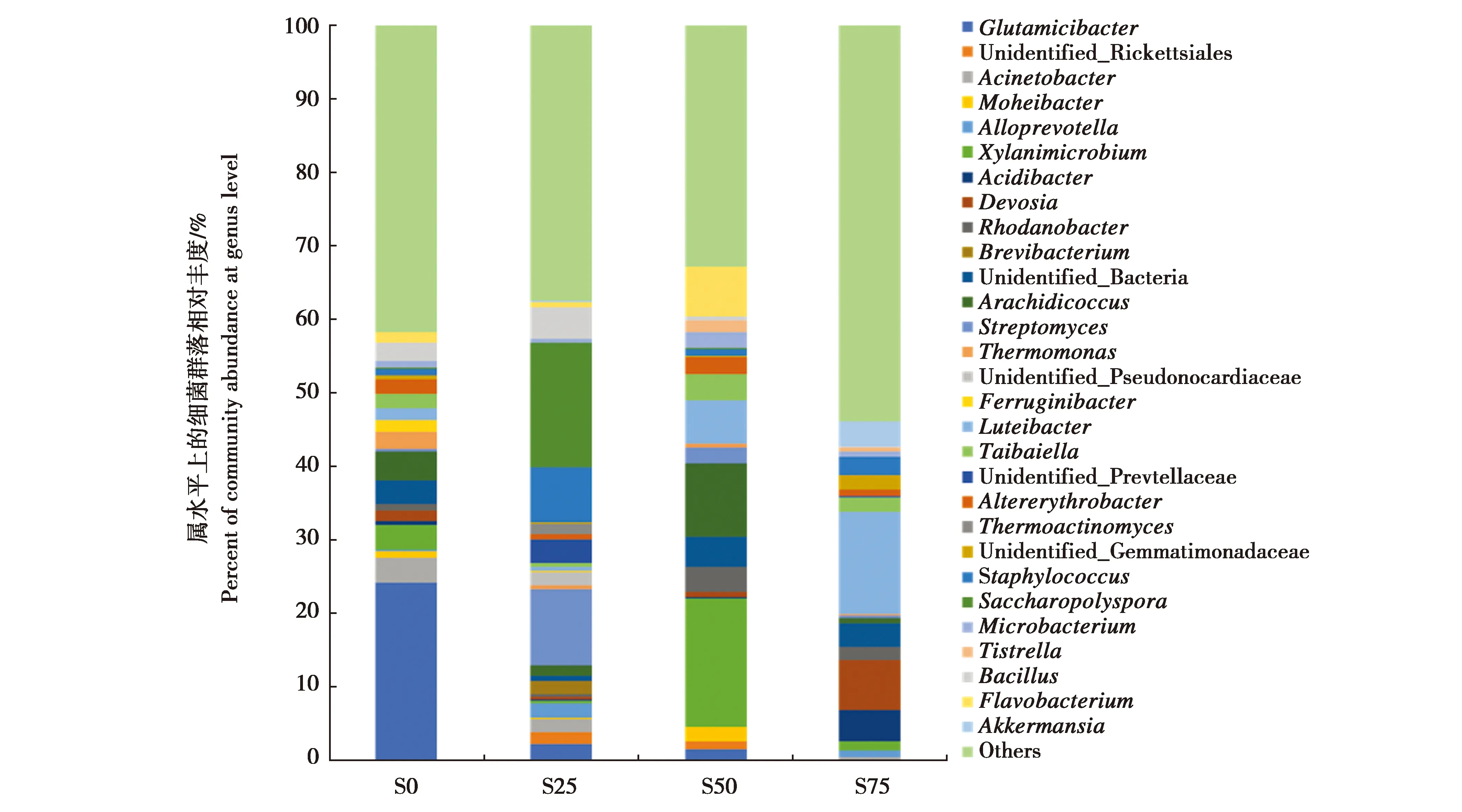
图4 发酵床不同深度的细菌在属水平上的群落组成Fig.4 Variation of bacterial community composition of the fermentation substrate among different depths at genus levelS0:表层;S25:25 cm深处;S50:50 cm深处;S75:75 cm深处S0:surface layer of the fermentation substrate.S25:25 cm in depth.S50:50 cm in depth.S75:75 cm in depth
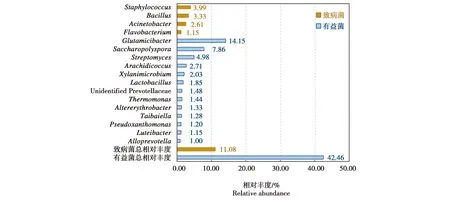
图5 发酵床表层(S0)和25 cm深处(S25)属水平上有益菌和致病菌及其相对丰度Fig.5 Genus and their relative abundance of probiotics and pathogenic bacteria of the surface layer(S0)and middle layer(S25)of the fermentation substrate
2.2.4 种水平上细菌群落的结构特点
鉴定到种的OTU仅占总数的23.70%。在种水平上,4组不同深度的发酵床垫料共注释出具有明确分类的种318个,其中注释到9种总相对丰度超过1%的细菌,总相对丰度为72.23%,包括阿氏节杆菌(Glutamicibacterarilaitensis,异名Arthrobacterarilaitensis)、干草小多孢菌(Saccharopolysporarectivirgula,异名Micropolysporafaeni)、阿克曼粘细菌(Akkermansiamuciniphila)、洛菲不动杆菌(Acinetobacterlwoffii)、普氏菌(Prevotellacopri)、格氏乳杆菌(Lactobacillusgasseri,或称加氏乳杆菌)、艰难梭菌(Clostridioidesdifficile)、Brevibacteriumepidermidis和罗伊氏乳杆菌(Lactobacillusreuteri)(图6)。
S0组样品中,阿氏节杆菌是绝对优势菌,相对丰度为58.57%,洛菲不动杆菌、格氏乳杆菌和罗伊氏乳杆菌相对丰度也较高,分别为5.8%、2.66%和2.25%;S25组样品中,干草小多孢菌是优势菌,相对丰度为35.58%,阿氏节杆菌和普氏菌相对丰度也较高,分别为7.21%和6.40%;S50组样品中,仅阿氏节杆菌相对丰度较大,为8.59%;S75组样品中,阿克曼粘细菌为优势菌,相对丰度为17.11%,艰难梭菌相对丰度也较高,为6.43%。
在种的水平上,S0组和S25组共注释到10种总相对丰度超过1%的细菌,其中有益菌占7种,分别是阿氏节杆菌、Brevibacteriumepidermidis、格氏乳杆菌、罗伊氏乳杆菌、Lysobacterpocheonensis、Sporosarcinaaquimarina和谷氨酸棒状杆菌(Corynebacteriumglutamicum),总相对丰度为46.78%;潜在致病菌3种,分别是干草小多孢菌、洛菲不动杆菌和普氏菌,总相对丰度为22.10%(图7)。
2.3 细菌群落多样性分析
2.3.1 Alpha多样性
OTU数据统计显示,每一样品测序的覆盖率均达到0.996,表明测序中未被测到的物种的概率极低,结果能够反应样品的实际情况。S0、S25、S50、S75各层分别有2 644、2 217、2 270和2 189个OTU。4层共享OTU的数量为1 177个,按照深度顺序,各层特有的OTU分别为300、206、197和181个,说明各个深度为细菌提供的环境有着显著差异。为了分析每个样品细菌群落的多样性,对每一深度的样品计算了4种Alpha多样性指数:ACE指数、Chao1指数、Simpson指数和Shannon指数。表1显示,4组样品中S0的ACE指数(2 133.695)明显高于其他3组(1 652.088—1 791.101),说明S0组的OTU数量,即物种数量最多。同时,S0组的Chao1指数(2 125.844)显著高于其他3组(1 638.753—1 771.731),表明该组物种的理论丰富度也是最高的。4组样品的Simpson指数均为0.973—0.987,较为接近,说明各组物种数量差异不很大,但是Shannon指数在S0组(8.144)明显大于其他3个深度的样品(7.205—7.814),说明发酵床表层物种的均匀度较高。另外,处于发酵床中下层的S50样品无论是物种数量还是均匀度都稍微高于中上层的S25和底层的S75,再次印证发酵床内部不同深度细菌生长的环境差异较大。
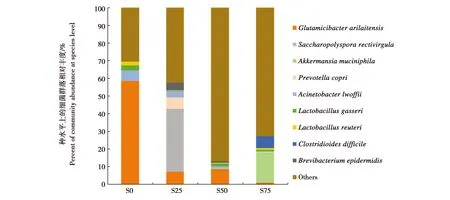
图6 发酵床不同深度的细菌在种水平上的群落组成Fig.6 Variation of bacterial community composition of the fermentation substrate among different depths at species levelS0:表层;S25:25 cm深处;S50:50 cm深处;S75:75 cm深处S0:surface layer of the fermentation substrate.S25:25 cm in depth.S50:50 cm in depth.S75:75 cm in depth
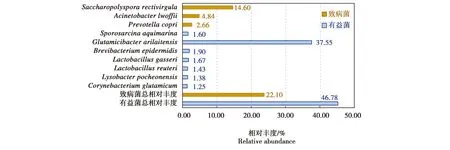
图7 发酵床表层(S0)和25cm深处(S25)种水平上有益菌和致病菌及其相对丰度Fig.7 Species and their relative abundance of probiotics and pathogenic bacteria of the surface layer(S0)and middle layer(S25)of the fermentation substrate
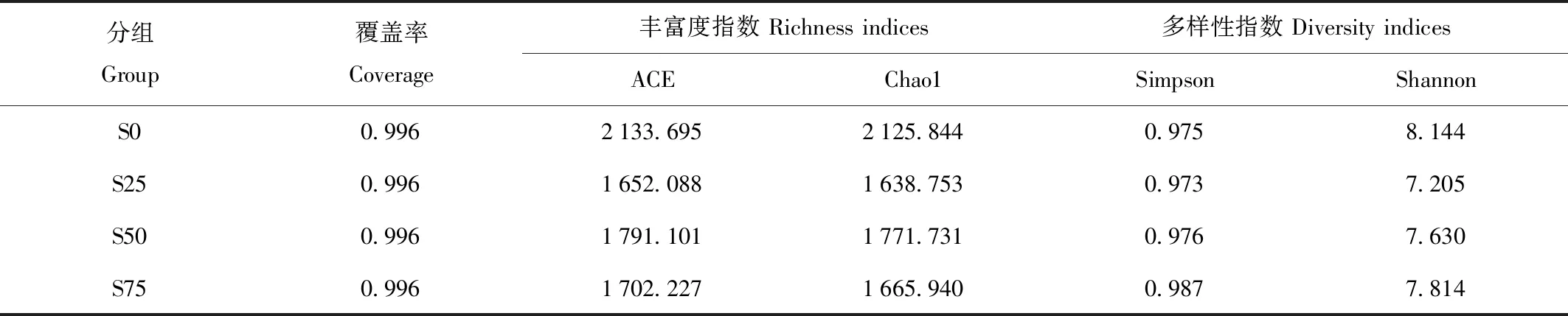
表1 各组样品细菌Alpha多样性指数Tab.1 Indices of bacterial diversity for all samples in each group
2.3.2 Beta多样性分析
主成分分析(PCA,principal component analysis)显示,在诸多因素中,主成分1(PC1)和主成分2(PC2)是影响4组12个样品之间差异性的主要因素,贡献率分别为22.2%和16.67%。每个深度3个发酵床样本分布在相同象限,且较为集中,表明各个重复之间的差异较小,每个深度细菌群落特征是可靠的。图7显示,S25和S50的群落组成较为相似,二者与发酵床底层S75和表层S0的差异性十分显著。同时,S0与S75的差异也非常显著。
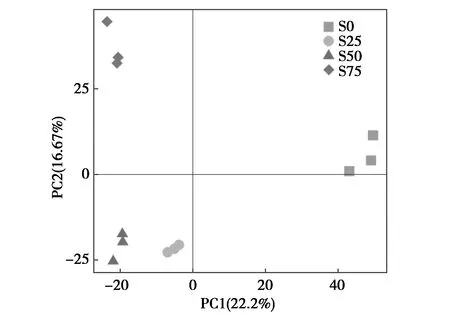
图8 各组样品细菌Beta多样性的PCA分析Fig.8 PCA analysis of beta diversity of samples in each groupS0:表层;S25:25 cm深处;S50:50 cm深处;S75:75 cm深处S0:surface layer of the fermentation substrate.S25:25 cm in depth.S50:50 cm in depth.S75:75 cm in depth
3 讨论
发酵床养殖模式旨在通过益生菌繁殖的占位优势来抑制病原菌的繁殖和传播,利用益生菌发酵产生的升温提高笼舍的地面温度,并使养殖动物在发酵床上健康成长[8]。这3个目的在绿狒狒展馆的发酵床测试中都达到了。
首先,参观通道与外界直接相通,笼舍也有通风窗口,受外界气温的影响较大。监测发现,笼舍内的温度比参观通道温度略高,并且波动规律一致(图2)。但是,发酵床中层温度比笼舍室温高很多,当发酵床进入发酵期时,笼舍温度低于10℃,发酵床的温度在20℃左右,经历迅速升温阶段后,达到顶峰温度45℃,随后缓慢回落,到达稳定期后,维持在28℃—30℃,这在一定程度上有助于保持笼舍温度。
更为重要的是,发酵床保持在28℃—30℃的水平上,绿狒狒每天大部分时间在发酵床上,翻动至25 cm深,始终接受发酵床的热量。相比普通的水泥硬质地面,动物福利有明显的提高。
第二,细菌群落结构分析显示,S0组的OTU数量、Chao1指数和Shannon指数都高于其他3组,即发酵床表层的细菌种类和均匀度都高于其他3个深度(表1),说明此层组成群落结构最为复杂。在发酵床内部,S50组样品无论是物种数量还是均匀度都稍微高于S25和S75组(表1),但差异不如S0与这3组间的差异大。Beta多样性分析也显示,S25和S50组的群落组成较为相似,二者与S75和S0组也各存在显著差异,说明发酵床内部不同深度细菌生长的环境差异较大。
绿狒狒对发酵床上的利用是以挖掘、翻找、采食里面滋生的小虫为主,挖掘深度一般不超过25 cm。因此,基本上处于S0到S25的微生物群落中。所接触的微生物种类相当于二者的总和。文献表明,S0和S25在属水平上,以有益菌占绝对优势,总相对丰度为42.26%;潜在致病菌为主的属仅有4个,总相对丰度为11.08%(图5)。在种水平上相对丰度超过1%的细菌共有10种,其中氨氮降解细菌阿氏节杆菌占有绝对优势,可有效去除铵态氮,减少了臭气产生与扩散,保障了笼舍周围的空气质量[9],其他有益菌对肠道环境的稳定具有重要作用[9-12]。有益菌总相对丰度占46.78%,处于绝对优势地位。
潜在的致病菌是对动物的主要威胁。在绿狒狒可接触到的范围内,发现潜在致病菌的相对丰度占22.10%。其中优势菌干草小多孢菌的丰度达到14.60%.该菌是外源性过敏性肺泡炎(EAA)的病原体之一[13-15]。还有干草小多孢菌、洛菲不动杆菌和普氏菌,主要导致肺炎、免疫力低下和类风湿性关节炎等[16-17]。研究显示,发酵床在发酵期间,内部温度升至45℃以上时,多数病原菌如大肠杆菌(Escherichiacoli)、沙门氏杆菌(Salmonellaspp.)等能被杀死[18],而上述细菌是群落演替到稳定期后检测到的,是动物可接触的常在菌。但是,这些潜在致病菌仅在宿主遭受免疫和生理压力,微生态平衡被打破而过度繁殖才会导致动物患病[19-20]。因此健康动物携带的潜在致病菌常维持在较低水平。在试验期间,绿狒狒始终表现正常,从行为、消化机能(基于粪便的判断)、精神状态等表观方面未发现任何患病迹象。因此,总体上说,发酵床的微生物群落对绿狒狒是安全的。
最后,本实验选在上海动物园,该地区属亚热带季风性气候,实验期间天气较为温暖,外部游客通道的温度为4.6℃—17.1℃,平均9.2℃。动物改变了以往挤在取暖设备附近的行为,转而利用地面,且活动量也大大增加。如果在最冷的1月(日均最高气温5℃,最低气温-5℃,https://www.tianqi.com/qiwen/city-shanghai-winter/),较之传统的硬质地面,发酵床会给动物带来更好的福利。
