仿刺参酶解液抑制黄嘌呤氧化酶活性的研究
2019-08-07孙婷婷李妍妍张迪骏黄忠白张春丹苏秀榕
孙婷婷 李妍妍 周 君 张迪骏 黄忠白 何 珊 李 晔 张春丹 苏秀榕*
(1 宁波大学海洋学院 浙江宁波315211 2 齐鲁师范学院生命科学学院 山东济南250000)
仿刺参(Apostichopus joponicus),属棘皮动物门(Echinodermata)、海参纲(Holothuriodea)、盾手目动物(Aspidochirota)、刺参科(Stichopodidae)、仿刺参属(Apostichopus)[1]。主要分布于我国山东、辽宁和河北沿海,主产于威海、烟台、大连、长岛等地。自古以来,我国居民认为海参不仅是一种佳肴,还是一种滋补佳品,可治疗或辅助治疗某些疾病。向怡卉等[2]研究发现,仿刺参中含有多种营养成分,19 种氨基酸和多种维生素以及丰富的矿物质;苏秀榕[3-4]、张悦容[5]、侯付景[6]等研究发现,仿刺参中含有多种不饱和脂肪酸,为仿刺参的开发利用提供了科学依据。
黄嘌呤氧化酶既能催化次黄嘌呤生成黄嘌呤,进而生成尿酸,又能直接催化黄嘌呤生成尿酸。尿酸是人类嘌呤代谢的终产物,人体的尿酸由体内合成和核酸分解代谢两条途径产生。近年来,随着人们生活水平的提高,高尿酸血症的发病率逐年升高,有研究对居住成都在3年以上的7 288例人群进行调查,结果显示:高尿酸血症患病率男性为19.8%,女性为5.1%[7]。高尿酸血症是由于嘌呤代谢紊乱,使尿酸生成增多和(或)排泄减少所致的代谢性疾病,其患者不仅会继发成为痛风,造成关节疼痛,而且会成为心脑血管疾病、糖尿病、高血压、肾等疾病的危害因素[8]。
目前,治疗高尿酸血症的药物非常有限,主要依赖抑制尿酸合成(XO 抑制剂)和促进尿酸排泄(丙磺舒)两类药物[9],这类药物往往会造成过敏皮疹、白细胞及血小板减少、肝功能损害等不良副作用[10]。国内除了加味茵陈五苓散[11]、桦褐孔菌提取物[12]等少数研究外,未见其它报道。寻找新型、天然、无害的降尿酸保健品成为抗高尿酸血症研究的热点。
海参除具有较广的抗肿瘤及抗凝血的作用[3]外,还具有镇痛解痉,抗疲劳,防治动脉粥样硬化[13]和增强机体免疫功能的作用[14]。仿刺参预防高尿酸血症的研究,国内外未见报道。本文以SD 大鼠为研究对象,探讨仿刺参抑制黄嘌呤氧化酶的活性以及抗高尿酸血症的效果。
1 材料和方法
1.1 材料及试剂
盐渍仿刺参,体质量(35±5)g,宁波奉化博望水产养殖公司;SD 大鼠,(220±10)g,浙江省医学科学院实验动物中心。
木瓜蛋白酶、中性蛋白酶、复合蛋白酶,上海生物制剂厂;尿酸(UA)、血尿素氮(BUN)试剂盒;宁波美康生物技术有限公司;黄嘌呤氧化酶(XOD)试剂盒,南京建成生物工程研究所。
1.2 仪器及设备
7020 全自动生化分析仪,日本日立仪器公司;LuxScanTM10K-A 双通道激光共聚焦扫描仪,北京博奥生物有限公司;S2-81 型不锈钢小型搅拌机,中国九阳股份有限公司;5418R 型离心机,德 国Eppendorf 公 司;NanoDrop 2000C,美 国Thermo Fisher 公司。
1.3 酶解条件的优化
1.3.1 单因素试验 将仿刺参水煮3 次去除体内的NaCl 加适量纯净水绞碎,分别添加木瓜蛋白酶、中性蛋白酶和复合蛋白酶,在各自适宜条件下,进行水解试验,根据水解度筛选酶。以水解度(DH)为指标,选取时间、温度和加酶量进行单因素试验。
1.3.2 响应面试验设计 根据单因素试验确定各因素最佳条件后,以Box-Benhnken 中心组合原理,设计3 因素3 水平试验优化仿刺参水解条件。
1.3.3 酶解液的制备 选取复合蛋白酶,55 ℃条件下酶解仿刺参136 min,并在100 ℃水浴中灭酶10 min,冷冻,待用。
1.4 动物实验
1.4.1 动物饲养和给药 SD 大鼠60 只,雌雄各半,分为空白组(N)、模型组(M)、仿刺参酶解液高剂量组(G1:10 mL/kg·d)、低剂量组(G2:6 mL/kg·d)。除空白组外,其余各组大鼠按每日3 mg/kg·d的剂量灌胃酵母膏淀粉混合液[15],并喂以200 mg/kg·d 氧嗪酸钾,造模,空白和模型对照组按低剂量灌等量蒸馏水。试验期间,各组自由进食、进水,室温保持25 ℃左右,光照昼夜间隔12 h,给药时间28 d。
1.4.2 生化指标检测 各组大鼠腹主动脉取血,3 000 r/min 离心,取上层血清,采用全自动生化分析仪测定血清中尿酸和尿素氮的含量及黄嘌呤氧化酶的活性。
1.5 基因芯片的检测
1.5.1 RNA 的提取和测定 取大鼠肝100 mg,液氮研磨后用Trizol 一步法提取总RNA,通过异丙醇沉淀法浓缩RNA,并进一步采用Nucleo SpinRRNA clean-up 试剂盒对总RNA 进行过柱纯化,用分光光度计定量,甲醛变性胶电泳质检。
1.5.2 cRNA 合成 每5 个大鼠为一组进行总RNA 等量混合,纯化后取2 μg 的mRNA 为模板,使用反转录酶合成第一条cDNA,并加外标,用RNase H 将杂合链中的RNA 切成短片段,用DNA 聚合酶以RNA 短片段为引物延伸,合成第二条cDNA,并纯化双链cDNA。以cDNA 为模板,利用T7 试剂盒合成cRNA;然后用RNA 试剂盒纯化。取2 μg cRNA,随机引物进行反转录,其产物用试剂盒纯化。取上述反转录产物,以随机引物、Cy5-dCTP 和Cy3-dCTP,Klenow 酶进行PCR扩增,标记产物再纯化、抽干。
1.5.3 杂交与清洗 标记的DNA 溶于80 μL 杂交液中 (3×SSC,0.2%SDS,5×Denhart's,25%甲酰胺),于42 ℃杂交过夜。杂交结束后,先在42 ℃含0.2%SDS,2×SSC 的液体中洗5 min,而后在0.2×SSC 中室温洗5 min。玻片甩干后即可用于扫描。
1.5.4 扫描和数据分析 用双通道激光共聚焦扫描仪进行扫描。在芯片上每个基因重复3 次,荧光交换后每个基因重复6 次,用LuxScan3.0 软件进行数据的提取,用t 检验的方法来挑选差异基因。对每个扫描信号的Lowess 归一化的Ratio 值进行统计,删除了荧光信号弱的基因(保留了信号值≥800 的表达基因和400~800 的临界表达基因的信号值)以及芯片上的阴性对照、内标、外标等冗余的数据,从剩下的基因中挑选至少有4 次Ratio 值的基因进行t 检验。计算得到的t 值如果大于0.05,则表明该基因在95%的水准上为差异表达。最后挑选差异表达基因,即用SAM 软件进行分析,FDR 控制在5%以内,再以1.5 倍标准筛选差异表达基因进行片间校正和片内归一化,及信号可信度P 值分析、GO Terms 和Pathway Miner 分析。数据以±s 表示,采用统计软件SPSS 进行方差分析。
1.6 荧光定量PCR 验证差异基因
1.6.1 模板的制备 按步骤1.5.1 节和1.5.2 节得到cDNA。
1.6.2 引物设计 根据基因序列,利用Primer3.0进行RT-qPCR 引物设计,具体引物信息见表1。

表1 RT-qPCR 引物信息Table 1 Primers used in the RT-qPCR
1.6.3 标准曲线的构建 将合成的cDNA 模版稀释成10-3,10-4,10-5和10-64 个浓度梯度作为模板进行RT-qPCR 反应。反应体系总体积为20 μL,其中包括:0.8 μL 上游引物(10 μmol/L)、0.8 μL 下游 引 物 (10 μmol/L)、2 μL 模 板cDNA、10 μL SYBR Premix Ex TaqTM III,并用ddH2O 补足20 μL 体系。反应程序为95 ℃预变性10 s;95 ℃变性10 s、55 ℃退火10 s、72 ℃延伸20 s,共35 个循环。
1.6.4 RT-qPCR 经过标准曲线验证,确定合适的RT-qPCR 反应体系和程序,对cDNA 分别进行目的基因和内参基因的扩增。利用标准曲线算出Ct 值,并利用Comparative Delta-delta Ct 法进行相对定量分析。
2 结果与分析
2.1 单因素酶解试验
在相同温度和pH 值下分别加入2%的木瓜蛋白酶、中性蛋白酶和复合蛋白酶,酶解时间2.5 h。复合蛋白酶的水解度为78%,中性蛋白酶和木瓜蛋白酶的水解度分别为68%和60%,因此确定复合蛋白酶为水解酶。
从图1可以看出,随着时间的延长,水解度先缓慢升高后下降。当水解时间为150 min 时,水解度最大;当水解时间继续延长时,酶解率下降(图1a)。当温度达到55 ℃时,水解度最大;当温度大于55 ℃时,水解度又下降(图1b)。当加酶量大于2%时,酶解率逐渐上升(图1c)。
2.2 响应面法优化酶解工艺
2.2.1 因素选取及分析 选用复合蛋白酶进行仿刺参水解的单因素分析,根据Box-Behnken 中心组合设计原理,以水解度为响应值,选取水解温度、水解时间和加酶量进行响应面试验。试验次数为15,其中析因部分试验次数为12,中心点重复试验次数为3(表2)。
采用响应面法分析试验结果,得到水解度为响应值的回归方程:仿刺参的水解度=80.18+5.54A+2.83B+10.09C-5.91AB+0.94AC-0.13BC-9.99A2-7.85B2-11.09C2。
利用Design Expert 软件对表2的试验结果进行二次多元回归拟合,并进行方差分析,水解度回归方程的显著性检验P<0.05,说明水解度试验中回归模型的预测值均与实际值吻合,模型显著;模型失拟项的P=0.2037(P>0.05),说明未知因素对试验结果干扰很小,即该方程与实际数据之间的拟合性好。另外,由统计学计算得出,模型的R2为0.9061。综上所述,该试验方法可靠,可以用该模型分析和预测试验数据(表3)。

图1 各因素对仿刺参水解度的影响Fig.1 The effects of various factors on the DH of of Apostichopus joponicus

表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken experimental design and results
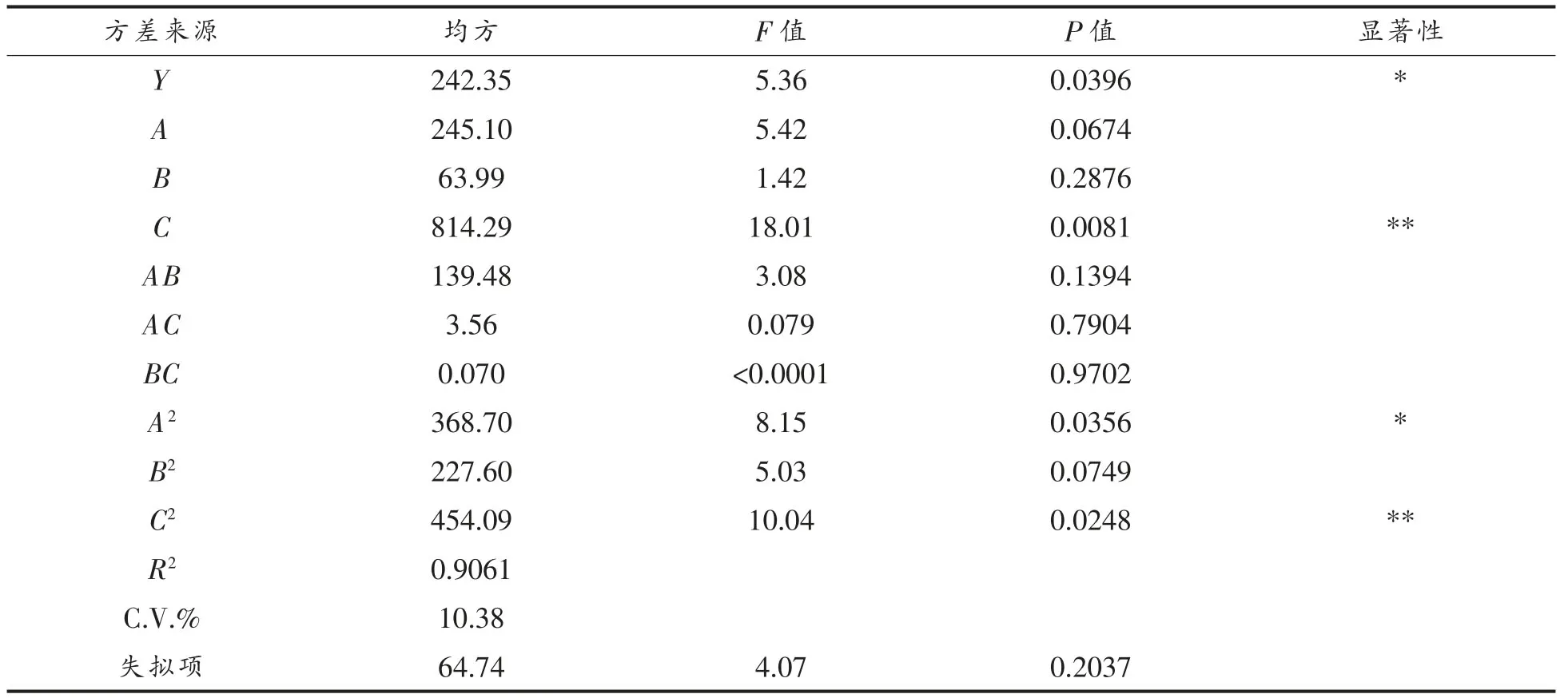
表3 回归模型方差分析Table 3 Variance analysis for the established native regression model
2.2.2 响应面交互作用及优化 通过响应面三维图可对任何两因素的交互影响及各因素对响应值的影响进行分析和评价[16-17],并从中确定最佳因素水平范围[18]。图2a~2c 分别表示了温度和时间、温度和加酶量、时间和加酶量3 组因素对水解度的影响。响应面三维图像的坡度大小反映响应值对该因素的敏感程度[19]。本试验响应面坡度陡峭,表明水解度受各因素影响大。
通过软件分析、计算,得到一组最优条件,对应的编码值分别为A:0.28;B:0.07;C:0.47,与之对应的最佳工艺条件:酶解温度55 ℃,酶解时间136 min,加酶量1.97%。在此条件下,响应面预测的水解度最大值为83.29%。用上述优化条件进行试验,得到的水解度与理论值基本相符(图2)。

图2 各因素相互作用对水解度的影响Fig.2 The effect of the interaction of various factors on the degree of hydrolysis
2.3 血清生化指标
与空白对照组相比,模型组大鼠血清中的UA、XOD 和BUN 水平明显增高,分别达到96.79 μmol/L、14.59 U/L 和5.89 mmol/L,且差异显著(P<0.05)。仿刺参酶解液组大鼠喂药后,血清中的UA和BUN 水平明显下降,分别为67.16 μmol/L 和5.14 mmol/L;XOD 的活性也最小,为13.76 U/L(表4)。
表4 大鼠的血清UA,XOD 和BUN 水平(±s)Table 4 The serum UA,XOD and BUN levels of the rats (±s)

表4 大鼠的血清UA,XOD 和BUN 水平(±s)Table 4 The serum UA,XOD and BUN levels of the rats (±s)
注:a.P<0.05;aa.P<0.01。
?
2.4 基因表达的差异
2.4.1 微阵列芯片分析结果 利用非监督聚类的等阶聚类方法(Hierarchical clustering)比较分析后,利用基因分布的火山图展示基因表达差异性。上调基因少于下调基因(图3)。
利用SAM 进行分析,模型组和酶解液组分别聚为一类,两者区分度高;在相同类别中,同一基因的表达情况基本相同,而不同类别间,同一基因的表达情况差异很大。芯片结果显示,酶解液组和模型组比较,获得差异基因179 个,其中36 个上调,143 个下调(图4)。
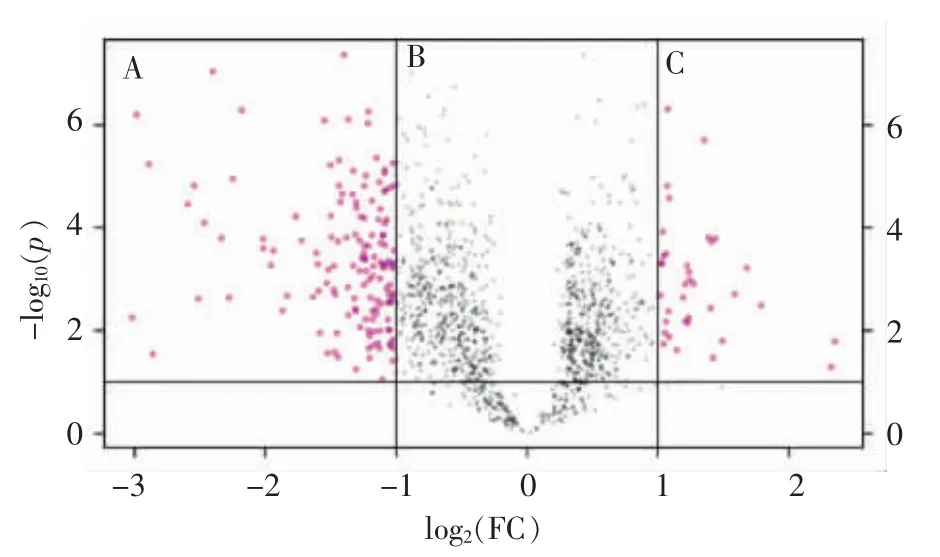
图3 大鼠基因分布的火山图Fig.3 Volcano plots of gene distribution of rats

图4 差异基因聚类分析Fig.4 Cluster analysis of differential gene
2.4.2 差异基因的GO 分析 酶解液组与模型组的差异基因本体联合分析(Gene ontology,GO),在生物学过程分析大鼠差异表达基因发现,与调控相关的基因58.8%,与新陈代谢相关的基因14.7%。从细胞组分分析大鼠差异表达基因,与细胞成分相关的基因19.6%,细胞外基质为17.6%,蛋白质等其它大分子复合物为13.7%。从分子功能过程分析,具有结合功能的基因88.0%,具有催化活性的基因12.0%。痛风与许多基因表达之间存在广泛作用,而这些基因中含有某些关键代谢酶密码,往往可以控制新陈代谢途径中关键酶的表达,从而对整个新陈代谢产生影响。食用仿刺参酶解液后,大鼠与结合功能相关的基因变化非常明显,与调控相关的基因次之。
2.5 RT-qPCR 结果
本方法在稀释为原浓度10-2,10-3,10-4和10-5模版浓度范围内取得了较好的线性关系。对通过基因芯片筛选的部分差异基因的RT-qPCR,分析显示与基因芯片结果一致。如基因Krt14 的相对表达量,在基因芯片结果中酶解液组上调1.33倍,在定量PCR 结果中酶解液组上调1.25 倍。如基因SPP1 的相对表达量,在基因芯片结果中酶解液组下调1.3 倍,在定量PCR 结果中酶解液组下调1.5 倍。从图中可以看出Krt14、Vim、Nime2、Spp1、Oash1h、Adora2a、Cck 这7 个基因,定量PCR结果和基因芯片结果一致;基因Mthfd1 和Gprotein,定量PCR 结果和基因芯片结果不一致;Flt1、Syp、Adss 这3 个基因,定量PCR 结果模型组和酶解液组没有差异,基因芯片结果酶解液组表达量下调(图5)。
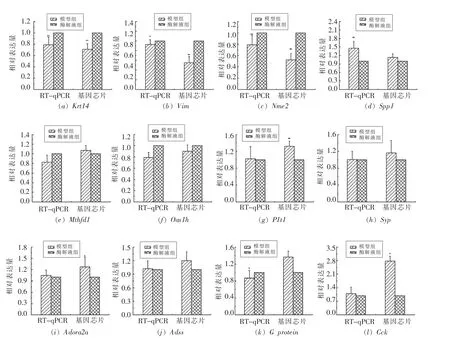
图5 RT-qPCR 结果Fig.5 The result of RT-qPCR
3 讨论
目前,水产动物蛋白质水解,多用复合蛋白酶、中性蛋白酶、木瓜蛋白酶,或者采用两种或几种蛋白酶的复合物。向怡卉等[20]对海参生殖腺水解的研究采用的是复合蛋白酶。实际生产中,酶的选择应综合水解效果、成本等因素。本文比较了复合蛋白酶、中性蛋白酶、木瓜蛋白酶在仿刺参水解过程中的作用效果,发现复合蛋白酶水解效果最好,最佳条件加酶量为1.97%,水解时间136 min,水解温度55 ℃。
黄嘌呤氧化酶(XOD)在尿酸生成过程中发挥着重要作用,直接调控着体内尿酸水平的高低[21]。孔悦等[22]研究表明,在高尿酸血症时,XOD 活性会发生相应变化。不少专家学者对9-苯基鸟嘌呤[23]、羟基胡椒酚等的相关抑制XOD 的作用进行研究,发现抑制XOD 活性是降低尿酸、预防痛风的关键[24-25]。
仿刺参的脂肪含量低,蛋白质含量高,富含人体所需的多种氨基酸。本研究表明,喂食仿刺参后大鼠体内的血尿酸含量明显降低,这说明仿刺参有抑制XOD 活性,改善高尿酸血症的功效。同时,通过对黄嘌呤氧化酶的检测,发现喂食仿刺参后,大鼠体内的XOD 活性明显降低,可以推测,仿刺参的作用机理主要是以黄嘌呤氧化酶为靶点,通过抑制其活性从而减少尿酸的合成,缓解高尿酸血症及其并发症的影响。
实践证明生物体内代谢酶的活性和浓度会因为不同的营养条件而存在较大差异,这主要是由于食物中的营养物质影响了基因的表达。当某种营养素缺失或过多时,在分子水平上表现为某个或某些基因的开放、关闭或表达量的变化,虽然动物的遗传特征不会因为营养素而改变,但它可以通过启动或终止一些基因的表达而改变遗传特征出现的时间框架。
喂食仿刺参后的大鼠基因表达出现明显的差异,下调基因数量明显多于上调基因的数量,差异基因包括能量代谢相关、糖代谢、细胞生长、合成及分解代谢、信号传递因子等。有一半的差异基因与疾病有关。
其中,酪氨酸(Ywhah2)可以使大鼠体内寡腺嘌吟核苷酸减少,从而减少体内尿酸的生成。分裂周期蛋白(Adora2a)可以和其它物质结合生成异源二聚体复合物,参与磷酸化多种蛋白,调节DNA 复制。细胞凋亡(Cck)存在生物过程的各个阶段。分泌性糖蛋白(Spp1)可以促进细胞的粘附和迁移,研究显示Spp1 与疾病的严重程度有重大关系。食用酶解液的大鼠中这4 个基因均表达下调。2′-5′寡腺苷酸合成酶(Osa)在细胞膜受体等作用下,可以形成2-5 寡糖苷酸(2-5A),2-5A 特异性结合核酸内切酶降解病毒的mRNA。食用酶解液的大鼠Osa 表达上调。路径分析中可以看出,高尿酸血症与肥胖、糖代谢、肿瘤有关,这与张长青等[26]、韩睿等[27]的研究结果一致。另有研究表明,痛风或可降低阿尔茨海默病的发病率,在大鼠基因芯片路径分析中可以看出糖代谢和阿尔茨海默病相关基因差异明显。
结合前期差异基因结果和RT-qPCR 结果,对仿刺参酶解液抑制黄嘌呤氧化酶活性的作用机制进行归纳。果糖1,6-二磷酸醛缩酶(Aldoa)是糖异生途径中的关键酶催化1,6-二磷酸果糖生成6磷酸果糖。大鼠进食蛋白含量很高的仿刺参酶解液之后,肝中糖原增加,糖的异生作用增强,因而氨基酸成糖成为氨基酸代谢的主要途径。由基因芯片结果可以看出,果糖1,6-二磷酸醛缩酶基因上调明显,故糖异生作用增强,氨基酸代谢主要通过糖异生转化为糖,通过其它代谢途径生成嘌呤、嘧啶的量减少。减少了大鼠体内嘌呤的生成,缓解高尿酸血症。
