碱性条件下大豆11S球蛋白溶液的性质和分子结构
2019-08-07朱建宇赵城彬江连洲谢凤英
朱建宇 赵城彬 江连洲 谢凤英*
(1 东北农业大学食品学院 哈尔滨150030 2 吉林农业大学食品科学与工程学院 长春130118)
大豆自古以来是我国居民饮食的重要组成部分,是植物蛋白的主要资源之一。与动物蛋白相比,大豆蛋白中必需氨基酸的比例更适合人体需要,其精氨酸含量比牛奶高,而且不含胆固醇。大豆蛋白不仅具有较高的营养价值,而且具有多种功能特性,如溶解性、起泡性、凝胶性和乳化性等,这些功能特性在食品生产加工中具有重要的作用[1]。蛋白的功能特性不仅与蛋白本身结构有关,加工过程中由于环境因素的改变引起的蛋白结构改变也将对其功能特性产生显著影响[2-3]。大豆蛋白在生产加工过程中通常会受到热处理、酸碱处理和盐处理等,不同的加工处理会引起蛋白质结构发生改变。事实上,蛋白质结构性质(分子尺寸、亚基组成、空间结构等)与环境因素(温度、pH 值和离子强度等)对蛋白质的功能特性均有影响。近年来,大多数研究主要以大豆分离蛋白为对象,探讨理化因素对其结构和功能特性的影响,很少对β-伴大豆球蛋白(7S)和大豆球蛋白(11S)的结构和功能特性进行研究,并缺乏特定条件下大豆球蛋白空间结构和溶液性质的信息。大豆蛋白质主要由7S 球蛋白和11S 球蛋白组成[4]。11S 球蛋白具有紧密的分子结构,多数活性基团被包裹在球状结构内部,一般的处理方法很难使其球状结构展开,从而有效提高其功能特性。与7S 球蛋白相比,11S 球蛋白是限制大豆蛋白应用和改性的关键因素[5]。
目前,关于碱性条件下大豆11S 球蛋白溶液性质和分子结构的研究鲜有报道。本试验对碱性条件下大豆11S 球蛋白溶解性、表面疏水性、Zeta电位以及粒径进行测定,同时采用拉曼光谱技术对蛋白质的分子结构进行研究,为大豆蛋白功能性质的改善及功能性大豆蛋白产品的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆(东农46),东北农业大学大豆研究所;8-苯胺基-1-萘磺酸 (ANS),美国Sigma 公司;Lowry 法蛋白质含量测定试剂盒,上海荔达生物科技有限公司;其它化学试剂均为国产分析纯级。
1.2 仪器与设备
低温高速离心机,美国Beckman 公司;AKTA-蛋白质纯化仪,美国GE 公司;F-4500 荧光分光光度计,日本Hitachi 公司;ZetaPALS-Zeta 电位仪、ZetaPALS-激光粒度分析仪,美国布鲁克海文仪 器 公 司;PerkinElmer Raman Station 400 拉 曼光谱仪,美国PE 公司。
1.3 试验方法
1.3.1 大豆11S 球蛋白的制备 大豆11S 球蛋白的制备根据Nagano 等[6]的方法。大豆→脱皮→粉碎→过60 目筛→正己烷脱脂→脱脂大豆粉→与水混合(料液比1∶15)→调节pH 7.5→提取2 h→离心分离(10 000×g,15 min)→上清液→添加亚硫酸钠 (0.98 g/L)→提取1 h→调节pH 6.4→4 ℃过夜→离心分离(12 000×g,20 min)→沉淀→冻干→大豆11S 球蛋白粗提物。
应用AKTA-蛋白质纯化仪和HiLoad 16/60 Superdex 200 prep grade 凝胶制备级预装柱,对大豆11S 球蛋白粗提物进行纯化,并进一步采用SDS-PAGE 分析蛋白质组成,通过光密度扫描测得大豆11S 球蛋白纯度约为92%。
1.3.2 不同pH 值缓冲溶液的配制 配制0.01 mol/L 的pH 7~9 的Tris-HCl 缓冲液,pH 10 的甘氨酸-HCl 缓冲液,pH 11~12 的NaOH-NaH2PO4缓冲液。
1.3.3 溶解性的测定 参考Samoto 等[7]的方法。称取100 mg 大豆11S 球蛋白样品分散于10 mL去离子水中,磁力搅拌30 min 后,在12 000×g 下离心20 min。上清液经适度稀释,采用Lowry 法测定稀释后的上清液中蛋白质含量,以牛血清白蛋白为标准物制作标准曲线。蛋白质的溶解度表示为上清液中蛋白的质量与样品中总蛋白质量的比值。

1.3.4 表面疏水性的测定 采用ANS 荧光探针法测定蛋白质表面疏水性[8]。将大豆11S 球蛋白样品溶于0.01 mol/L 磷酸盐缓冲液中配成10 mg/mL的蛋白溶液,室温条件搅拌1 h 后在10 000×g 下离心30 min,上清液用相同的磷酸盐缓冲液稀释至0.07~0.67 mg/mL (采用Lowry 法测定蛋白浓度)。分别取不同浓度的样品溶液4 mL,加入8 mmol/L 的ANS 溶液40 μL,充分振荡混匀后静置3 min,测定样品的荧光强度(FI)。激发波长λex为390 nm,发射波长λem为470 nm,夹缝宽均为5 nm。以蛋白质浓度为横坐标,荧光强度为纵坐标作图,曲线初始斜率即为蛋白质的表面疏水性(H0)。
1.3.5 Zeta 电位的测定 根据Crudden[9]的测定方法,采用ZetaPlus Zeta 电位仪测定大豆11S 球蛋白溶液的Zeta 电位。将11S 球蛋白样品用缓冲液稀释至质量分数为0.2%,上样体积为1 mL。Zeta电位测定条件:聚苯乙烯池(1 cm)若干,铂电极(0.45 cm2,间距0.4 cm)一对。温度为25 ℃,温度平衡时间为2 min。
1.3.6 粒径分布的测定 根据李杨等[10]的测定方法,采用ZetaPlus 粒度分析仪测定大豆11S 球蛋白的平均粒径分布。将11S 球蛋白样品用磷酸缓冲液稀释至蛋白质量分数为0.2%的溶液。过0.45 μm 水系醋酸纤维素滤膜,室温条件下测量。
1.3.7 拉曼光谱的测定 参考张萍等[11]的测定方法,将大豆11S 球蛋白用缓冲溶液配制成质量浓度为100 mg/mL 的溶液进行拉曼测定。激发光波长设定为785 nm,激光功率为300 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10 次,4次扫描进行累加。拉曼图谱处理:谱图基线校正、谱峰查找采用ACD Labs V12 软件,以苯丙氨酸【(1 003±1)cm-1】作为归一化因子,以此作为各拉曼峰强度变化的依据,得到不同条件下大豆11S球蛋白的拉曼光谱,采用Raman Spectral Analysis Package Version 2.1 软件计算大豆11S 球蛋白各结构的百分含量。
1.4 统计分析
每个样品重复3 次试验,ANOVA 差异显著性分析利用SPSS V17.0 软件完成,P<0.05 为显著性差异,采用Origin8.0 软件作图。
2 结果与分析
2.1 碱性条件下大豆11S 球蛋白的溶解性和表面疏水性分析
图1为碱性条件下大豆11S 球蛋白的溶解性和表面疏水性,由图1可知,碱性(pH 7.0~12.0)条件下,随着pH 值的增加,大豆11S 球蛋白的溶解性逐渐增强,表面疏水性(H0)逐渐降低,这表明碱性条件下蛋白质的H0与溶解性呈负相关。Paraman 等[12]在对大米蛋白理化性质的研究中发现溶解性与H0呈负相关,这与本研究的结果一致。当pH 值由7.0 增加到12.0 时,蛋白分子间静电斥力增加,大豆11S 球蛋白空间结构在一定程度上去折叠展开,同时亚基之间二硫键发生断裂,增强了蛋白质的水合作用,阻止蛋白质发生聚集[13],导致溶解性增强;同时碱性pH 作用会诱导蛋白分子发生重排,使疏水基团位于蛋白分子内部,导致H0降低。此外,高溶解性蛋白质表面暴露的疏水残基较少[14],也可能导致蛋白质H0降低。
由于食品加工过程中不涉及极端酸碱处理,且在pH 10.0~12.0 范围内,大豆11S 球蛋白的溶解性和H0的变化不显著,因此,选取pH 7.0~10.0范围进行大豆11S 球蛋白的Zeta 电位、粒径以及分子结构研究。
2.2 碱性条件下大豆11S 球蛋白的Zeta 电位和粒径分析
Zeta 电位是表征蛋白质带电性质和分散稳定性的重要参数,一般来说,蛋白质表面带正电荷的氨基酸多于带负电荷的氨基酸,其蛋白质溶液Zeta 电位为正值;反之,蛋白质表面带负电荷的氨基酸多于带正电荷的氨基酸时,蛋白质溶液Zeta电位呈负值[15]。溶液的pH 值会影响蛋白质分子表面带电基团的离子化程度,引起蛋白质分子表面带电氨基酸发生重新排布,导致蛋白溶液的Zeta电位发生改变[16]。采用Zeta 电位仪对碱性条件下大豆11S 球蛋白溶液的Zeta 电位进行测定,结果如图2所示。在所测试的pH 7.0~10.0 范围内,pH呈碱性,所有蛋白样品的Zeta 电位均为负值,说明碱性条件下大豆11S 球蛋白表面羧基解离,以负离子形式存在。随着pH 值的升高,大豆11S 球蛋白溶液Zeta 电位的绝对值逐渐增大。分析原因在于pH 通过影响蛋白质侧链羧基及氨基的解离程度来影响蛋白表面所带电荷[17]。随着pH 值的升高,蛋白质分子侧链上的极性基团(如羧基、羟基和氨基) 更多的暴露于大豆球蛋白分子表面并逐渐发挥作用,使大豆球蛋白表面所带的电荷增多,导致溶液Zeta 电位的绝对值增加。
采用激光粒度分析仪测定碱性条件下大豆11S 球蛋白的粒径分布,平均粒径结果如图2所示。在pH 7.0~10.0 的范围内,大豆11S 球蛋白质溶液的平均粒径分布在89.1~111.8 nm 范围内,随着pH 值的升高,平均粒径整体呈下降趋势,在pH 9 时略有波动。通常蛋白质溶液的粒径大小取决于蛋白质的聚集程度[18],由于溶液pH 值的改变影响了大豆球蛋白分子表面的电荷分布,使静电相互作用增大,分子间斥力增强,蛋白分子处于相对稳定状态,不易发生聚集,从而使溶液中11S 球蛋白平均粒径降低。此外,蛋白溶液中单个蛋白质分子和大粒径的可溶性聚集物同时存在,这可能就是导致碱性条件下(pH 7.0~10.0)大豆11S 球蛋白的平均粒径呈现波动变化的一个原因。
综合Zeta 电位和平均粒径分析可知,在碱性条件下,大豆球蛋白表面负电荷增多,更多同性电荷之间的静电排斥作用使蛋白质溶液稳定性增强,降低了蛋白质之间的聚沉几率,蛋白质的溶解性增大,同时更多的极性氨基酸暴露于蛋白质表面可能会导致H0降低。

图1 碱性条件下大豆11S 球蛋白的溶解性和表面疏水性Fig.1 Solubility and surface hydrophobicity of 11S glycinin at alkaline condition
2.3 碱性条件下大豆11S 球蛋白的拉曼光谱分析
采用拉曼光谱对蛋白质的二级结构及疏水微环境进行分析,以拉曼光谱特征吸收峰的相对强度来表示蛋白质分子结构变化的定量信息[19]。图3为碱性条件下大豆11S 球蛋白的拉曼光谱图。由于拉曼光谱图中特征峰的强度与蛋白质中特定基团或化学键的数目成正比,当特征峰的强度发生改变时,说明蛋白质分子中特定基团或化学键的数目发生了改变[20]。

图3 碱性条件下大豆11S 球蛋白的拉曼光谱图Fig.3 Raman spectra of 11S glycinin at alkaline condition
2.3.1 碱性条件下大豆11S 球蛋白二级结构分析 采用Raman Spectral Analysis Package Version 2.1 软件对大豆11S 球蛋白的拉曼图谱二级结构进行定量计算,利用酰胺I 带和酰胺III 带拟合大豆11S 球蛋白的二级结构含量,结果如表1和表2所示。

表1 酰胺I 带拟合碱性条件下大豆11S 球蛋白二级结构含量Table 1 Secondary structure contents of 11S glycinin by amide I bands at alkaline condition
由表1利用酰胺I 带拟合结果可以看出,在pH 7.0~10.0 范围内,随着pH 值的升高,α-螺旋结构含量逐渐增加,β-折叠和无规卷曲结构含量逐渐降低,pH 值的改变对β-转角结构含量影响不显著。由表2利用酰胺III 带拟合结果可以看出,在pH 7.0~10.0 范围内,随着pH 值的升高,α-螺旋结构含量逐渐增加,无规卷曲结构含量逐渐降低,pH 值的改变对β-折叠和β-转角结构含量影响不显著。综上所述,根据酰胺I 带和酰胺III带大豆11S 球蛋白二级结构含量变化可知,虽然利用酰胺I 带和酰胺III 带分析出来的大豆11S球蛋白二级结构各组分含量存在一定差异,但pH对α-螺旋结构和无规卷曲结构的影响结果是一致的。通过与表面疏水性变化规律相关性分析表明,在碱性(pH 7.0~10.0)条件下,大豆11S 球蛋白的表面疏水性与α-螺旋结构含量呈显著负相关(r=-0.786,P<0.05),与无规卷曲结构含量呈显著正相关(r=0.792,P<0.05)。魏冬旭等[21]采用圆二色谱研究pH 值对大豆11S 球蛋白二级结构的影响,得到的结果与本文研究结果一致。

表2 酰胺III 带拟合碱性条件下大豆11S 球蛋白二级结构含量Table 2 Secondary structure contents of 11S glycinin by amide III bands at alkaline condition
2.3.2 碱性条件下大豆11S 球蛋白氨基酸侧链分析 蛋白质拉曼光谱的850 cm-1和830 cm-1谱峰是酪氨酸残基的对位取代苯的有关振动,由于环的呼吸振动和面外弯曲倍频之间的费米共振,两谱峰成对出现。两峰的强度比(I850/I830)为费米共振线,可用来表征酪氨酸残基的包埋与暴露情况[22]。当I850/I830比值为0.3~0.5 时,酪氨酸残基趋向于“包埋”态;当I850/I830比值为1.25~1.40 时,酪氨酸残基趋向于“暴露”态;当0.5<I850/I830<1.25 时,酪氨酸残基一部分暴露于蛋白质分子表面,一部分包埋在蛋白质内部。可根据I850/I830的值计算包埋在分子内部和暴露在分子表面的酪氨酸残基的分子数N[23]。表3为碱性条件下酪氨酸与色氨酸残基包埋/暴露情况。由表3可以看出,I850/I830比值在0.5~1.25 范围内,表示酪氨酸残基一部分暴露于蛋白质分子表面,一部分包埋在蛋白质分子内部。在碱性(pH 7.0~10.0)条件下,随着pH 值的升高,I850/I830及N暴露∶N包埋的比值均有所下降,表明大豆11S 球蛋白分子中的酪氨酸残基趋于“包埋”态。酪氨酸残基内卷于蛋白质分子内,疏水性氨基酸基团的包埋导致大豆11S 球蛋白H0降低。
760 cm-1附近的拉曼谱带归属为色氨酸侧链,色氨酸拉曼光谱强度(I760)可以反映色氨酸残基微环境的极性,色氨酸谱带的强度越高,表明越多的色氨酸残基由暴露于分子外部转向包埋于分子内部。由表3可以看出,随着pH 值的升高,大豆11S球蛋白分子内的色氨酸残基拉曼光谱强度逐渐增大,表明处于大豆11S 球蛋白分子外部的色氨酸残基趋近于“包埋”态,蛋白质的空间结构变的更加紧密,这与酪氨酸费米共振I850/I830的分析结果一致。

表3 碱性条件下酪氨酸与色氨酸残基包埋/暴露情况Table 3 Embedding/exposure of tyrosine and tryptophan residues at alkaline condition
以上结果表明,大豆11S 蛋白H0与其疏水性氨基酸残基的暴露密切相关。疏水性氨基酸残基的暴露程度越大,暴露数量越多,大豆蛋白H0越高。反之,疏水性氨基酸残基的暴露程度越小,暴露数量越少,大豆蛋白H0越低。可见,大豆蛋白疏水基团的暴露程度是决定其H0强弱的主要原因。
2.3.3 碱性条件下大豆11S 球蛋白二硫键分析二硫键是维持蛋白质三级结构的重要作用力,蛋白质拉曼光谱500~550 cm-1是二硫键伸缩振动的特征频率,可以得到大豆11S 球蛋白分子内二硫键构象变化的信息。一般情况下二硫键有3 种构型,500~510 cm-1附近谱峰归属为扭曲-扭曲-扭曲(g-g-g)构型,515~525 cm-1附近谱峰归属为扭曲-扭曲-反式(g-g-t)构型,535~545 cm-1附近谱峰归属为反式-扭曲-反式(t-g-t)构型[24]。为了研究碱性条件对大豆11S 球蛋白二硫键特征拉曼光谱峰强度和位置的影响,采用Peak Analyzer 软件进行多峰值Guassina 拟合,得到碱性条件下大豆11S 球蛋白二硫键构型相对含量的变化,结果如图4所示。从图4可以看出,在碱性(pH 7.0~10.0)条件下,大豆11S 球蛋白的二硫键构型发生了改变,g-g-g 构型相对含量先增加后降低,g-g-t构型相对含量先降低后增加,t-g-t 构型相对含量总体降低,而碱性pH 处理后大豆11S 球蛋白二硫键构型的改变呈现出一种非线性的变化趋势。虽然碱性条件下二硫键构型未呈规律性变化,但这种非线性的变化趋势也证明了在pH 7.0~10.0处理下,大豆11S 球蛋白构象发生改变,可能发生蛋白质亚基的解离和聚合。
3 结论
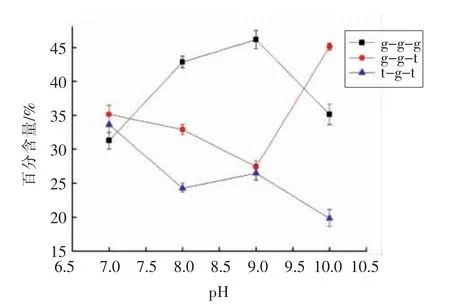
图4 碱性条件下大豆11S 球蛋白二硫键构型的变化Fig.4 Change in conformation of disulfide bond of 11S glycinin at alkaline condition
碱性(pH 7.0~12.0)条件下,随着pH 值的增加,大豆11S 球蛋白的溶解性增加,表面疏水性(H0)降低,Zeta 电位的绝对值增大,平均粒径整体呈下降趋势,这表明在碱性条件下,大豆球蛋白表面负电荷增多,更多同性电荷之间的静电排斥作用使蛋白质溶液稳定性增强,降低了蛋白质之间的聚沉几率,使蛋白质的溶解性增加,同时更多的极性氨基酸暴露于蛋白质表面可能会导致H0降低。拉曼光谱分析表明随着pH 值的升高,α-螺旋结构含量增加,无规卷曲结构含量降低,蛋白分子中的酪氨酸和色氨酸残基趋于“包埋”态,说明疏水性氨基酸基团的包埋导致大豆11S 球蛋白H0降低。碱性条件下大豆11S 球蛋白的二硫键构型发生了改变,证明了在pH 7.0~10.0 处理下,蛋白质构象发生改变,可能发生蛋白质亚基的解离和聚合。
