间作小麦对西瓜生长及根际土壤酶和微生物的影响
2019-08-03吕慧芳别之龙
吕慧芳 别之龙


摘 要:合理的间作可以有效缓解西瓜连作障碍问题,有利于西瓜生产的可持续发展。为了探讨西瓜与小麦间作对西瓜生长的影响,采用盆栽基质模拟连作土壤,设置小麦和西瓜根系的不同分隔方式(西瓜和小麦根系间作不分隔、用尼龙网分隔、用塑料膜分隔,单种西瓜为对照,),研究不同分隔方式下间作小麦对西瓜根际土壤生物学性状的影响,西瓜定植前接入西瓜专化型尖孢镰刀菌。结果表明,西瓜与小麦根系不分隔处理和用尼龙网分隔处理下西瓜植株的生理参数(叶绿素含量、根系活力、叶片SOD和CAT活性)、土壤酶活性(蔗糖酶和磷酸酶)、土壤细菌的数量,均优于对照和用塑料膜分隔處理;另一方面,西瓜与小麦根系不分隔处理和用尼龙网分隔处理下西瓜植株POD活性、MDA含量、土壤真菌和尖孢镰刀菌的数量均低于对照和用塑料膜分隔处理;但西瓜和小麦根系不同分隔处理和对照处理西瓜植株的生物量(株高和干质量)和土壤放线菌的数量无显著差异。综上,小麦与西瓜间作能增强西瓜植株的生理抗性,提高西瓜根际土壤酶活性,改善根际微生物种群结构。
关键词: 西瓜;小麦;间作;抗氧化酶;土壤酶;土壤微生物
Abstract:Appropriate intercropping could effectively solve the obstacle of continuous cropping of watermelon, it is beneficial to the sustainable development of watermelon. To explore the effect of intercropping wheat on growth of watermelon, pot substrates as simulation of continuous cropping soils were conducted to investigate the effects of wheat intercropping on soil biological characteristics in the rhizosphere of watermelon in four different root separation treatments(watermelon monoculture CK, watermelon and wheat intercropping non separation, watermelon and wheat intercropping with mesh separation, and watermelon and wheat intercropping with film separation). Pot substrates were inoculated with FON spores before watermelon transplanting. The results showed that watermelon and wheat roots non separation and mesh separation treatments on watermelon plants physiological characteristics(chlorophyll content, root vigor, leaf SOD and CAT activities), soil enzyme activities (sucrase and phosphatase) and soil bacteria number were superior to the watermelon monoculture(CK),watermelon and wheat roots with film separation(FS) treatments. On the other hand, watermelon and wheat roots non separation and mesh separation treatments on watermelon plants POD activity, MDA content, soil fungi and Fusariu oxysporum f. sp. niveum number were lower than the watermelon monoculture(CK), watermelon and wheat roots with film separation(FS). However, no significant differences were found on watermelon plants biomass (plant height and dry weight)and soil actinomycetes number between different treatments. In conclusion, wheat and watermelon intercropping enhanced the physiological resistance of watermelon plant and improved soil enzyme activity, microbial population structure in the rhizosphere of watermelon.
Key words: Watermelon; Wheat; Intercropping; Antioxidase; Soil enzyme; Soil microorganism
西瓜是我国重要的瓜果类作物,连作会导致枯萎病等土传病害的发生,严重威胁西瓜产业的可持续发展[1]。近年来,间作能够有效减轻连作障碍[2-3],已经取得了一定成效。前人研究发现,西瓜与小麦间作时不同根系分泌物的相互作用可能是间作提高西瓜对枯萎病抗性的重要原因,西瓜根系分泌物促进西瓜专化型尖孢镰刀菌的产孢量、孢子萌发和菌丝生长[4-5];相反,小麦根系分泌物抑制西瓜专化型尖孢镰刀菌的产孢量、孢子萌发和菌丝生长,且间作小麦能促进西瓜生长,提高西瓜抗枯萎病能力,减轻西瓜枯萎病的发生[5-6]。土壤酶活性的提高和土壤微生物种群结构多样性的增加能有效抑制植物土传病害的发生[7-8]。除了根系分泌物的作用外,前人研究发现,合理的间作、伴生、轮作和套种可以改善作物生理状况、土壤酶活性和微生物种群结构,从而提高植株抗性,抑制土传病害的发生,有效缓解连作障碍[5-10]。
小麦—西瓜间作种植模式是我国西瓜露地主产区河南、湖北、安徽、山东、江苏等地区的主要栽培模式,这种兼顾粮食生产和农民增收的栽培模式是缓解西瓜连作障碍的有效方式,也是西瓜产业可持续发展的一条可行途径。然而,在小麦—西瓜间作条件下,小麦和西瓜根系生长是否对土壤酶活性和根际微生物具有影响还缺乏足够证据。笔者通过模拟西瓜连作土壤盆栽试验,并人工接种西瓜尖孢镰刀菌,研究小麦—西瓜间作体系中小麦与西瓜根系的不同分隔方式对土壤酶活性和土壤微生物种类的影响,探索小麦—西瓜间作体系对西瓜生长和根际环境的影响,为小麦—西瓜间作种植模式的应用提供理论依据。
1 材料与方法
1.1 材料
供试西瓜‘早佳(8424)由新疆农业科学院哈密瓜研究中心提供;小麦‘鄂麦18(E18)由湖北省农业科学院粮食作物研究所提供,E18小麦根系分泌物能抑制西瓜专化型尖孢镰刀菌的生长[5]。供试菌株:西瓜专化型尖孢镰刀菌(Fusariumoxysporumf. sp. niveum)。取样时间为定植后20 d。
1.2 试验设计
参照任丽轩[11]的方法设置小麦和西瓜根系的不同分隔方式处理。处理1(CK):西瓜单作(每盆只种植西瓜,不种植小麦);处理2:西瓜和小麦根系之间不分隔(每盆种植西瓜和小麦,2者的根系不分隔,简称不分隔NS);处理3:西瓜和小麦根系之间用尼龙网分隔 (每盆种植西瓜和小麦,西瓜和小麦的根系之间用孔径30 μm尼龙网隔开,养分和根系分泌物可以通过,简称尼龙网分隔MS);处理4:西瓜和小麦根系之间用塑料膜分隔(每盆种植西瓜和小麦,西瓜和小麦的根系用塑料薄膜隔开,养分和根系分泌物不能通过,简称塑料薄膜分隔FS)。盆钵直径34 cm,高24 cm,每盆装栽培基质8 L,每处理设30盆,3次重复。2014年4月29日,西瓜幼苗长到3叶1心后定植于盆钵中,小麦种子于4月20日直接播种于盆钵中。为了模拟连作土壤,在西瓜植株定植前接入106 CFU·mL-1的西瓜专化型尖孢镰刀菌孢子悬浮液10 mL。每盆种植西瓜1株,小麦20株,间距为6 cm。采用霍格兰营养液配方进行肥水管理。
西瓜定植20 d后取西瓜的叶片和根系,并收集西瓜根系上的基质样品,每个重复取5株,于-80 ℃保存,用于植株生理指标、土壤酶活性和土壤微生物数量的测定。
1.3 方法
1.3.1 形态指标测定 株高采用卷尺进行测定;植株干质量采用电子分析天平测定。
1.3.2 叶绿素含量和根系活力测定 叶绿素含量采用96%乙醇浸提比色法测定;植物根系活力采用氯化三苯基四氮唑(TTC)法测定[12]。
1.3.3 抗氧化酶和丙二醛含量测定 蛋白质含量参考考马斯亮蓝法[13]测定;过氧化氢酶(CAT)活性、過氧化物酶(POD)活性和超氧化物歧化酶(SOD)活性参考Zhen等[14]的方法测定;MDA含量采用硫代巴比妥酸比色法测定[12]。
1.3.4 土壤酶活性测定 土壤脲酶活性采用苯酚钠-次氯酸钠比色法测定;土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定;土壤蛋白酶活性采用茚三酮比色法测定;土壤磷酸酶活性采用磷酸苯二钠比色法测定[15]。
1.3.5 土壤微生物种类与数量的测定 釆用稀释平板法计数根际土壤中的微生物。采用五氯硝基苯(PCNB)培养基进行尖孢镰刀菌计数;采用马丁氏(Martin)琼脂培养基进行真菌计数;采用牛肉膏蛋白胨培养基进行细菌计数;采用高氏(Gause)1号培养基进行放线菌计数。
1.4 数据分析
釆用Microsoft Excel 2007进行数据处理,采用SPSS 19.0统计软件进行方差分析。
2 结果与分析
2.1 根系不同分隔方式对西瓜植株生长、叶绿素含量和根系活力的影响
由表1可知,NS和MS处理下西瓜植株的株高和干质量较CK和FS处理有所增加,差异不显著。各处理西瓜叶片叶绿素含量为NS>MS>FS>CK,NS和MS处理的西瓜叶片叶绿素含量显著高于FS和CK处理,分别高出CK 11.61%和10.32%。根系活力的大小能够反映植株抵御生物或者非生物胁迫的强度。NS和MS处理的西瓜根系活力显著高于CK,分别高出21.84%和23.55%。
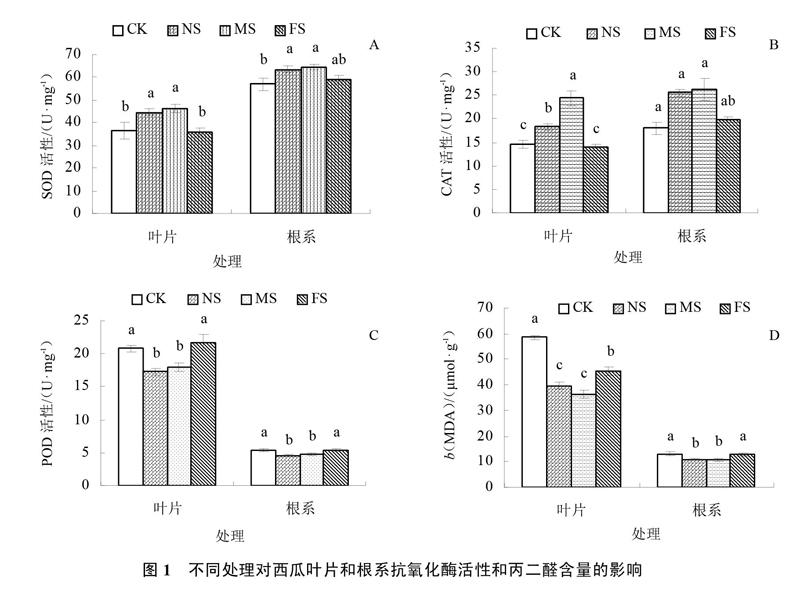
2.2 根系不同分隔方式对西瓜植株抗氧化酶活性和丙二醛含量的影响
各处理西瓜叶片SOD活性为MS>NS>CK>FS,NS和MS处理的西瓜叶片SOD 活性显著高于FS和CK,分别高出CK 22.64%和27.40%(图1-A)。MS处理的西瓜叶片CAT活性显著高于NS、FS和CK,分别高出33.32%、73.09%和67.43%。NS和MS处理的西瓜根系CAT活性显著高于CK处理,分别高出42.37%和46.82%(图1-B)。FS和CK处理的西瓜叶片POD 活性分别高出NS 25.56%和20.57%,分别高出MS 21.03%和16.22%,均达到显著差异;各处理西瓜根系POD 活性为FS>CK>MS>NS,FS和CK处理的西瓜根系POD 活性显著高于MS和NS处理(图1-C)。NS和MS处理的西瓜叶片和根系MDA含量均显著低于FS和CK处理(图1-D),NS和MS处理西瓜叶片MDA含量分别低于CK 32.01%和38.01%。
2.3 根系不同分隔方式对西瓜根际土壤酶活性的影响
由图2可知,西瓜根际土壤脲酶活性为MS>FS>NS>CK,MS处理的西瓜根际土壤脲酶活性显著高于其他处理(图2-A)。西瓜根际土壤蔗糖酶活性为NS>MS>FS>CK,NS和MS处理的西瓜根际土壤蔗糖酶活性均显著高于FS和CK处理(图2-B),分别高出CK30.79%和29.30%。NS处理西瓜根际土壤蛋白酶活性均显著高于MS、CK和FS处理(图2-C),分别高出25.16%、32.82%和43.84%。NS处理的西瓜根际土壤磷酸酶活性显著高于CK和FS(图2-D),分别高出44.71%和33.96%。
2.4 根系不同分隔方式對西瓜根际土壤微生物数量的影响
由图3可知,不同分隔处理的西瓜根际土壤细菌的数量为NS>MS>CK>FS(图3-A),NS处理西瓜根际土壤细菌数量是CK处理的1.58倍,FS处理的1.60 倍。不同分隔处理的西瓜根际土壤放线菌的数量为MS>NS>CK>FS,不同处理间差异不显著(图3-B),表明分隔方式对放线菌数量的影响无明显差异。不同分隔处理对西瓜根际土壤真菌和尖孢镰刀菌数量的影响一致(图3-C~D),CK和FS处理的西瓜根际真菌和尖孢镰刀菌数量显著高于NS和MS处理。
3 讨 论
合理的间作能促进作物生长并有利于作物增产[2,10]。在小麦与西瓜伴生体系中,‘D125小麦伴生通过提高西瓜叶片叶绿素a含量和叶绿素a/b值,从而提高光合效率[16]。在本试验中,与CK和FS相比,NS和MS处理显著提高了西瓜叶片叶绿素含量,但是西瓜植株的株高和干质量方面没有明显变化,可能是小麦—西瓜间作初期对西瓜的生长影响较小,通过提高叶片叶绿素含量促进净光合速率的提高来提高植株干物质的积累,这种作用不显著。植物受到生物胁迫时,根系活力反映了其抗病能力。番茄与大蒜轮作,番茄的根系活力得到明显提高[17]。NS和MS处理西瓜根系活力显著高于西瓜单作,说明间作小麦可提高西瓜的根系活力,进而增强西瓜对枯萎病的抗病能力。
抗氧化酶系统作为植物重要的活性氧自由基清除系统,在植物遭受环境胁迫方面起着重要作用[18]。植物体内的CAT、SOD和POD等抗氧化酶,其活性高低与植物抗病性密切相关。MDA作为膜脂过氧化程度的一项指标,其含量的高低反映植物所受逆境胁迫的伤害程度[19]。与蓝蓟单作种植相比,与向日葵间作能明显提高蓝蓟叶片SOD与POD活性,同时降低叶片中MDA含量[20]。本试验中,NS和MS处理提高了西瓜叶片和根系SOD、CAT活性,并降低了西瓜叶片和根系MDA含量,说明有小麦间作时,西瓜通过提高SOD、CAT活性清除体内大量积累的超氧阴离子自由基,较西瓜单作时维护了细胞膜的稳定性[17],增强西瓜对枯萎病的抗性,从而使西瓜植株正常生长。NS和MS处理西瓜叶片和根系POD活性低于西瓜单作,可能由于清除了体内多余的活性氧,降低了活性氧对细胞膜的损害。这与Ren等[2]和Xu等[6]的研究部分结果基本一致。表明小麦间作通过增强西瓜植株的生理抗性提高了西瓜枯萎病的抗病性。
土壤酶是土壤中最活跃的成分之一,直接参与土壤中重要的生物化学过程,其活性可作为评价土壤质量的重要指标[21]。玉米与花生间作提高了土壤碱性磷酸酶和蔗糖酶的活性,降低了玉米和花生病害的发生[22]。本试验中,MS处理提高了西瓜根际土壤脲酶活性,NS处理提高了西瓜根际土壤蛋白酶活性,NS和MS处理西瓜根际土壤蔗糖酶和磷酸酶活性升高。土壤酶活性的提高能有效改善土壤的养分状况,提高植物间作期间的养分转化和供应,有助于土壤微生物的生长和酶的合成[23],小麦间作西瓜根际土壤酶活性升高,可能是小麦—西瓜间作体系中小麦根系分泌物传递到西瓜根际,为西瓜根际提供较多的营养物质,有利于提高土壤酶活性和微生物的生长[24]。
土壤微生物参与多种生态过程,对土壤的质量和功能影响较大[25]。植物对土传病害的抗性在很大程度上取决于土壤微生物群落,丰度高、物种均匀性高、多样性指数高的微生物群落有较强的抗病原菌的能力[26]。旱作水稻与西瓜间作,可降低西瓜根际土壤尖孢镰刀菌数量,增加土壤微生物多样性,减轻西瓜枯萎病的发生[2]。本试验中,与NS和MS处理相比,FS处理时,由于小麦根系分泌物传递不到西瓜根际,西瓜根际土壤细菌数量明显降低,而土壤真菌和尖孢镰刀菌数量显著升高。与CK和FS处理相比,MS处理时,由于小麦的根系分泌物可以传递到西瓜根际,西瓜根际土壤细菌数量升高,而土壤真菌和尖孢镰刀菌数量显著降低,西瓜根际土壤微生物种群结构发生显著变化,原因可能与小麦—西瓜间作体系中小麦根系分泌的香豆酸抑制了西瓜专化型尖孢镰刀菌的生长以及西瓜根系分泌物成分的变化有关[5]。表明FS处理的西瓜和小麦根系之间没有养分和根系分泌物的交流,其种植方式类似于西瓜单作;MS处理的西瓜和小麦根系之间有养分和根系分泌物的交流,其种植方式类似于西瓜和小麦不分隔种植。本试验结果与Xu等[7]和任丽轩[11]的研究结果类似。
4 结 论
在小麦与西瓜间作系统中,由于不同的分隔方式下根系的交流程度不同,使植株的生理特点、土壤酶活性和土壤微生物数量产生显著差异。间作小麦提高了西瓜叶片叶绿素含量和根系活力,提高了西瓜叶片和根系 SOD和CAT活性,降低了叶片和根系POD活性和 MDA 含量,提高西瓜根际土壤酶活性,改善西瓜根际土壤微生物种群结构。说明小麦—西瓜间作的种植模式可增强植株的生理抗性,改善土壤环境,从而有效缓解西瓜连作障碍。
参考文献
[1] LING N,ZHANG W W,WANG D S,et al.Root exudates from grafted-root watermelon showed a certain contribution in inhibiting Fusarium oxysporum f.sp.niveum[J].Plos One,2013,8:1-8.
[2] REN L X,SU S M,YANG X M,et al.Intercropping with aerobic rice suppressed Fusarium wilt in watermelon[J].Soil Biology and Biochemistry,2008,40:834-844.
[3] GAO X,WU M,XU R N,et al.Root interactions in a maize/soybean intercropping system control soybean soil-borne disease,red crown rot[J].Plos One,2014,9:e95031.
[4] HAO W Y,REN L X,RAN W,et al.Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp.niveum[J].Plant Soil,2010,336:485-497.
[5] LV H F,CAO H S,NAWAZ M A,et al.Wheat intercropping enhances the resistance of watermelon to Fusarium wilt[J].Frontiers in Plant Science,2018,25,9:696.
[6] XU W H,LIU D,WU F Z,et al.Root exudates of wheat are involved in suppression of Fusarium wilt in watermelon in watermelon-wheat companion cropping[J].European Journal of Plant Pathology,2015,141:209-216.
[7] XU W H,WANG Z G,WU F Z.The effect of D123 wheat as a companion crop on soil enzyme activities,microbial biomass and microbial communities in the rhizosphere of watermelon[J].Frontiers in Microbiology,2015,6:1-10.
[8] 张黎杰,周玲玲,姜若勇,等.大棚西瓜—草菇—辣椒轮作对解除设施西瓜连作障碍的效果[J].江西农业学报,2016,28(4):11-14.
[9] WANG M Y,WU C N,CHENG Z H,et al.Soil chemical property changes in eggplant/garlic relay intercropping systems under continuous cropping[J].Plos One,2014,9(10):e111040.
[10] 蓝妮,向慧敏,章家恩,等.水稻与美人蕉间作对水稻生长、病虫害发生及产量的影响[J].中国生态农业学报,2018,26(8):1170-1179.
[11] 任丽轩.旱作水稻西瓜间作抑制西瓜枯萎病的生理机制[D].南京:南京农业大学,2012.
[12] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13] BRADFORD M M.A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding,anal[J].Analytical Biochemistry,1976,72:248-254.
[14] ZHEN A,BIE Z L,HUANG Y,et al.Effects of salt-tolerant rootstock grafting on ultrastructure,photosynthetic capacity,and H2O2-scavenging system in chloroplasts of cucumber seedlings under NaCl stress[J].Acta Physiologiae Plantarum,2011,33:2311-2319.
[15] 关松荫.土壤酶及研究法[M].北京:农业出版社,1986.
[16] 徐伟慧,吴凤芝,王志刚,等.连作西瓜光合特性及抗病性对小麦伴生的响应[J].中国生态农业学报,2014,22(6):655-660.
[17] 李威,程智慧,孟焕文,等.轮作不同蔬菜对大棚番茄连作基质中微生物与酶及后整番茄的影响[J].园艺学报,2012,39:73-80.
[18] YADHU S,ANIL K G,NAVTEJ S B.Bread wheat progenutors:Aegilops tauschii (DD genome) and Triticum dicoccoides (AABB genome) reveal differential antioxidative response under water stress[J].Physiology and Molecular Biology of Plants ,2017,23(1):99-114.
[19] LIU X Z,HUANG B R.Heat stress injury in relation to membrane lipid peroxidation in creeping bentgrass[J].Crop Science,2000,40:503-510.
[20] 張岩,唐玉娇,徐惠风,等.蓝蓟与向日葵间作对某些酶生理特性的影响[J/OL].分子植物育种,[2018-12-14].http://kns.cnki.net/kcms/detail/46.1068.S.20181212.1150.008.html.
[21] NDIAYE E L,SANDENO J M,MCGRATH D,et al.Integrative biological indicators for detecting change in soil quality[J].American Journal of Alternative Agriculture,2000,15:26-36.
[22] 贾曦,王璐,刘振林,等.玉米//花生间作模式对作物病害发生的影响及分析[J].花生学报,2016,45(4):55-60.
[23] DICK R P.A review:long-term effects of agricultural systems on soil biochemicaland microbial parameters[J].Agriculture Ecosystems &Environment,1992,40(1/4):25-36.
[24] 徐伟慧,吴凤芝.西瓜根际土壤酶及微生物对小麦伴生的响应[J].浙江农业学报,2016,28(9):1588-1594.
[25] LAGOMARSIN A,BENEDETTI A,MARINARI S,et al.Soil organic C variability and microbial functions in a mediterranean agro-forest ecosystem[J].Biology Fertility of Soils,2011,47:283-291.
[26] JANVIERC,VILLENEUVE F,ALABOUVETTE C,et al.Soil health through soil disease suppression:which strategy from descriptors to indicators?[J].Soil Biology and Biochemistry,2007,39:1-23.
