非酒精性脂肪肝患者血清25-羟维生素D水平与胰岛素抵抗的相关性分析
2019-08-02喻茂文黄淑彬易维佳汤洪波
喻茂文,黄淑彬, 舒 月,易维佳,汤洪波
(四川省金堂县第一人民医院/四川大学华西医院金堂医院检验科,四川金堂 610400)
非酒精性脂肪性肝病(NAFLD)是一类与遗传、免疫、应激和环境等多种因素有关的代谢性疾病,其主要病理特征为不伴有长期酒精服用史而出现肝实质细胞脂肪变性和脂质浸润[1]。目前随着社会经济的发展和饮食结构的变化,我国NAFLD呈逐年升高且年轻化趋势。相关流行病学调查显示,NAFLD在普通成人中患病率可达20%~33%,而在糖尿病患者中可达50%以上[2]。NAFLD患者早期无明显特征性症状或体征,但肝细胞在长期脂肪贮积下可逐渐发生变性、坏死,进而发展成肝纤维化和肝硬化等不可逆病变。故研究NAFLD发生发展相关危险因素和机制,对其早期预防和控制具有重要价值,也是目前临床医师的研究热点。既往国内外研究显示,胰岛素抵抗、氧化应激和糖脂代谢紊乱在NAFLD发生中起着重要作用,且NAFLD患者发展成为2型糖尿病(T2DM)或代谢综合征风险较普通人群明显增加[3-5]。但目前关于NAFLD患者胰岛素抵抗相关研究仍存在不足,国内外尚缺乏胰岛素抵抗在NAFLD患者发生中的具体机制研究。维生素D是一种重要的类固醇激素,近年来研究发现其除了参与人体钙磷代谢外,还参与炎性反应、氧化应激及糖脂代谢等多种病理生理过程。MITRI等[6]认为维生素D可通过减少细胞因子介导的胰岛β细胞凋亡和刺激胰岛素分泌等途径维持糖耐量正常。ELSEWEIDY等[7]认为维生素D可作为胰岛素敏感性的有效调节剂,但目前在NAFLD患者中血清25-羟维生素[25(OH)D] 水平与胰岛素抵抗的关系仍不明确。本研究选取2015年1月至2018年1月本院门诊就诊或住院治疗NAFLD患者作为研究对象,旨在通过分析NAFLD患者和健康成人血清25(OH)D水平及与临床相关指标的关系,探讨25(OH)D在NAFLD患者胰岛素抵抗中的可能作用机制。
1 资料与方法
1.1 一般资料 选取2017年8月至2018年7月在本院门诊就诊或住院治疗NAFLD患者为研究对象。共纳入符合上述标准的NAFLD患者240例,其中男125例,女115例;平均年龄为(47.8±8.5)岁;根据患者血糖控制情况分为单纯NAFLD组(n=95)、NAFLD合并空腹血糖受损(IGR)组(n=79)和NAFLD合并T2DM组(n=66)。另随机选取本院健康体检中心90例健康成年人作为健康对照组,其中男、女各45例,平均年龄为(47.7±8.0)岁。健康对照组健康状况良好,排除既往有酗酒史、合并有T2DM、慢性肝肾功能不全、肿瘤或感染病史者。此外,本研究经本院伦理委员会批准,所有纳入患者及家属均签署知情同意书,并享受随时退出权利。
1.2 病例纳入、排除和诊断标准 纳入标准:(1)NAFLD诊断明确且NAFLD诊疗标准参考2016版欧洲肝脏研究协会NAFLD诊疗指南[8]:①既往无饮酒史或男性饮酒量每周小于140 g或女性饮酒量每周小于70 g;②临床症状主要表现为腹胀、乏力或肝区隐痛等;③血清谷丙转氨酶(ALT)可升高,但ALT<70 U/L可伴有三酰甘油(TG)升高等;④肝脏脂肪含量(LFC)>5%;⑤排除酒精性脂肪肝、病毒性肝炎等其他可导致脂肪肝的疾病,同时满足上述5种条件NAFLD诊断即可成立;(2)年龄18~60岁;(3)初诊病例且未接受任何药物、饮食控制或运动疗法等治疗措施。排除标准:(1)有长期饮酒史即男性每周饮酒量≥140 g或女性饮酒量≥70 g者;(2)合并有严重肝肾心功能不全疾病者;(3)急慢性肝炎、肝硬化或肝癌病史者;(4)近3个月内服用影响肝功能、钙磷代谢或糖代谢药物如类固醇激素、噻嗪类利尿剂、活性维生素D和二膦酸盐制剂等者;(5)妊娠或哺乳期妇女;(6)合并急性感染、恶性肿瘤或1型糖尿病患者;(7)合并精神或认知障碍,难以配合后续随访或治疗者。T2DM和IGR诊断标准参考2010版美国糖尿病协会诊疗指南[9],其中IGR诊断标准为空腹血糖(FPG)在6.1~7.0 mmol/L和(或)口服葡萄糖耐量试验(OGTT)2 h后血糖在7.8~11.1 mmol/L。
1.3 研究方法 由专门医护人员对受试者进行病史询问,采用本科自编问卷对患者进行登记,该问卷由本院医师、技师根据既往国内外报道的脂肪肝相关风险因素进行编写[10-11],主要包括基本信息、既往病史和生活习惯三个部分:(1)年龄、性别、职业、文化程度、收入、联系方式;(2)病程、既往病史、遗传史、吸烟史、饮酒史(具体到饮用酒类型、频率、时长和饮酒量);(3)饮食、运动、睡眠和药物使用情况等。调查地点选取在医生谈话室,调查前由专职人员告知患者填写方法及本次研究的目的、内容和意义,获得受试者充分支持。以下情况视作无效问卷:(1)问卷填写时间小于5 min;(2)问卷信息填写率小于80%。完成问卷调查后安排受试者进行体格检查、实验室和影像学检查。体格检查包括受试者身高、体质量,并计算体质量指数(BMI);实验室检查要求受试者清晨空腹抽取肘静脉血,采用自动生化分析仪(迈瑞BS2000)检测血清总胆固醇(TC)、TG、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、ALT、天门冬氨酸氨基转移酶(AST)、FPG等指标。糖化血红蛋白(HbA1c)采用Premier Hb9210进行测定。采用西门子全自动化学发光免疫分析仪(ADVIA Centaur®XP)检测空腹胰岛素(FINS)和血清25(OH)D水平。采用稳态模式胰岛素抵抗指数(HOMA-IR)评估胰岛素抵抗,计算公式:HOMA-IR= FPG×FINS/22.5,目前关于HOMA-IR取值范围国内外尚无定论,既往研究多认为不同人群中上限值在2~3[12-13]。采用GEOktimma64排128层CT测定受试者LFC,LFC>5%为诊断脂肪肝截断点。

2 结 果
2.1 各组临床资料及生化指标比较 各组患者性别、年龄比较差异无统计学意义(P>0.05)。与健康对照组相比,其余3组患者BMI、FPG、HbA1c、ALT、AST、TG、TC、LDL-C、HOMA-IR和LFC升高,HDL-C和25(OH)D降低,差异均具有统计学意义(P<0.05)。与单纯NAFLD组相比,NAFLD合并IGR组和NAFLD合并T2DM组患者FPG、HbA1c、ALT、AST、TG、TC、HOMA-IR和LFC升高,25(OH)D降低,差异均具有统计学意义(P<0.05),见表1。

表1 各组临床资料及生化指标比较

续表1 各组临床资料及生化指标比较
注:a为χ2值,b为F值,c为H值;与单纯NAFLD组比较,*P<0.05;与NAFLD合并IGR组比较,#P<0.05;与NAFLD合并T2DM组比较,△P<0.05
2.2 NAFLD患者发生T2DM风险因素的多因素Logistic回归分析 根据NAFLD患者是否合并T2DM分为NAFLD合并T2DM组(n=66)和NAFLD不合并T2DM组(n=174),以NAFLD合并T2DM组为因变量,赋值方法:1=NAFLD组合并T2DM,0=NAFLD组不合并T2DM,以BMI、FPG、HbA1c、ALT、AST、TG、TC、LDL-C、HDL-C、25(OH)D、HOMA-IR和LFC为自变量进行多因素Logistic回归分析。结果发现,BMI(OR=1.922,95%CI:1.175~3.143,P=0.023)、LFC(OR=2.464,95%CI:1.263~4.807,P=0.005)和HOMA-IR(OR=4.229,95%CI:2.250~7.949,P<0.05)是NAFLD发生T2DM的危险因素,25(OH)D(OR=0.457,95%CI:0.240~0.869,P<0.05)是NAFLD发生T2DM的保护因素,见表2。
2.3 HOMA-IR三分位分组后各组临床相关指标比较 根据HOMA-IR值,将240例NAFLD患者按三分位数法分为HOMA-IR<1.2组、HOMA-IR1.2~1.6组和HOMA-IR>1.6组,随着HOMA-IR值增加,BMI、HbA1c、TG、LDL-C和LFC水平升高,25(OH)D水平降低,差异均具有统计学意义(P<0.05),见表3。

表2 NAFLD患者发生T2DM风险因素的

表3 HOMA-IR三分位分组后各组临床相关指标比较

续表3 HOMA-IR三分位分组后各组临床相关指标比较
注:a为χ2值,b为F值,c为H值;与HOMA-IR<1.2组比较,*P<0.05;与HOMA-IR1.2~1.6组比较,#P<0.05
2.4 HOMA-IR、血清25(OH)D与临床各指标相关性分析 HOMA-IR与BMI、HbA1c、TG、LDL-C和LFC在未校正和校正相关因素后均呈正相关(P<0.05);而25(OH)D与BMI、TG、LFC和HOMA-IR在未校正和校正相关因素后均呈负相关(P<0.05)。见表4、5。
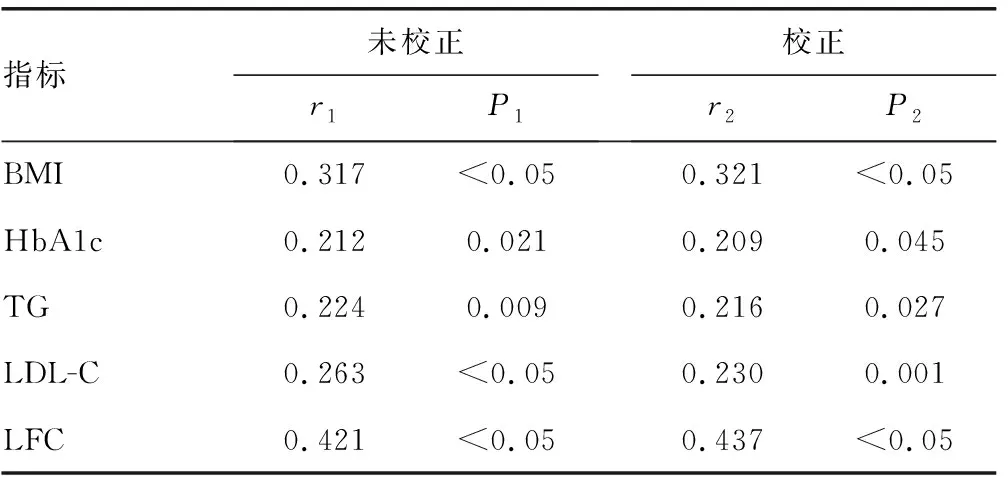
表4 HOMA-IR与临床各指标相关性

表5 血清25(OH)D与临床各指标相关性
2.5 LFC三分位分组后血清25(OH)D和HOMA-IR相关性分析 将LFC根据三分位法分为LFC<14.3%组、LFC14.3%~24.4%组和LFC>24.4%组,方差分析结果显示,各组25(OH)D水平随LFC值增加而降低,HOMA-IR值升高,差异均具有统计学意义(P<0.05)。Pearson相关性分析结果显示,LFC 14.3%~24.4%和LFC>24.4%组患者血清25(OH)D和HOMA-IR均呈负相关,且对BMI和TG两种因素进行校正后,LFC>24.4%组上述两种指标仍具有较强相关性(r=-0.472,P=0.001)。见表6。

表6 LFC三分位分层后血清25(OH)D和HOMA-IR相关性
注:*P<0.05,与LFC<14.3%组比较;-表示无数据
3 讨 论
2002年美国肝病学会将NAFLD从脂肪肝分型中独立出来,定义为除酒精、病毒和免疫等其他导致肝脏损害因素而形成的代谢应激性肝损伤,其疾病谱包括单纯性脂肪肝(SFL)、非酒精性脂肪性肝炎(NASH)和NASH相关肝硬化等[14]。既往研究发现,NAFLD与T2DM的发生关系密切,二者既可能是彼此发生的危险因素,在发生发展中遵循相互促进的环形递进性恶性循环模式,又可能是同一病因的两种病理表现[15]。T2DM患者机体血糖水平长期处于异常升高状态,多余葡萄糖可转移至肝脏转化为肝糖原,当肝糖原储存量超过肝脏储存阈值时,多余葡萄糖即可转化为脂肪在肝脏内堆积,进而导致肝细胞脂肪变性、坏死凋亡,这是T2DM患者易合并NAFLD的病理基础[16]。但也有研究认为,胰岛素抵抗在NAFLD的发病过程中起到重要作用,是NAFLD发生的重要危险因素。NAFLD患者胰岛素抵抗和脂质代谢紊乱也可加剧糖代谢紊乱,进而导致患者空腹糖耐量受损和T2DM的发生[15]。本研究结果也发现,与健康对照组相比,NAFLD患者BMI、FPG、HbA1c、ALT、AST、TG、TC、LDL-C、HOMA-IR和LFC升高,HDL-C和25(OH)D降低,差异均具有统计学意义(P<0.05)。表明NAFLD患者存在明显的糖代谢、脂代谢、维生素D代谢异常和胰岛素抵抗。而进一步与单纯NAFLD组相比,NAFLD合并IGR组和NAFLD合并T2DM组胰岛素抵抗水平和糖脂代谢指标明显升高、25(OH)D水平降低,这提示胰岛素抵抗、LFC和血清25(OH)D均可能参与了NAFLD患者糖代谢紊乱的发生。既往LALLUKKA等[17]也研究认为胰岛素抵抗是NAFLD发生发展的中心环节,也为T2DM的主要病理生理改变。结合本研究结果,可以认为胰岛素抵抗促进了NAFLD的发生,而NAFLD又通过某种机制加剧患者胰岛素抵抗程度。
目前,临床研究表明胰岛素分泌功能受损和胰岛素抵抗是T2DM发生的两个重要环节。近年来有研究发现维生素D对胰岛β细胞具有一定的调节作用,血浆25(OH)D水平与β细胞功能和胰岛素敏感性呈正相关[18]。BLACK等[19]研究发现,随着NAFLD患者血清25(OH)D水平降低,T2DM合并NAFLD患病率明显升高,且呈明显的剂量依赖型关系,这提示25(OH)D与NAFLD发生密切相关。SEO等[20]一项纳入1 081名成人的队列研究发现,受试者低维生素D水平与NAFLD发生密切相关且独立于性别、年龄、运动量等因素。JABLONSKI等[21]通过对176例NAFLD患者进行研究,经校正BMI、高血压、肝脏疾病病史等因素后,多因素Logistic回归分析结果发现低水平25(OH)D是T2DM合并NAFLD的重要危险因素(OR=2.56,95%CI:1.27~5.19),且与胰岛素抵抗密切相关。与上述研究不同的是,本研究将240例NAFLD患者分为合并T2DM和单纯NAFLD组,研究结果发现,BMI、LFC和HOMA-IR和低水平25(OH)D是NAFLD发生T2DM的危险因素。进一步说明了25(OH)D在NAFLD和T2DM之间的相互发生发展中可能起到重要的推动作用。
此外,本研究根据HOMA-IR值对NAFLD患者进行三分位分层,结果发现随着胰岛素抵抗增强,患者BMI、HbA1c、TG、LDL-C和LFC水平升高,25(OH)D水平降低,差异均具有统计学意义(P<0.05)。校正BMI、HbA1c、TG、LDL-C等相关因素,HOMA-IR与LFC呈正相关关系(r=0.437,P<0.05),25(OH)D与LFC呈负相关关系(r=-0.281,P=0.003)。根据LFC对NAFLD患者进行三分位分层,LFC 14.3%~24.4%组和LFC>24.4%组患者血清25(OH)D和HOMA-IR均呈负相关,且对BMI和TG两种因素进行校正后,LFC>24.4%组血清25(OH)D和HOMA-IR仍具有较强相关性(r=-0.472,P=0.001)。上述结果表明25(OH)D、LFC和胰岛素抵抗在NAFLD的发生过程中可能起到交互作用。既往报道的相关机制如下:(1)25(OH)D与靶细胞上特异性受体结合,提高靶细胞内第二信使Ca2+浓度,加快细胞内信号通路传导,提高胰岛素分泌量和敏感性[22]。(2)氧化应激和炎性反应在胰岛素抵抗的发生过程中也起到重要作用,有研究认为25(OH)D能够调节细胞内炎性因子水平,并可通过激活Wnt/β-连环蛋白信号传导通路来降低胰岛细胞内氧化应激反应[23]。(3)胰岛素抵抗可促进游离脂肪酸在肝细胞内沉积,肝脏脂肪异常沉积增多也可进一步导致患者胰岛素抵抗增强。25(OH)D可有效阻止肝脏前脂肪细胞向脂肪细胞的转化,进而减少肝脏脂肪浸润程度,改善患者胰岛素抵抗水平[24]。本研究结果也发现NAFLD患者LFC水平与HOMA-IR呈正相关。表明25(OH)D可通过改善NAFLD患者LFC的基础上降低胰岛素抵抗水平。目前,已有学者将短期口服维生素D3用于改善T2DM患者胰岛β细胞功能,并取得不错的治疗效果,可明显降低患者血糖和HbA1c水平[25]。但关于口服维生素D是否能改善NAFLD肝损伤存在争议[26]。
4 结 论
NAFLD患者胰岛素抵抗严重程度与25(OH)D和LFC有关,低水平25(OH)D为NAFLD患者发生T2DM的危险因素。故对于临床上对于NAFLD患者,尤其是合并T2DM患者,应积极筛查和预防低水平25(OH)D的发生,防止患者进一步向T2DM发展。
