肠炎沙门菌icdA基因缺失株的构建及重要特性分析
2019-07-30吴同垒张艳英于秀剑黄翠琴张志强史秋梅朱国强
吴同垒,张艳英,陈 娟,于秀剑,黄翠琴,张志强,史秋梅*,朱国强
(1.河北科技师范学院,河北秦皇岛066004;2.中国农业大学,北京100193;3.福建省家畜传染病防治与生物技术重点试验室,福建龙岩364000;4.扬州大学,江苏扬州225009)
沙门菌(Salmonella)是一种食源性致病菌,鸡肉、蛋和相关产品是沙门菌的主要携带者,主要通过粪口途径传染人和其它哺乳动物[1-2]。沙门菌血清型众多,达到2600余种,其中肠炎沙门菌(Salmonella enterica serovar Enteritidis)是引起人类和畜禽沙门菌病的主要成员。肠炎沙门菌通过水平传播和垂直传播两种方式传播,引起鸡沙门菌病,也可引起人类的肠胃炎和食物中毒。世界范围内,每年因沙门菌导致的食物中毒造成大约155 000人死亡[3-4]。
肠炎沙门菌为兼性胞内寄生菌,能够在宿主细胞中存活并增殖。由于生物膜的选择性通过性,普通药物难以大量进入细胞,不能彻底杀死病原菌。icdA基因编码异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)在呼吸链的三羧酸循环中发挥重要作用,研究显示其在沙门菌侵入的巨噬细胞中高表达[5]。同时,对结核分枝杆菌、幽门螺杆菌和迟缓爱德华菌的研究发现IDH能够显著激活宿主的免疫应答反应[6-8]。因此,推测IDH与沙门菌的抗应激能力、胞内存活能力和毒力密切相关[5]。
为了进一步证实IDH在肠炎沙门氏菌中的生物学功能,本研究利用λ-同源重组技术对肠炎沙门菌icdA基因进行了缺失,构建了该基因的缺失株,并对该缺失株进行体外应激试验、药敏试验和生物被膜检测、抗蛋清杀伤试验、胞内存活和动物攻毒试验,分析icdA基因的功能,为开发肠炎沙门菌疫苗奠定基础。
1 材料与方法
1.1 主要实验材料 肠炎沙门菌c50336、质粒pKD3、pKD46、pCP20和pBBR322,均由扬州大学朱国强教授惠赠。鼠源巨噬细胞Raw264.7,由吉林农业大学单晓枫教授惠赠。BALB/c小鼠购自北京维通利华实验动物有限公司。
PCR Mixture、T4连接酶、DNA Marker和限制性内切酶均购自宝生物工程(大连)有限公司;蛋白Maker购自Fermentas公司;L-阿拉伯糖购自Sigma公司;ID32E生化鉴定试纸条购自法国Biomerieux公司。
1.2 引物的设计与合成 根据肠炎沙门菌基因组(CP028151.1)序列,利用Primer Premier 5设计引物。引物P1和P2由两部分组成,前半部分(下划线)与icdA基因同源,后半部分与氯霉素抗性基因(cat)同源,P1和P2用于扩增cat基因。引物P3、P4用于扩增icdA基因,构建互补菌株。引物P5、P6与icdA基因同源,但位于P1和P2引物外侧,用于基因缺失菌株的鉴定。引物由上海生工生物工程技术服务有限公司合成(表1)。

表1 引物信息
1.3icdA基因缺失株及回补株的构建 参照文献[9],以质粒pKD4为模板,使用引物P1/P2克隆氯霉素基因片段并回收,溶解于去离子水中;向培养至对数期的c50336(携带pKD46)菌液中加入终浓度为30 mmol/L的阿拉伯糖诱导2 h,冰浴10 min后,使用冰冷的去离子水洗涤3次,加入去离子水重悬制备感受态细胞。将氯霉素片段电击转化感受态细胞,复壮后涂布氯霉素平板,培养24 h,挑取单菌落进行PCR鉴定。取阳性菌42℃热激去除质粒pKD4,经Amp复筛和PCR鉴定获得一次重组菌株,命名为c50336::cat。将质粒pCP20电转化入c50336::cat,经筛选得到敲除氯霉素片段的菌株,即为二次重组菌株c50336ΔicdA,再次进行PCR鉴定。
使用引物P3/P4扩增icdA基因,并连接至质粒pBR322中,即为pBR322-icdA。将其电转化至菌株c50336ΔicdA中,经鉴定,阳性菌株命名为c50336 ΔicdA+icdA,即为回补菌株。
1.4 重组菌生长曲线及生化特性检测 取过夜培养的 c50336、c50336ΔicdA和c50336ΔicdA+icdA菌液,按1∶50转接新鲜LB液体培养基,37℃震荡培养;每隔2 h取不同时间点菌液,测定其OD600nm值,绘制3种菌的生长曲线。同时,利用ATB自动鉴定系统进行菌株生化特性分析。
1.5 重组菌的体外应激试验 对菌株c50336、c50336ΔicdA和 c50336ΔicdA+icdA进行下列应激试验:使用生理盐水调整各菌株浓度为1×108cfu/mL;将上述菌株分别与pH3.5和pH10.0的灭菌生理盐水,37℃孵育30 min,检测各菌株对酸、碱的应激;同时将上述菌株分别与去离子水和2.4 mol/L NaCl溶液,37℃孵育1 h,检测各菌株对低、高渗透压的应激;42℃,于生理盐水中孵育各菌液10min,进行热应激试验;测定上述菌在含10 mmoL/L H2O2的生理盐水中,37℃孵育10 min的氧化应激。各应激试验结束后经细菌计数,分析实验数据。
1.6 重组菌的耐药试验 使用多粘菌素B,在96孔板中进行最低抑菌浓度(MIC)实验:采用倍比稀释法在第一孔中加入100 μL LB培养基(含浓度1 000 μg/mL多粘菌素 B),2~12孔加入2倍倍比稀释的多粘菌素 B,取 c50336、c50336ΔicdA和c50336ΔicdA+icdA菌液,LB稀释各菌液至 1×109cfu/mL,向96孔板中每孔加10 μL菌液,同时设置无多粘菌素B对照组。37℃培养48 h,观察细菌生长情况。
1.7 重组菌的生物被膜形成能力检测 取c50336、c50336ΔicdA和 c50336ΔicdA+icdA菌液按 1∶100 的比例接入生物膜诱导培养基,以150 μL/孔分装到96孔板中,置于30℃,80 r/min培养;24 h后弃去菌液,蒸馏水洗去游离细菌,使用2%结晶紫室温染色15 min,蒸馏水洗涤;乙醇溶解结晶紫,测量OD575nm值,进行数据分析。
1.8 重组菌的抗蛋清杀伤试验 将培养至对数期的c50336、c50336ΔicdA和 c50336ΔicdA+icdA菌 液 离心后用PBS缓冲液洗涤3次,并稀释至1×104cfu/mL,加入等体积无菌蛋清充分混匀,37℃孵育1 h,平板计数,计算3种细菌存活率。
1.9 重组菌胞内存活能力的测定 取生长良好的鼠源巨噬细胞Raw264.7,以1×105/孔铺于24孔细胞板;将培养至对数生长期的c50336、c50336ΔicdA和c50336ΔicdA+icdA细菌计数,以MOI 10的剂量感染Raw264.7细胞,混匀后孵育1 h,更换为含20 μg/mL庆大霉素的DMEM,以杀死细胞外的细菌。在感染后1 h、10 h、24 h采用1%Tritoxn-100裂解细胞后细菌计数,绘制曲线。
1.10 动物感染实验 取BALB/c小鼠,每组10只,共分为11组;取c50336和c50336ΔicdA菌液,离心后 PBS重悬,并 10倍倍比稀释为 1.0×108cfu/mL~1.0×104cfu/mL;1~5组经腹腔注射0.2 mL不同浓度c50336,6~10组经腹腔注射不同浓度c50336ΔicdA;第11组注射PBS,作为对照组。感染后连续记录小鼠死亡数,根据改良寇氏法计算各菌对小鼠的半数致死量(LD50)。
2 结果
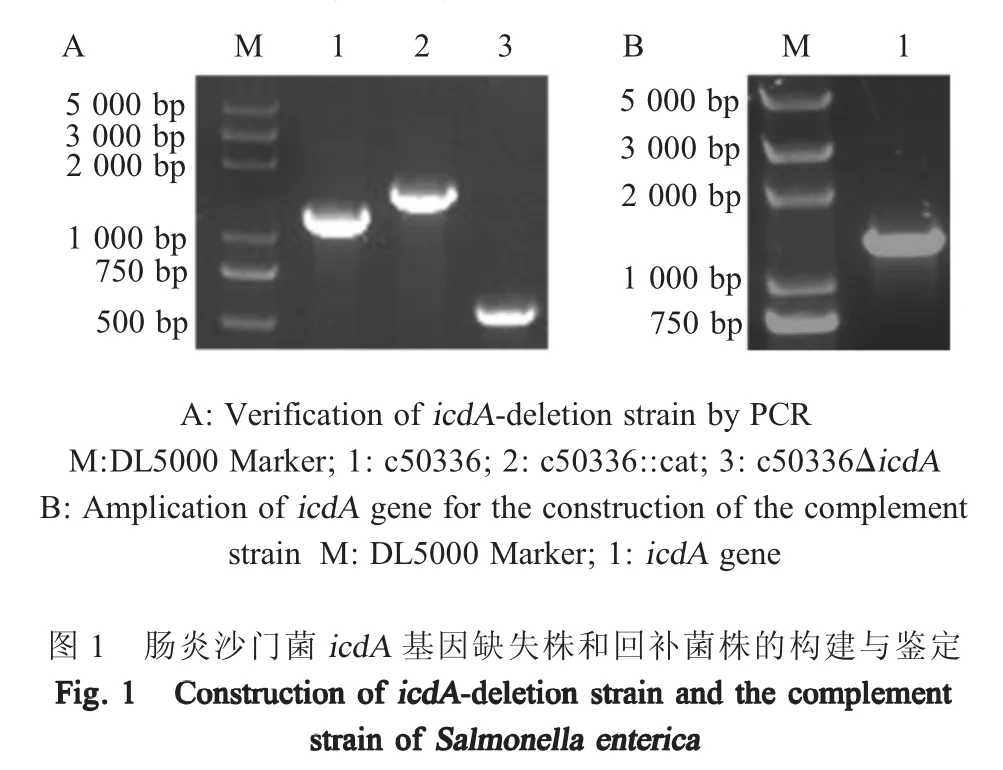
2.1icdA基因缺失株和回补菌株的构建与鉴定以引物P1和P2,模板质粒pKD3,扩增氯霉素基因(cat)片段,并电转化至c50336(携带质粒pKD46)中,阳性质粒热激去除质粒pKD46,即为一次重组菌株c50336::cat;利用质粒pCP20消除氯霉素片段,得到二次重组菌株c50336ΔicdA,PCR鉴定结果如图1A,与预期相符,表明构建了icdA基因缺失菌株。利用质粒pBBR322,构建回补菌株c50336ΔicdA+icdA,icdA基因扩增结果显示,泳道1的条带大小与预期一致(图1B)。表明回补菌株正确构建。
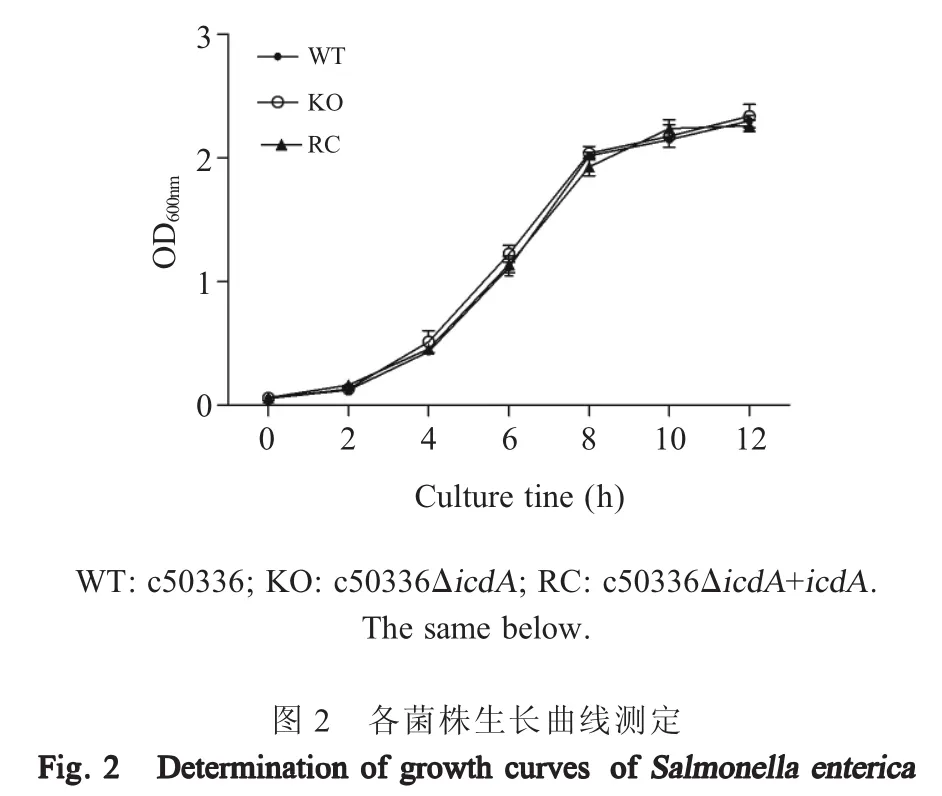
2.2 重组菌生长曲线测定和生化特性分析 LB液体培养基中培养c50336、c50336ΔicdA和c50336ΔicdA+icdA菌株,取各时间点菌液测定各自OD600nm值,绘制3种菌株的生长曲线,结果显示,测试各菌株间生长速度无明显差异(图2),表明icdA基因缺失不引起沙门菌的营养缺陷。
利用ATB全自动生化鉴定系统对c50336、c50336ΔicdA和 c50336ΔicdA+icdA菌株的生化反应谱进行测定,结果显示3株菌之间生化反应谱无区别,表明icdA基因缺失不改变沙门菌的生化特性。
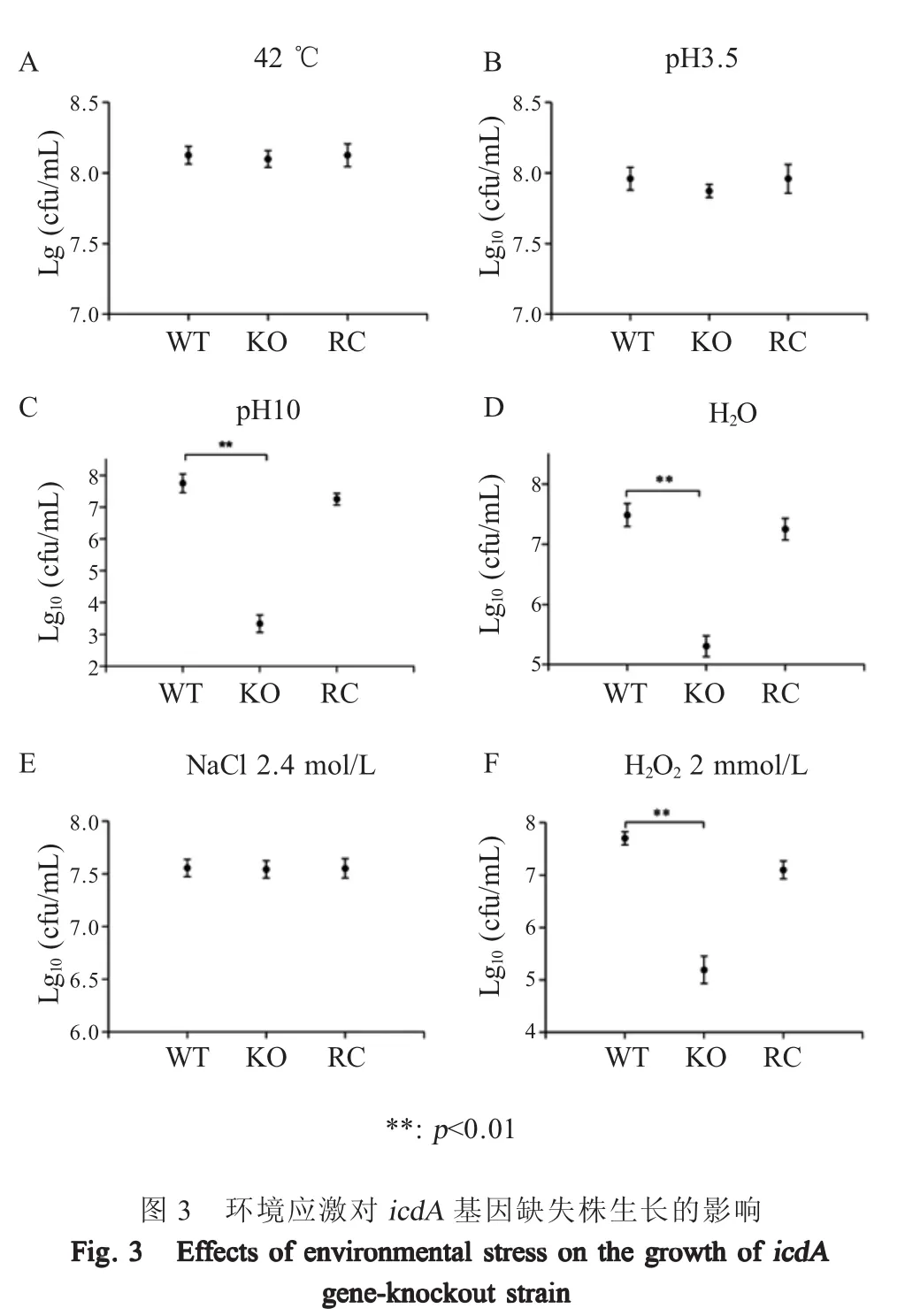
2.3 重组菌的抗体外应激试验结果 体外应激试验检测菌株c50336、c50336ΔicdA和c50336ΔicdA+icdA对酸、碱、热、高渗、低渗和氧化应激的抵抗能力,结果显示,相对于野生型菌株c50336,基因缺失株c50336ΔicdA在碱应激(pH=10)、低渗(去离子水)应激和氧化应激(H2O2=2 mmol/L)条件下的存活率明显降低,但在热应激(42℃)、酸应激(pH=3.5)和高渗应激(NaCl 2.4 mol/L),各菌株存活率未出现显著变化(图3)。表明IDH参与肠炎沙门菌对部分应激的抵御,是细菌适应外界环境(包括宿主环境)生存的重要分子。
2.4 重组菌耐药试验结果 利用多粘菌素B进行菌株 c50336、c50336ΔicdA和 c50336ΔicdA+icdA的MIC实验,经过计算,结果显示菌株c50336的MIC值 为 15.625(1/26×/103) μg/mL,而 c50336ΔicdA的MIC 为 1.954(1/29×/103) μg/mL,回补菌株的 MIC 与野生菌株一致。icdA基因缺失菌株的MIC值降低8倍(23),其耐药性降低(表2)。表明IDH参与了肠炎沙门菌的耐药机制。
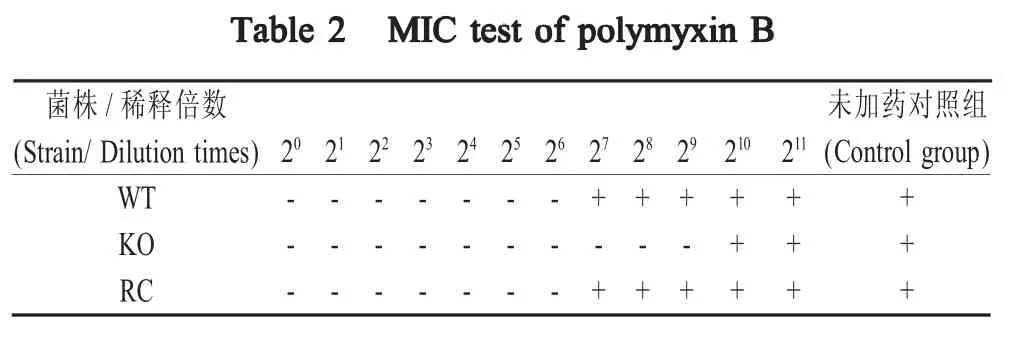
表2 各菌株对多粘菌素B的MIC试验
2.5 重组菌生物被膜形成能力分析 采用结晶紫染色法定量分析菌株c50336、c50336ΔicdA和c50336 ΔicdA+icdA的生物被膜形成能力,结果显示,基因缺失菌株c50336ΔicdA生物膜形成量不足野生菌株的50%(图4)。表明IDH参与肠炎沙门菌的生物被膜形成,进一步揭示其影响肠炎沙门菌耐药性的机制。

2.6 重组菌抗蛋清杀伤试验 将c50336、c50336ΔicdA和c50336ΔicdA+icdA调整浓度为1×104cfu/mL后,与无菌蛋清混合孵育1 h,进行细菌计数,并计算各细菌的存活率。结果显示,相对于野生菌株c50336,基因缺失菌株c50336ΔicdA在蛋清中的存活率明显降低,仅约为野生型菌株的一半,而回补菌株c50336ΔicdA+icdA蛋清存活率得到大部分恢复(图5)。表明IDH参与肠炎沙门菌对蛋清杀伤的防御。
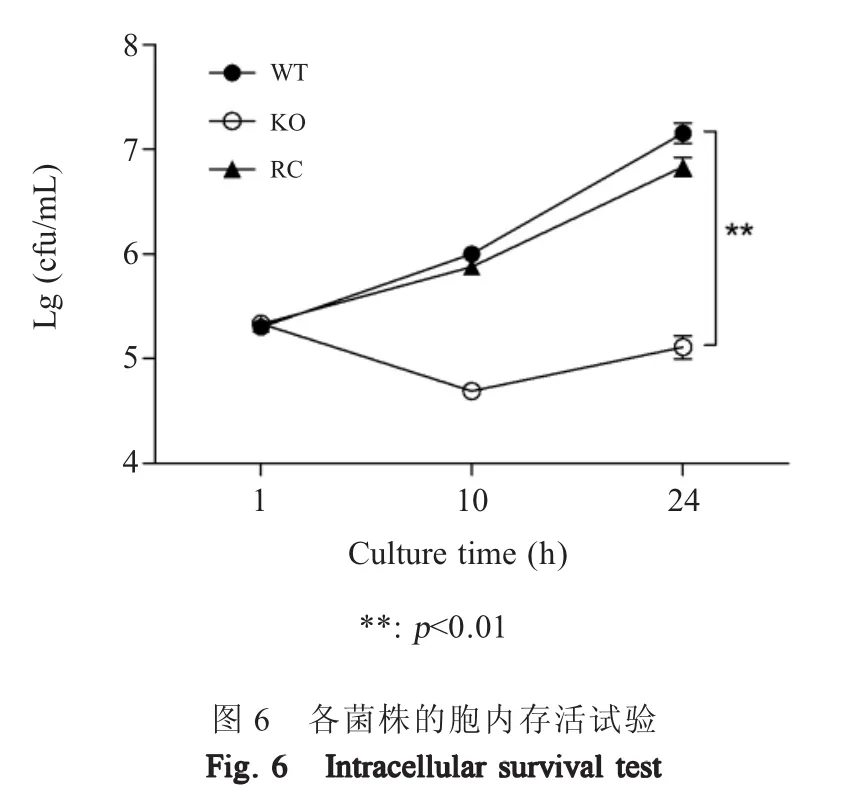
2.7 重组菌的胞内存活能力测定结果 取c50336、c50336ΔicdA和 c50336ΔicdA+icdA菌 液 计 数 后以MOI=10的剂量感染鼠源巨噬细胞系Raw264.7,在感染后的不同时间点裂解细胞,进行细菌计数,以Lg(cfu/mL)值作图评价细菌的胞内存活能力。结果显示,在感染后的10 h和24 h,基因缺失菌株c50336 ΔicdA的Lg(cfu/mL)值比野生菌株c50336约降低了2,即细胞载菌量降低了约100倍,而回补菌株载菌量得到部分回复(图6)。表明IDH能够影响肠炎沙门菌的胞内存活能力。

2.8 动物感染试验结果 取野生型菌株c50336和基因缺失菌株c50336ΔicdA,进行小鼠感染试验,攻毒后连续记录小鼠死亡数量,利用寇氏法计算各菌株的LD50,结果显示,c50336ΔicdA的 Lg(LD50)值增大2左右,即LD50增大了约100倍(图7)。表明icdA基因缺失后肠炎沙门菌的毒力显著降低(p<0.01)。
3 讨论

沙门菌是兼性胞内寄生菌,在细胞内形成包裹菌体的内噬体(Salmonella-containing vacuol,SCV),在SCV保护下进行增殖和扩散[9-11]。在细胞内,沙门菌需要调节自身的基因表达,以适应和抵御宿主的杀伤,icdA基因在肠炎沙门菌感染细胞内高表达,提示其参与抵御应激,进而影响细菌的毒力。本研究利用λ-Red同源重组技术构建了icdA基因缺失菌株,用于分析icdA基因功能。研究结果显示,相对于野生菌株,icdA基因缺失菌株生化特性,部分应激条件下(碱应激、低渗、氧化应激)存活率未发生变化,但对碱应激、低渗应激和氧化应激的敏感性明显增强,对蛋清抵抗能力和对抗菌肽类物质多粘菌素B的耐药性显著降低,同时其生物被膜的形成能力也明显降低。进一步利用胞内存活试验和动物感染试验证明,icdA基因缺失菌株的胞内存活能力和对小鼠的毒力显著降低(LD50增大)。根据以往研究报道[5-8,10]推测IDH参与沙门菌的致病性。
多粘菌素B是一种抗菌肽类药物,可作为一大类抗生素的代表,其杀菌方式主要是在微生物的细胞壁上打孔,形成大分子通道,进而释放细菌内容物,最终引起细菌死亡[12-13]。本研究发现icdA基因缺失菌株相对野生菌株,对多粘菌素的MIC值降低了8倍,表明其影响肠炎沙门菌的耐药性。生物被膜形成能力是肠炎沙门菌的重要毒力特征,常常与细菌的耐药性密切相关。本研究利用结晶紫染色法证明,相对于野生型菌株,icdA基因缺失菌株的生物被膜形成能力降低了约50%,该结果进一步解释了其耐药性降低的原因。
肠炎沙门菌常污染鸡蛋,被人食用后引起食物中毒,威胁人类健康。一般认为,蛋清不允许微生物的生存,因为其中含有大量的杀菌成分,但是肠炎沙门菌能在其中生存,这种生存能力是细菌垂直传播和引起人类感染的重要原因[14-16]。本研究证明icdA基因编码产物参与肠炎沙门菌对蛋清杀伤的防御作用。在蛋清中生存能力的降低,提示icdA基因缺失株具有作为候选疫苗菌株的可能性,应用该缺失菌株作为疫苗使用,可以在一定程度上减少肠炎沙门菌垂直传播的概率,保障动物健康和促进食品安全。将icdA基因缺失菌株作为疫苗,还需要分析该菌株的毒力。本研究发现,icdA基因缺失菌在巨噬细胞内的存活能力显著降低,其LD50也显著升高,表明该菌株毒力明显降低,有望作为候选疫苗。
