伪狂犬病病毒UL56蛋白与宿主蛋白Nedd4相互作用的研究
2019-07-30王书文蔡雪辉
王书文,吕 闯,蔡雪辉*
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150069)
伪狂犬病病毒(Pseudorabies virus,PRV)又称奥耶兹基氏病毒或猪疱疹病毒,属于α疱疹病毒亚科水痘疱疹病毒属成员,可以感染多种家畜、野生动物及啮齿类动物。猪是其唯一的自然宿主及主要传染源。PRV侵染宿主过程中,可潜伏于外周感觉神经节或裂解性感染并引起明显的神经症状,临床上引起新生仔猪神经系统紊乱、生长猪呼吸道症状,并且能导致妊娠母猪流产、产死胎、弱胎及木乃伊胎[1]。研究表明疱疹病毒UL56蛋白(pUL56)与PRV的神经致病能力相关,可能在病毒粒子囊泡转运过程中发挥作用[2]。
PRV pUL56含有多种功能性结构域,成为其与宿主细胞蛋白互作的分子基础。近期研究显示PRV pUL56可增加猪白血球抗原I类(Swine leukocyte antigen class I,SLA-I)分子的泛素化,并经溶酶体途径降解细胞表面的SLA-I分子,这可能是PRV逃逸机体细胞免疫的机制之一[3]。PRV pUL56属于II型膜蛋白,对病毒粒子的神经传播有促进作用且与病毒的神经毒力相关,但UL56基因缺失并不影响病毒粒子在神经元轴突中的转运能力[2]。因此,pUL56对PRV神经致病性的分子机制仍有待进一步研究。
WW结构域(Domain)由35~40个氨基酸残基组成,其中存在2个由20~23个氨基酸残基间隔高度保守的色氨酸残基(Tryptophan,W)[4]。WW结构域特异性的识别脯氨酸富含序列,是一个高度保守的介导蛋白互作的结构域[5]。神经前体细胞表达发育下调蛋白4(Neural precursor cell expressed developmentally down-regulated 4,Nedd4)含有 2~4个 WW结构域,作为一类具有E3泛素连接酶活性的蛋白质,在生理状态下主要通过泛素化依赖的方式介导蛋白质通过溶酶体及蛋白酶体降解而发挥其生物学功能[6],在蛋白质生成及输送、免疫应答和应激反应等生理过程中发挥重要的作用。多种病毒可利用细胞内泛素连接酶体系促进其自身组装、释放、转录以及抗天然免疫等过程[7]。Nedd4是宿主细胞泛素连接酶家族代表性成员,在病毒感染宿主过程中,可与病毒蛋白相互作用调控病毒在细胞内的信号传导及出芽等过程[8]。Nedd4通过与底物蛋白的PPxY(PY)基序相互作用,随后进入泛素蛋白酶体途径降解[9]。通过对PRV pUL56氨基酸序列的分析,本研究发现其编码4个PY基序,以pUL56为研究对象,利用免疫共沉淀(Co-IP)及激光共聚焦试验验证PRV pUL56与Nedd4是否存在相互作用及其对Nedd4表达的调控,为探究pUL56在PRV感染过程中的功能奠定了基础。
1 材料与方法
1.1 病毒株、载体及细胞 PRV HeN1株(KP098534.1)由哈尔滨兽医研究所流行病学与病原监测团队分离并保存[10];真核表达载体p3×Flag-CMV、pCMV-HA和 pAcGFP-C1、真核表达质粒 pAcGFP-UL56-S1、pAcGFP-UL56-S2、pAcGFP-UL56-S3、非洲绿猴肾脏细胞(Vero)、人胚胎肾293T细胞(HEK293T)和小鼠胚胎成纤维细胞(MEF)均由哈尔滨兽医研究所流行病学与病原监测团队保存。
1.2 主要试剂 小鼠抗Flag单克隆抗体(MAb)、小鼠抗HA MAb、小鼠抗β-actin MAb和Flag抗体亲和糖珠均购自Sigma-Aldrich公司;小鼠抗GFP MAb及兔抗GM130 MAb购自Proteintech公司;山羊抗小鼠IgG Alexa Fluor 568购自Invitrogen公司;完全蛋白酶抑制剂cocktail及X-treme GENE HP DNA转染试剂购自Roche公司;山羊抗小鼠DyLight 800 IgG(H+L)购自KPL公司;反转录试剂盒购自TaKaRa公司;KOD FX Neo DNA聚合酶购自TOYOBO公司;胶回收及质粒提取试剂盒购自Omega公司;T4 DNA连接酶购自NEB公司;DH5α感受态细胞购自南京诺唯赞生物科技有限公司;山羊抗兔IgG Alexa Fluor 647、限制性核酸内切酶及蛋白Marker均购自Thermo scientific公司;RIPA(弱)细胞裂解液及SDS-PAGE蛋白胶配制试剂盒购自上海碧云天生物技术有限公司;病毒DNA/RNA基因组提取试剂盒购自天根生化科技(北京)有限公司;UNIQ-10柱式TRIzol总RNA抽提试剂盒购自生工生物工程(上海)股份有限公司;DAPI染料由哈尔滨兽医研究所流行病学与病原监测团队提供。
1.3 引物设计 根据GenBank中PRV HeN1株UL56基因序列(KP098534.1)及小鼠Nedd4 CDS基因序列(NM_010890.4),分别设计扩增相应基因的特异性引物(表1),并由吉林省库美生物科技有限公司合成。

表1 本研究中使用的PCR引物
1.4 重组质粒的构建 利用PRV HeN1株感染Vero细胞,待细胞病变约为70%时按照病毒基因组提取试剂盒说明书提取PRV基因组。以PRV HeN1株基因组为模板,分别采用特异性引物UL56-Flag-F/R及UL56-GFP-F/R扩增UL56基因。PCR反应程序:95℃ 5 min;95℃ 30 s、65℃ 30 s、72℃30 s,35个循环;72℃10 min。利用HindⅢ和EcoRⅠ分别对引物UL56-Flag-F/R扩增的PCR产物与载体p3×Flag-CMV双酶切;此外,用XhoⅠ和KpnⅠ对引物UL56-GFP-F/R扩增的PCR产物与载体pAcGFP-C1双酶切;随后,利用T4 DNA连接酶分别对双酶切后的PCR产物和相应载体连接。连接产物转化DH5α感受态细胞,取适量菌液涂布于氨苄或卡那抗性LB细菌培养板,分别挑取3个克隆进行后续验证。构建的重组质粒分别命名为p3×Flag-UL56和 pAcGFP-UL56。
利用UNIQ-10柱式TRIzol总RNA抽提试剂盒提取MEF细胞总mRNA并反转录获得cDNA,以该cDNA为模板,分别采用特异性引物mNedd4-HA-F/R及mNedd4-Flag-F/R扩增Nedd4基因。PCR反应程序:95℃5 min;95℃30 s、66℃30 s、72℃2 min,35个循环;72℃10 min。利用BglⅡ和KpnⅠ分别对PCR产物与载体pCMV-HA及p3×Flag-CMV双酶切;利用T4 DNA连接酶对双酶切后的PCR产物和相应载体连接。连接产物转化DH5α感受态细胞,取适量菌液涂布于氨苄抗性LB细菌培养板,分别挑取3个克隆进行后续验证。将构建的重组质粒分别命名为pCMV-HA-mNedd4及p3×Flag-mNedd4。所有用于实验的重组质粒均经过测序鉴定以确定插入外源片段的核苷酸序列正确。
1.5 Co-IP试验 将重组质粒 p3×Flag-UL56和pCMV-HA-mNedd4各3 μg分别转染铺于 6孔细胞培养板的HEK293T细胞进行过表达。转染48 h后,用200 μL/孔含有完全蛋白酶抑制剂cocktail的RIPA(弱)裂解液于4℃振荡作用1 h;12 000 r/min,4℃离心10 min后取上清。每个样品留取40 μL作对照,其余样品与40 μL Flag抗体亲和糖珠于4℃旋转孵育8 h。随后,用预冷的PBS(pH7.4)洗涤珠子3次,2 000 r/min,4℃离心3 min后弃上清,加入 60 μL PBS 及 15 μL 5×loading buffer重悬糖珠,100℃煮样10 min后进行SDS-PAGE。以小鼠抗Flag MAb(1∶5 000)、小鼠抗 HA MAb(1∶10 000)及小鼠抗β-actin MAb(1∶10 000)为一抗,山羊抗小鼠IgG(H+L)(1∶10 000)为二抗 western blot检测 pUL56与Nedd4之间是否存在相互作用。
1.6 激光共聚焦试验 将重组质粒pAcGFP-UL56和pCMV-HA-mNedd4(各1 μg)分别单独转染和共转染HEK293T细胞;转染24 h后,利用4%多聚甲醛4℃固定细胞30 min;3%BSA室温封闭1 h;以小鼠抗HA MAb(1∶1 000)为一抗标记细胞内表达的 HA-mNedd4,兔抗 GM130 MAb(1∶500)特异性地标记细胞内的高尔基体,4℃孵育过夜;次日,用PBS洗涤细胞3次,以山羊抗小鼠IgG Alexa Fluor 568(1∶500)及山羊抗兔 IgG Alexa Fluor 647(1∶500)为二抗,室温作用1 h;用DAPI(1∶2 000)复染细胞核10 min,PBS清洗后利用激光共聚焦显微镜(Zeiss LSM880)观察并拍照,以确定pUL56与Nedd4在细胞内的单独定位及共定位情况。
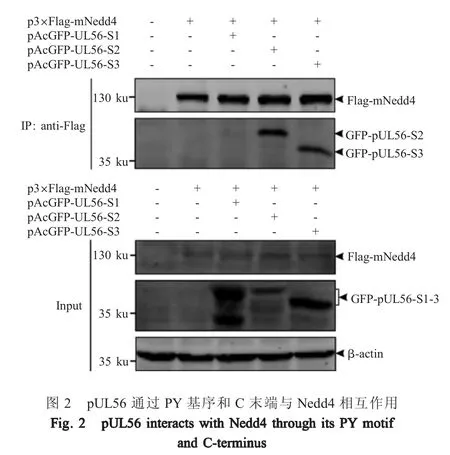
1.7 pUL56的分段Co-IP试验 利用本实验室前期构建的重组质粒pAcGFP-UL56-S1(pUL56 N末端)、pAcGFP-UL56-S2(包含pUL56全部PY基序)、pAcGFP-UL-56-S3(pUL56 C 末端)与 p3×Flag-mNedd4共转染HEK293T细胞,进行Co-IP试验,具体操作步骤参考1.5。以小鼠抗Flag MAb(1∶5 000)、小鼠抗 GFP MAb(1∶10 000)及小鼠抗 β-actin MAb(1∶10 000)为一抗,山羊抗小鼠Dylight 800 IgG(H+L)(1∶10 000)为二抗分别进行western blot检测,以确定pUL56与Nedd4相互作用的关键区域。
1.8 表达pUL56 PY基序突变体重组质粒的构建采用融合PCR方法将PRV pUL56的4个PPXY基序全部突变为AAxY,命名为pUL56-PYM。以重组质粒p3×Flag-UL56-PYM1的构建为例,以 p3×Flag-UL56为模板,利用UL56-Flag-F/UL56-PYM1-R、UL56-Flag-R/UL56-PYM1-F两对引物分别扩增UL56突变片段1及片段2,再以片段1及片段2胶回收产物为模板,利用特异性引物UL56-Flag-F/R扩增UL56突变片段,并连接到p3×Flag-CMV载体中,构建 p3×Flag-UL56-PYM1。在 p3×Flag-UL56-PYM1重组质粒基础上分别构建UL56 PYM2~4丙氨酸突变体。最终,获得重组质粒p3×Flag-UL56-PYM1(74AAxY)、 p3 ×Flag-UL56-PYM2(74AAxY-101AAxY)、p3×Flag-UL56-PYM3(74AAxY-101AAxY-112AAxY)和 p3×Flag-UL56-PYM4(74AAxY-101AAxY-112AAxY-122AAxY)。此外,进一步以p3×Flag-UL56-PYM4为模板,利用引物UL56-GFP-F/R将UL56-PYM4克隆于pAcGFPC1载体,获得重组质粒pAcGFP-UL56-PYM4。所有用于实验的重组质粒均经过测序鉴定以确定插入外源片段的核苷酸序列正确。
1.9 pUL56 PY基序突变体的Co-IP及激光共聚焦试验 为确定pUL56与Nedd4的相互作用能力是否随着PY基序突变的增加而降低,将重组质粒p3×Flag-UL56-PYM1、 p3×Flag-UL56-PYM2、 p3×Flag-UL56-PYM3和 p3×Flag-UL56-PYM4与 pCMV-HA-mNedd4共转染HEK293T细胞,进行Co-IP试验,具体操作步骤参考“1.5 Co-IP试验”。以小鼠抗Flag MAb(1∶5 000)、小鼠抗 HA MAb(1∶10 000)及小鼠抗β-actin MAb(1∶10 000)为一抗,山羊抗小鼠Dylight 800 IgG(H+L)(1∶10 000)为二抗进行 western blot检测。将重组质粒pAcGFP-UL56-PYM4与pCMV-HA-mNedd4共转染HEK293T细胞,以小鼠抗HA MAb(1∶1 000)为一抗,以山羊抗小鼠 IgG Alexa Fluor 568(1∶500)为二抗,进行激光共聚焦试验,检测pUL56 PY基序全部突变后,pUL56与Nedd4在细胞内是否还存在共定位。
1.10 pUL56调控Nedd4表达的western blot检测根据本研究前期实验结果,将pAcGFP、pAcGFPUL56和pAcGFP-UL56-PYM4分别与pCMV-HA-mNedd4重组质粒(各 1 μg)共转染 HEK293T细胞。转染24 h和48 h后,利用含有完全蛋白酶抑制剂cocktail的RIPA(弱)裂解液裂解细胞,收集细胞裂解后释放的蛋白样品,离心取上清后分别以小鼠抗GFP MAb(1∶20 000)、小鼠抗 HA MAb(1∶10 000)及小鼠抗β-actin MAb(1∶10 000)为一抗,山羊抗小鼠Dylight 800 IgG(H+L)(1∶10 000)为二抗进行 western blot检测。采用Image J软件对western blot目的条带灰度值分析pUL56 PY基序在pUL56调控Nedd4的表达中是否发挥作用。
2 结果
2.1 PR V pUL56与Nedd4存在相互作用 采用Co-IP试验验证PRV pUL56是否与宿主蛋白Nedd4存在相互作用。结果显示,过表达的Flag-pUL56能够通过糖珠亲和的Flag抗体吸附于珠子,相反,过表达的HA-mNedd4不能吸附于糖珠,当过表达Flag-pUL56与HA-mNedd4共同与Flag抗体亲和糖珠孵育时,两者均可以吸附于珠子,并被western blot试验检测到(图1A),结果表明pUL56与Nedd4存在相互作用。
利用激光共聚焦试验对pUL56及Nedd4在细胞内的单独定位情况进行检测。结果显示两者均分布在细胞质中,但pUL56主要在细胞质的核周区域,两者没有明显的细胞器定位(图1B)。
进一步通过激光共聚焦试验对pUL56与Nedd4在细胞内的共定位情况进行检测。结果显示,GFP-pUL56与HA-mNedd4均定位于细胞的高尔基体(图1C)。因此,pUL56可将细胞质分布的Nedd4重新定位于细胞的高尔基体,改变了Nedd4在细胞内的定位情况。
2.2 PRV pUL56与Nedd4相互作用的分子机制研究结果 为确定pUL56和Nedd4相互作用的关键区域,利用pUL56分段Co-IP试验验证GFP-pUL56-S1(pUL56 N末端)、GFP-pUL56-S2(包含 pUL56全部PY基序)、GFP-pUL56-S3(pUL56 C末端)与 FlagmNedd4之间的相互作用。结果显示过表达的FlagmNedd4能够通过亲和糖珠的Flag抗体吸附于珠子,当过表达的 Flag-mNedd4与 GFP-pUL56-S1、GFP-pUL56-S2及GFP-pUL56-S3共同作用于Flag抗体的亲和糖珠时,western blot试验仅检测到GFP-pUL56-S2和 GFP-pUL56-S3。表明 GFP-pUL56-S2和 GFP-pUL56-S3与Flag-mNedd4产生了互作,而GFP-pUL56-S1与Flag-mNedd4不存在互作(图2)。因此,PRV pUL56通过其PY基序及C末端区域与Nedd4发生互作。

为确定pUL56 PY基序在pUL56与Nedd4互作中发挥的作用,本研究将pUL56 PY基序突变体分别与Nedd4进行Co-IP试验。结果显示,随着pUL56 PY基序突变的增加,可被western blot试验检测到的HA-mNedd4条带越来越弱。但当pUL56 PY基序全部突变后,HA-mNedd4仍可检测到微弱条带(图3A);激光共聚焦试验结果显示GFP-pUL56 PYM4与HA-mNedd4在细胞质中也存在微弱共定位荧光(图3B)。表明随着pUL56 PY基序突变的增加,pUL56与Nedd4的互作能力降低,pUL56的C末端可能在其突变体PYM4中发挥了与Nedd4互作的功能。

2.3 PRV pUL56下调Nedd4的表达 为研究pUL56是否通过PY基序调控Nedd4的表达,本研究利用western blot分析HA-mNedd4蛋白的表达水平。结果显示,转染24 h后,HA-mNedd4蛋白表达水平在其与GFP-pUL56共表达组明显低于其与GFP共表达的对照组。然而,HA-mNedd4蛋白表达水平在其与GFP-pUL56 PYM4共表达组明显高于其与GFP-UL56共表达组(图4)。转染48 h后,HA-mNedd4蛋白水平在其与GFP-pUL56 PYM4和GFP-pUL56共表达组无明显差异,且均显著低于其与GFP共表达的对照组(图4)。表明PY基序在pUL56介导的下调Nedd4表达过程中发挥作用。此外,除PY基序以外还有其它蛋白基序发挥功能。

3 讨论
病毒在感染、复制及组装过程中,需要多种宿主蛋白的参与和协作。研究病毒蛋白与宿主蛋白之间的互作可为阐明病毒在宿主体内的感染、复制周期及致病机制等方面的研究奠定基础。
PRV是一种具有神经嗜性的α疱疹病毒,其感染宿主后在其外周神经系统迅速建立潜伏感染引起明显的神经症状,且使宿主终生带毒,这种感染、建立潜伏感染和再激活的过程是病毒得以生存的关键[11]。
近期研究结果表明PRV pUL56与PRV对啮齿动物的神经致病性相关,pUL56促进病毒粒子在神经元之间的传播,且对病毒毒力有一定的影响,但其分子机制尚未有文献报道[2]。为研究PRV感染宿主的致病机制及与宿主蛋白相互作用的分子基础,本研究对pUL56的氨基酸序列进行分析发现其编码4个PY基序。大量研究证实含有PY基序的病毒蛋白可与具有WW结构域的宿主蛋白发生相互作用,进而影响病毒的出芽、复制、释放等过程[12-13]。本研究选择宿主WW结构域蛋白Nedd4为研究对象,通过Co-IP和激光共聚焦实验确定了PRV pUL56与Nedd4存在相互作用,pUL56主要定位于细胞的高尔基体,Nedd4广泛分布于细胞质中,当两者共同表达于HEK293T细胞时,pUL56可将细胞质分布的Nedd4重新定位于高尔基体,改变了Nedd4在细胞中的分布[8,14]。进一步,利用pUL56分段Co-IP试验确定了pUL56通过其PY基序及C末端区域与Nedd4发生互作。本研究首次发现不同于单纯疱疹病毒(HSV)UL56,PRV pUL56通过其C末端区域与Nedd4发生互作,但其详细分子机制还有待进一步的研究[8]。研究显示PY基序在介导PRV pUL56与SLA-I分子的相互作用中发挥重要作用,pUL56通过PY基序与目的蛋白发生互作,增加其泛素化并将其带到溶酶体途径而降解[2]。还有研究报道HSV2 pUL56与Nedd4存在相互作用,HSV2 pUL56的PY基序突变后其完全失去了与Nedd4相互作用能力[8]。然而,本研究通过Co-IP和激光共聚焦试验显示随着pUL56 PY基序突变的增加,pUL56与Nedd4的相互作用能力逐渐减弱,但并没有完全失去与Nedd4的互作能力;当PY基序全部突变后,pUL56突变体不再将Nedd4大量定位于高尔基体,pUL56与Nedd4在细胞质中存在微弱的共定位荧光;进一步试验结果表明pUL56通过其PY基序显著下调Nedd4的表达,并且本研究显示除PY基序以外pUL56还存在其它下调Nedd4表达的机制,对pUL56介导Nedd4下调表达的其它分子机制有待于进一步探索。
本研究首次报道宿主蛋白Nedd4与PRV pUL56存在相互作用,并初步阐明了两者相互作用的分子机制及表达调控的关系,为揭示PRV pUL56神经致病机制提供了参考依据。
