骨科祛痰逐瘀方经MAPK/ERK通路诱导血管内皮细胞迁移与血管管腔形成
2019-07-26陈镇秋洪郭驹韩晓蕊何伟张庆文魏秋实
陈镇秋 洪郭驹 韩晓蕊 何伟 张庆文 魏秋实*
1.广州中医药大学第一附属医院关节骨科,广东广州510405
2.广州中医药大学岭南医学中心国家重点学科中医骨伤科学实验室,广东广州510405
3.加拿大阿尔伯塔省埃德蒙顿阿尔伯塔大学医学院外科部,T6G 2R3
4.广州市第一人民医院/华南理工大学第二附属医院放射科,广东广州510006
血管形成与组织内血管化由多种细胞协同作用,主要包括血管内皮细胞(endothelia cell,EC)和周细胞(pericyte)[1]。血管内皮细胞是组织表面的单层扁平上皮,具有构成血管腔结构、吞噬异物、集体免疫等功能[2-3]。周细胞又称Rouget细胞,它通常存在于血管内皮细胞的基膜中,通过直接接触或者旁分泌信号,与内皮细胞发生细胞间的生物学反应,进而监视和稳定内皮细胞的成熟过程[4]。血管化在骨组织重建中发挥重要作用,血管网通过激活骨内细胞,诱导破骨细胞吸收,促进成骨细胞生成新骨,从而维持骨稳态平衡[5]。成功的药物运用,可透过血管内皮细胞和周细胞,在骨组织中发挥重要作用。然而,在目前的药物研发中,化学类药物能够发挥这一作用的较为局限,且副作用较多[6]。
活血化瘀类中药运用于临床由来已久,且作用显著,可用来增强骨血管化治疗效果。其中,祛痰逐瘀方(Qutan Zhuyu Decoction,QZD)由经典方剂四物汤和二陈汤有机组合而成,已被证明具有多项临床药理作用,如心脑血管等疾病[7-8]。在既往的研究中,本团队已经从细胞层面和病理层面报道了QZD可以保护骨髓间充质干细胞脂肪化,从而提高移植后骨髓间充质干细胞的存活率[9-10]。然而,QZD在血管的修复重建、血管内皮细胞的迁徙和增殖作用上知之甚少,限制了QZD在骨血管化的进一步深入拓展。在本研究中,研究团队证明了QZD通过激活类丝裂原活化蛋白激酶(MAPKs)促进血管内皮细胞迁移和血管管腔形成。QZD可能是增加干细胞替代疗法中细胞迁移的有希望的方法。
1 材料与方法
1.1 实验动物
本研究采用C57BL/6小鼠共30只。性别:雄性;级别:SPF级。体质量230~250 g,由广东省医学实验动物中心提供,合格编号为(SCXK(粤)2014-0035);所有动物实验在广州中医药大学动物实验中心执行,编号为(SCXK(粤)2013-0001),并进行标准饲养,标准鼠粮适应性饲养,室温(23±2)℃,自由饮水,间隔光照12 h,并保持定期消毒、通风,各组小鼠按照单笼培养原则执行。临床和动物伦理审查:动物实验经过广州中医药大学动物伦理委员会批准。
1.2 复方QZD含药血清制作
QZD 组成:熟地10 g、芍药10 g、当归10 g、川芎10 g、半夏10 g、陈皮10 g、茯苓 10 g、甘草10 g,实验用中药均统一购自广州中医药大学第一附属医院。按照人与小鼠的剂量换算公式计算小鼠的每日灌胃剂量。上述药物水煎加热浓缩为浓度1 g/mL的药液,4℃保存备用。给药前将小鼠禁食6 h后采用QZD药液灌胃。1次/d,连续7 d。末次灌胃1 h后,水合氯醛0.5 mL/100 g腹腔注射麻醉后,腹主动脉取血。室温静置30 min后取上清液,3 000 r/min离心,分离血清,取上清液。冰冻保存备用。
1.3 细胞培养和处理
培养SVEC细胞(内皮细胞系,来自猿猴病毒转化小鼠)和10 T1/2细胞(周细胞前体细胞,来自小鼠间充质细胞系)(由University of Western Australia徐家科教授馈赠)。细胞维持在DMEM液中进行培养。在标准培养箱中,在5%CO2和95%空气的湿润气氛下及37℃下培养。将3~5次传代的细胞用于实验。
1.4 划痕迁徙实验
将SVEC细胞在24孔板中在DMEM(Sigma公司,美国)中培养。在划痕前将细胞单层在无血清Opti-MEM(Thermo Fisher Scientific公司,美国)中血清饥饿过夜。24 h后用移液管尖端刮擦融合细胞单层以产生划痕伤口。然后用Opti-MEM洗涤细胞两次以除去细胞碎片。在细胞中加入QZD含药血清或bFGF蛋白(Thermo Fisher Scientific公司,美国)的Opti-MEM作为阳性对照在37℃温育16 h。使用Nikon Eclipse TE2000-5显微镜在所选位置的0和16 h时间点捕获时间流逝图像,并且通过Image J软件估计伤口区域。
1.5 管腔形成实验
在开始实验之前,将 SVEC细胞在无血清DMEM中血清饥饿过夜。将Matrigel Matrix(Corning公司,美国)在4℃下解冻过夜,然后使用。24 h后,将基质胶基质加入24孔板(300 μL/孔)的孔中。将板在37℃下孵育30 min以进行聚合。然后将SVEC细胞(血清饥饿过夜)接种到基质胶层上,并使其与Opti-MEM在37℃下连接30 min。然后除去培养基并用QZD含药血清或bFGF蛋白的Opti-MEM替换作为阳性对照。将细胞在37℃下孵育24 h。使用显微镜捕获5个随机选择的视野。使用Image J软件量化管长度和管覆盖面积。
1.6 免疫荧光染色
将10T1/2细胞接入六孔板中,汇合度达到70%,在细胞中加入QZD含药血清或bFGF作为阳性对照。用2%多聚甲醛固定10T1/2细胞。PBS洗3遍。用0.2%~0.5%triton X-100对细胞透化处理;PBS洗3遍。2%BSA封闭30 min,PBS洗两遍。加入一抗α-SMA,室温孵育1 h;加入二抗,室温孵育30~45 min;PBS洗4遍,每次5 min。加入0.5 μg/mL DAPI(PBS配制)染色;用PBS洗3遍;加入20 μL封片剂封片。使用显微镜进行观察10T1/2状态。
1.7 Western blot
将SVEC进行培养,在细胞中加入QZD含药血清或bFGF作为阳性对照,经过30 min后停止反应,将SVEC细胞进行裂解备用。分别制备SDS-PAGE分离胶和浓缩胶后,放入电泳的缓冲液。细胞裂解液与上样缓冲液充分混匀,置沸水浴中加热,冷却后用微量移液器吸取样品与预染蛋白并电泳。转膜缓冲液中制作滤纸、凝胶、PVDF膜,350 mA转膜。取出PVDF膜置于盛有脱脂奶粉的封闭液的平皿中,置于摇床上室温封闭1 h。倾倒封闭液,加入一抗(p-ERK1/2和 p-p38按 1∶1000稀释,β-actin按 1∶1000稀释,Cell signaling technology公司,美国),摇床上室温振荡孵育2~4 h,孵育过夜。回收一抗,用TBST洗涤5次。加入相应鼠源二抗(1∶1000)。TBST洗涤3次,TBS洗涤1次。将发光显色试剂盒材料混合后,加在膜上接触反应后,放入凝胶成像系统中进行成像分析。使用Image J软件进行半定量分析。
2 结果
2.1 QZD含药血清诱导SVEC细胞迁移
为了研究QZD含药血清对内皮细胞迁徙的生物学作用,使用SVEC细胞进行划痕迁徙试验进行测定。结果提示,与PBS对照相比,加入QZD(100 ng/mL和200 ng/mL)对SVEC细胞进行干预后可显著增强SVEC细胞迁移(图1)。bFGF(50 ng/mL)用作阳性对照。

图1 QZD含药血清诱导SVEC细胞迁徙 A:实验组(QZD)、阳性对照组[+bFGF(50 ng/mL)]较正常对照组均有促进SVEC迁徙;B:细胞迁徙实验计数结果(*P<0.05)。Fig.1 QZD-containing serum induces migration of SVEC cells.A:Test group(QZD)and positive control group[+bFGF(50 ng/mL)]promoted SVEC migration compared with normal control group;B:Counting result of cell migration experiment(*P<0.05).
2.2 QZD含药血清诱导管腔结构形成
为明确QZD含药血清对SVEC形成血管结构的作用,结果提示QZD含药血清可刺激SVEC细胞中管状结构的形成(图2A);与PBS对照相比,加入QZD的实验组管腔腔周长度(P<0.05)和管腔面积(P<0.01)显著增强(图2B、2C)。bFGF(50 ng/mL)用作阳性对照。
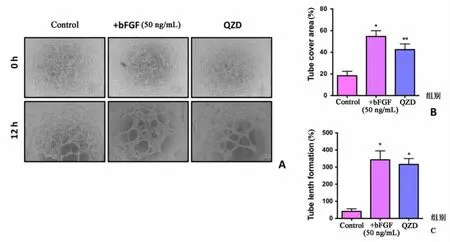
图2 QZD含药血清诱导管腔结果形成 A:实验组(QZD)、阳性对照组[+bFGF(50 ng/mL)]较正常对照组均有促进SVEC管腔结构形成;B:管腔面积计数结果(*P<0.05,**P<0.01);C:管腔腔周长度计数结果(*P<0.05)。Fig.2 QZD-containing serum induces lumen formation.A:Test group(QZD)and positive control Group[+bFGF(50 ng/mL)]promoted the formation of SVEC luminal structure compared with the normal control group;B:Counting result of tube area(*P<0.05,**P<0.01);C:Counting results of cavity length(*P<0.05).
2.3 QZD含药血清促进10T1/2细胞聚集
为了明确QZD含药血清对周细胞的作用,采用QZD对10T1/2细胞进行干预。结果提示,QZD可促进10T1/2细胞聚集。与 PBS对照相比,加入QZD的实验组绿色荧光增强,细胞聚集,并呈管腔状规律性排列(图3)。bFGF(50 ng/mL)用作阳性对照。
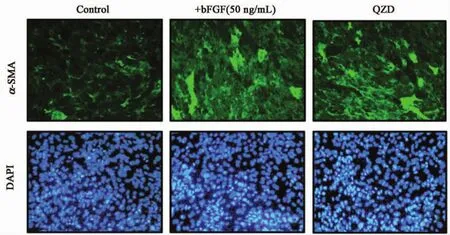
图3 QZD含药血清诱导管腔结果形成。实验组(QZD)、阳性对照组[+bFGF(50 ng/mL)]较正常对照组均促进10T1/2细胞的聚集、荧光表达增强和管腔状有序性排列Fig.3 QZD containing serum induces lumen formation.Test group(QZD)and positive control Group[+bFGF(50 ng/mL)]promoted the aggregation and fluorescence expression of 10T1/2 cells compared with the normal control group.The lumens are arranged in an orderly manner.
2.4 QZD含药血清经MAPK/ERK通路介导SVEC分化
为了明确QZD含药血清的作用机制,采用QZD对SVEC细胞进行干预,在15 min后收集细胞并进行Western blot检测。结果提示,在加入QZD含药血清后的 30 min时,pERK1/2(P<0.01)和 p-p38(P<0.05)的表达量较空白对照组高,但较阳性对照组弱(图4)。bFGF(50 ng/mL)用作阳性对照。

图4 QZD含药血清经MAPK/ERK通路介导SVEC分化 A:实验组(QZD)和阳性对照组[+bFGF(50 ng/mL)]的p-ERK1/2和p-p38的表达水平较空白对照组增高;B:p-ERK1/2与β-actin比值(**P<0.01);C:p-p38与β-actin比值(*P<0.05,**P<0.01)。Fig.4 QZD containing serum mediates SVEC differentiation via MAPK/ERK pathway.A:Expression of p-ERK1/2 and pp38 in test group(QZD)and positive control group[+bFGF(50 ng/mL)]increased compared with normal control group;B:p-ERK1/2 and β-actin ratio(**P<0.01);C:p-p38 and β-actin ratio(*P<0.05,**P<0.01).
3 讨论
血管内皮细胞和周细胞在骨代谢中血管重建具有重要作用,当血管内皮细胞受损时,与周细胞结合并塑造血管的能力降低,骨代谢受到极大的限制,而恢复细胞活性目前仍受到药物的限制[3,11]。中药复方QZD是“祛痰逐瘀法”的代表方,由二陈汤和四物汤组合而成,在临床上广泛运用于股骨头坏死、创伤后骨不愈合等多种骨科疑难疾病。前期研究表明,QZD具有显著促进BMSCs的增殖及促成骨转化能力,进而验证了“祛痰逐瘀法”在预防激素性ONFH可能与调控BMSCs成骨分化有关[9-10]。然而,QZD在血管内皮细胞和周细胞分化,以及血管重建的作用知之甚少。
本研究表明,QZD含药血清可以促进SVEC的迁移,说明QZD含药血清对于血管内皮细胞的分化具有重要的积极性。同时也间接说明了QZD促血管化的潜力可以运用于骨修复及血管重建的。但是,血管重建的过程是复杂的。在多种血管激活物和促进因子的作用下,血管内皮细胞的聚集和组合,形成了血管的基本构架[12]。周细胞毗邻血管内皮细胞的基底部,通常以粘附或者连接的方式进行接触。特别是在逐渐成熟的新生血管中,周细胞从基底部向顶端迁徙和成熟,填补了血管内皮细胞之间的空隙,使血管趋于稳定[13]。因此,在尝试验证QZD含药血清对于血管内皮细胞的血管管腔形成作用的同时,更需要验证QZD含药血清对于周细胞是否具有积极作用。
本研究表明,QZD含药血清不仅可以促进血管管腔形成、增大管腔的面积和腔面周长,同时还能增加周细胞的聚集。由此说明,QZD对于血管重建的作用具有多方面、立体化、复合性的特点。如上所述,血管内皮细胞和周细胞的构建关系影响血管化重建的效果。二者的协同作用对于需要修复的组织或器官是非常关键的步骤,在骨组织中同样存在[14-15]。在不加干预的骨血管化重建治疗期间,只有一小部分细胞能够获得有效的活性恢复和重构[16]。在机能相对下降的慢性病患者或者老年性患者则更加缓慢,甚至导致进一步的骨坏死扩张和不愈合出现。因此,借助QZD提高多细胞的血管重构和修复能力是合理的。
另外,QZD含药血清干预血管内皮细胞的内在机制也值得关注。目前,已报道多种细胞信号传导途径与血管内皮细胞迁移分化的调节有关[17-19]。据报道,细胞外信号调节激酶1/2(ERK1/2)和P38丝裂原活化蛋白激酶(p38)在其中起关键作用,并参与增强血管内皮细胞的迁移[20-21]。在本研究中,QZD含药血清处理30 min后,ERK 1/2和p38磷酸化水平显著增加。这些数据表明,对于QZD含药血清所诱导的血管内皮细胞迁移与分化,ERK 1/2和p38磷酸化的激活是必需的,这也是QZD促进血管化的机制之一。
本研究使用划痕迁徙实验和血管形成试验探究了QZD对SVEC分化的影响,以及对10T1/2对血管管腔成形的作用。结果提示,QZD可促进血管内皮细胞的迁移和管腔重建,且基于激活的ERK1/2和p38活化通路。尽管这一作用仍需要在活体中进行论证,但是QZD卓越的促血管化重建能力为未来的中药精准化治疗奠定了坚实的理论基础和微观实证依据。
