长链非编码RNA CDRT8通过调控YAP1表达对食管癌TE-1增殖的影响
2019-07-12
食管癌是中国常见的恶性肿瘤之一[1]。虽然近年来食管癌的手术切除率较之前有所升高,并发症下降,但是总体治疗效果仍不尽如人意[2]。长链非编码RNA(lncRNA)是一类长度大于200个核苷酸的非编码单链RNA,越来越多的研究表明,lncRNA在细胞的生理和病理过程中发挥重要的作用,与肿瘤的发生发展密切相关[3-4]。本研究拟通过检测食管癌组织中lncRNA-CDRT8的表达水平,并采用质粒构建和转染技术,观察CDRT8对食管癌细胞生物学行为的影响。
1 材料与方法
1.1 标本来源
选取利川市人民医院心胸外科2016年4月至2018年1月手术切除的13例食管癌及癌旁组织,术前患者均未行任何辅助治疗,术后均经病理证实为食管癌。本研究获本院伦理委员会批准,患者对研究方案签署知情同意书。标本取出后立即存放于液氮罐内保存。
1.2 材料
DMEM培养基和胎牛血清购自美国Hyclone公司。人食管癌细胞株TE-1购自中国科学院上海生科院细胞资源中心。Trizol试剂盒和脂质体转染试剂Lipofectamine 2000购自美国Invitrogen公司。PCR引物购自生工生物工程(上海)股份有限公司。实时荧光定量PCR(qPCR)相关试剂盒购自美国Promega公司。CDRT8-shRNA质粒(5′-UACCAUCUCACUCAGUCCCUG -3′)及阴性对照质粒购自广州市锐博生物科技有限公司。细胞周期检测试剂盒和噻唑蓝(MTT)试剂盒购自碧云天生物技术研究所。一抗β-actin、Yes相关蛋白1(YAP1)、细胞周期蛋白E(Cyclin E)和细胞周期蛋白依赖性激酶2(CDK2)购自美国BD公司。
1.3 总RNA抽提及qPCR检测
采用Trizol试剂一步法分别提取组织或细胞总RNA,反转录为cDNA,按照qPCR试剂盒说明书,以GAPDH为内参分别进行qPCR扩增,检测CDRT8和YAP1基因表达水平。
1.4 细胞培养和质粒转染
TE-1培养于含10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2、饱和湿度培养箱中培养。转染前1天,将TE-1细胞接种于六孔板,要求转染时细胞密度为60%,转染CDRT8-shRNA重组质粒为实验组,以转染阴性对照质粒为对照组。转染12 h后更换新鲜培养基。
1.5 流式细胞术检测细胞周期
收集转染后48 h的两组细胞,加入1 mL 70%乙醇固定,4 ℃下过夜,PBS溶液洗涤细胞,加入1 mL碘化丙啶染色液,4 ℃避光孵育30 min后用流式细胞仪检测细胞周期分布。
1.6 MTT检测
转染48 h后,两组细胞制备单细胞悬液,接种于96孔板。于接种后1、2、3、4、5 d分别进行MTT检测,酶标仪检测每孔在波长490 nm处的吸光度(OD)。
1.7 集落形成实验
转染48 h后,两组细胞分别制备单细胞悬液,以1 000个/孔接种于6孔板。培养10 d后,甲醇固定20 min,0.1%结晶紫溶液染色30 min,统计集落形成数。
1.8 Western blot检测
转染48 h后收集两组细胞,提取总蛋白,行SDS-PAGE电泳,电转至 PVDF 膜,封闭液封闭后在4 ℃下一抗孵育过夜,二抗孵育,ECL化学显影剂发光显影。
1.9 统计学方法

2 结果
2.1 CDRT8在食管癌组织中的表达水平
qPCR检测结果显示,CDRT8在肿瘤组织和癌旁组织中的表达水平分别为3.26±0.3和1.10±0.14。CDRT8在食管癌组织中的表达水平明显升高,差异有统计学意义(P<0.01)。见图1。
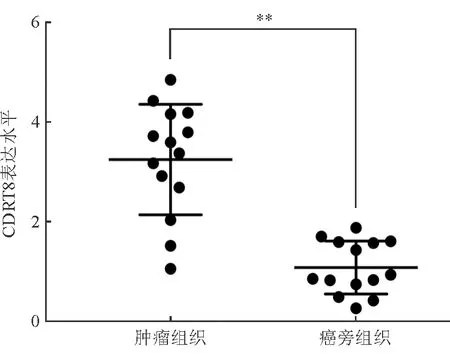
注:与癌旁组织相比,**P<0.01
2.2 CDRT8在两组TE-1细胞中的相对表达水平
以转染CDRT8-shRNA重组质粒为实验组,以转染阴性对照质粒为对照组。质粒转染TE-1细胞后,实验组中CDRT8相对表达水平显著低于对照组(0.29±0.05比1.09±0.29),差异有统计学意义(P<0.05)。
2.3 CDRT8对食管癌TE-1细胞周期的影响
实验组TE-1细胞中细胞周期在G0/G1期的占比明显升高,细胞周期在S期和G2/M期的占比明显降低,提示低表达CDRT8可抑制TE-1细胞周期的进展。见表1。

表1 CDRT8对食管癌细胞TE-1细胞周期的影响(%,)
注:与对照组相比,aP<0.05,bP<0.01
2.4 CDRT8对TE-1细胞活力的影响
自第4 天开始,与对照组相比,CDRT8-shRNA质粒转染的TE-1细胞的活力显著降低,差异有统计学意义(P<0.05),提示CDRT8低表达能有效抑制TE-1细胞的活力,见图2。
2.5 CDRT8对细胞增殖能力的影响
实验组TE-1细胞的集落数目为(93.15±17.58)个,明显低于对照组[(214.70±25.96)个],且差异有统计学意义(P<0.01),提示CDRT8低表达能有效抑制TE-1细胞的增殖能力。

注:与对照组相比,*P<0.05,**P<0.01
2.6 qPCR检测YAP1 mRNA表达水平
实验组TE-1细胞中YAP1 mRNA的表达水平为0.18±0.03,较对照组(1.15±0.34)显著下降,且差异有统计学意义(P<0.05),提示CDRT8低表达可促进YAP1 mRNA的表达。
2.7 Western blot 结果
与对照组相比,实验组TE-1细胞中YAP1、Cyclin E和CDK2蛋白表达水平显著下降,提示CDRT8低表达可促进YAP1 mRNA的表达。见图3。
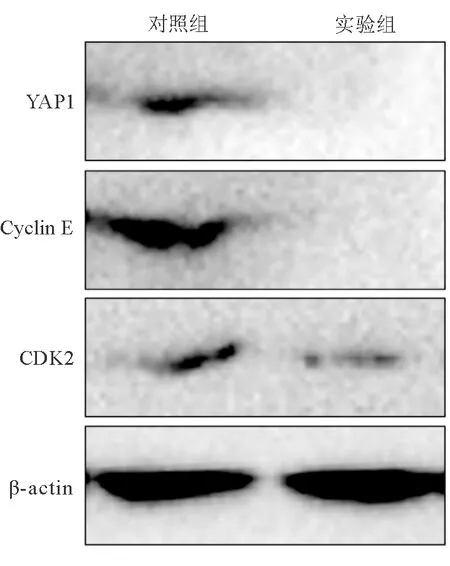
图3 两组细胞中YAP1、Cyclin E和CDK2蛋白的表达情况
3 结论
继微RNA(miRNA)之后,lncRNA极大丰富了机体中高度复杂的RNA调控网络[5]。lncRNA是RNA聚合酶Ⅱ转录的副产物,以往被误判为基因组转录的“噪音”,其是由大于200个核苷酸构成的单链非编码RNA,在人类基因组中巨大的数量和多方面的机制调控越来越引起人们的重视[6]。lncRNA已经成为多种疾病诊断、治疗及预后评估的生物标志物[7]。近年来研究表明,PEG10、POU3F3、CCAT2、PVT1等众多lncRNA参与食管癌的发生发展[8-11]。目前尚无CDRT8在人食管癌组织中的表达情况及其是否功能性参与食管癌的发生、发展的公开报道。
本研究采用qPCR技术对人食管癌组织进行检测,结果均表明CDRT8在食管癌组织中的表达显著高于癌旁组织,CDRT8可能在食管癌中发挥致癌作用。利用shRNA质粒构建和转染技术可在短期内大量降低细胞内CDRT8的表达水平。本研究干扰细胞内CDRT8的表达,在qPCR检测结果证实细胞内CDRT8含量降低后,流式细胞术结果表明细胞周期停滞,MTT比色法和集落形成实验结果均表明TE-1细胞的增殖和集落形成被显著抑制,进一步证明CDRT8在人食管癌中发挥肿瘤促进因子的作用,参与调控食管癌的发生、发展。
YAP1是一种抑癌蛋白,在多种肿瘤中表现为高表达,参与肿瘤的发生、发展和恶性转化[12]。有研究表明,YAP1 mRNA和蛋白在食管癌组织中明显上调,且YAP1与食管癌的转移和肿瘤分期密切相关[13-14]。本研究结果表明,抑制CDRT8表达后食管癌细胞中YAP1基因表达降低。YAP1可促进Cyclin E合成,Cyclin E结合并激活CDK2,Cyclin E-CDK2激酶复合物使细胞启动DNA合成,不可逆转地进入S期,增强细胞的增殖能力,促进肿瘤的发生发展[15-16]。抑制CDRT8表达后,食管癌细胞中Cyclin E和CDK2蛋白表达降低。CDRT8如何影响YAP1基因表达的分子机制尚未明确。lncRNA可作为分子海绵与miRNA结合进而抑制miRNA对下游相应靶基因mRNA的沉默效应。CDRT8可能通过与食管癌特异miRNA之间形成负反馈调节,进而影响YAP1基因的表达,发挥致癌作用。
综上所述,CDRT8在食管癌组织中呈高表达,干扰CDRT8的表达能显著抑制食管癌细胞的增殖,其可能的机制是下调YAP1基因的表达,为lncRNA成为食管癌治疗的新靶点提供了理论依据。
