重症肌无力的发病机制及临床治疗研究进展
2019-07-11高丽李壮林
高丽 李壮林
【摘要】 重症肌无力(myasthenia gravis,MG)是神经内科常见的一种骨骼肌无力为特征的自身免疫性疾病,主要由于神经肌肉接头处传递功能障碍造成的,具有明确的抗原靶标,主要与烟碱型乙酰胆碱受体(acetylcholine receptor,AChR)的破坏有关。目前针对MG的治疗方法主要有免疫抑制剂、胆碱酯酶抑制剂、胸腺切除、中医治疗等措施来控制和延缓疾病进展。本综述对MG的发病机制、治疗方法及治疗进展等进行了介绍。
【关键词】 重症肌无力; 发病机制; 治疗进展
doi:10.14033/j.cnki.cfmr.2019.09.082 文献标识码A 文章编号 1674-6805(2019)09-0-04
Pathogenesis and Clinical Treatment Progress of MG/GAO Li,LI Zhuanglin.//Chinese and Foreign Medical Research,2019,17(9):-176
【Abstract】 Myasthenia gravis(MG) is one kind of autoimmune disease characterized by skeletal muscle weakness,which occurs more often in neurology.MG is mainly caused by dysfunction of neuromuscular junctions.It has a clear antigenic target,and is related to the destruction of nicotinic acetylcholine receptor(AChR).By now,the methods of treatment for MG mainly include immunosuppressive agents,cholinesterase inhibitors,thymectomy,and Chinese Medicine treatment to control and delay disease progression.This article reviewed the pathogenesis,treatment methods and treatment progress of MG.
【Key words】 Myasthenia gravis; Pathogenesis; Treatment progress
First-authors address:Rongchang Pharmaceuticals.LTD,Yantai 264006,China
重症肌无力(myasthenia gravis,MG)是一种罕见的由自身抗体引起的神经肌肉疾病,属于获得性自身免疫性疾病,发病机制由体液免疫、细胞免疫及补体共同参与,其特征是神经肌肉接头传递功能障碍,骨骼肌无力。MG疾病发作反复,迁延难愈,MG患者的临床特点是易疲劳,活动后加重,休息后减轻,晨轻暮重,并且随时间出现波动性。此外,有研究表明味觉障碍是MG患者的非运动症状,尤其存在于胸腺瘤和严重延髓麻痹的MG患者中[1]。MG的发病率具有地区差异性,在全球范围内为每10万人中有0.3~3例[2],30岁左右的女性和65岁左右的男性有较高的发病率。随着诊断技术的不断发展,MG的发病率和患病率不断增加,尤其是老年人[3]。MG主要有Ⅰ型眼肌型、Ⅱ型轻度全身型、Ⅲ型重度激进型、Ⅳ型迟发重症型和Ⅴ型肌萎缩型。目前MG的治疗方法主要包括免疫抑制剂、胆碱酯酶抑制剂、胸腺切除、中医治疗及免疫调节治疗,如静脉注射免疫球蛋白和血浆置换等,由于MG的异质性,没有国际公认的标准治疗方法适合所有患者。
1 发病机制
MG的发病机制到目前为止并不是十分清楚,其主要病因是患者机体中出现针对突触后膜上成分的病理性抗体所致,主要是抗乙酰膽碱受体(acetylcholine receptor,AchR)。自身抗体结合突触后膜上的AchR导致神经肌肉接头突触后膜中AchR分子数量的减少,不能产生足够的终板电位,引起肌肉传递功能障碍。约80%~85%的MG患者具有抗AchR抗体,抗体的浓度可能代表疾病的严重程度,放射免疫沉淀法是标准的抗AchR抗体的检测方法,根据抗AchR抗体浓度的不同给予不同的治疗。胸腺是产生抗AchR抗体的主要场所,绝大部分MG患者伴有胸腺增生、胸腺瘤和淋巴滤泡增生等[4],且诱导抗AchR抗体产生的组分通常位于这些增生的组织中。目前研究表明抗AchR抗体的致病机制主要有:抗AchR抗体与AchR结合后激活补体导致AchR破坏;抗AchR抗体会阻断AchR中乙酰胆碱的结合位点;抗AchR抗体使AchR发生交联,加快AchR的降解速率。
MG还与多种相关致病抗体有关,比如抗骨骼肌特异性酪氨酸激酶(skeletal muscle-specific tyrosine kinase,MuSK)抗体、抗低密度脂蛋白受体相关蛋白4(low density lipoprotein receptor-related protein 4,LRP4)抗体[5]、乙酰胆碱酯酶(acetylcholinesterase,AChE)抗体和抗兰尼碱受体(ryanodine receptor,RyR)抗体等有关[6]。MUSK是一种跨膜蛋白,位于突触后膜上,具有促进AchR聚集的作用。抗MUSK抗体与MUSK结合后会抑制AchR的聚集。由抗MUSK抗体引起的MG相对于由抗AchR抗体造成的MG更加难以治疗[7]。LRP4位于突触后膜,与其受体结合后激活MUSK,启动信号级联反应,促进AchR的聚集。AChE位于突触间隙,能够水解乙酰胆碱,从而终止信号传递。抗RyR抗体可能并不直接导致肌肉无力的产生,但可能是疾病的标志物之一。此外,B淋巴细胞亚群和T淋巴细胞亚群及与MG相关的微小RNA都与MG的发病有密切的联系。有研究表明胸腺异常的MG患者的生发中心具有不同于正常人的miRNA和mRNA表达模式[8],这些miRNA和mRNA参与炎症、免疫应答、细胞周期调节和抗细胞凋亡共同的调节途径,参与支持胸腺中GC的形成。在合并胸腺瘤的MG患者中,随着胸腺瘤的进展,分泌白细胞介素10的B10细胞在肿瘤组织中浓度上调,然而随着MG严重程度的增加,其在外周血中浓度下调,暗示B10细胞与MG的发病有一定的联系[9]。
2 治疗
由于MG的多样性,目前没有全世界统一的治疗方案,但随着对MG发病机制的不断深入了解,治疗方面得到了很大的进展,根据病情的严重程度采取不同的治疗是目前认可的治疗方案。对于病情较轻的MG患者给予药物治疗,病情较重的患者可以结合药物治疗和胸腺切除治疗。MG的治疗现在主要分为目免疫抑制剂、糖皮质激素、胆碱酯酶抑制剂、胸腺切除、中医治疗等措施来控制和延缓疾病进展。
2.1 免疫抑制剂
免疫抑制剂通常用于不能耐受激素治疗或者激素治疗效果不理想的MG患者,疗效和不良反应与剂量成依赖性关系,具有用量小和起效快的优势。在MG治疗药物中占有重要地位,免疫抑制剂分为非生物和生物制剂。治疗MG的非生物免疫抑制剂主要有硫唑嘌呤、霉酚酸酯、甲氨蝶呤、环磷酰胺、环孢菌素A和他克莫司,是临床上常用的治疗重症肌无力的免疫抑制剂。治疗MG常用的生物制剂包括利妥昔单抗(rituximab)、依库丽单抗(eculizumab)、依那西普(etanercept)和贝利单抗(belimumab)。对于病情严重的MG患者会采用血浆置换和大剂量注射免疫球蛋白的救急治疗。
硫唑嘌呤、霉酚酸酯、甲氨蝶呤和环磷酰胺都是通过影响DNA的合成,抑制细胞生长来发挥免疫抑制作用。单独服用硫唑嘌呤治疗MG的效果不佳,作用缓慢,联合泼尼松龙加硫唑嘌呤的治疗可以很大程度上提高MG的治疗效果[10]。霉酚酸酯对于MG的治疗效果目前仍存有争议,有研究表明,MG患者服用霉酚酸酯停药后会导致MG患者病情恶化[11]。甲氨蝶呤通常用于治疗硫唑蝶呤治疗无效的患者,一项大型临床研究表明,服用氨甲喋呤可以有效减轻MG患者的症状且耐受性良好[12]。环磷酰胺是一种细胞毒免疫抑制药物,不良反应较多,有研究表明静脉注射环磷酰胺治疗MG比其他免疫抑制剂的效果更有效且复发率更低[13]。
环孢菌素A和他克莫司属于钙调节磷酸酶抑制剂,通过抑制钙调节磷酸酶进而阻止T细胞活性和细胞因子的应答,减少炎症反应,适用于所有亚型的MG患者。环孢菌素起效快,通常在一个月左右,可单药或联合激素给药,但是其不良反应较严重,具有肾毒性[14]。他克莫司的药效比环孢菌素A高很多,最近一项关于他克莫司对于治疗MG的临床效果表明相对低剂量的他克莫司能够影响多种免疫系统靶标,有效缓解MG患者的病情[15]。对Medline、EMBASE、Cochrane图书馆和四个中国数据库的数据库进行了符合条件的研究,得出结论表明他克莫司可降低MG病情的严重程度[16]。
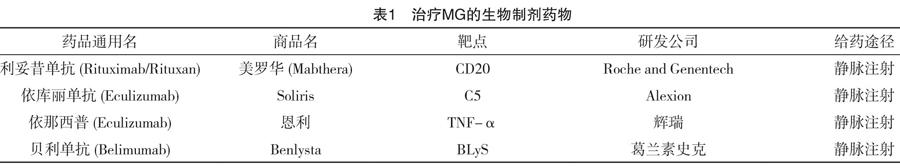
单克隆抗体药物的出现给MG患者带来了希望,在MG治疗中取得了突飞猛进的进展。Rituximab是一种能够特异性结合B细胞表面CD20靶点的人鼠嵌合型单克隆抗体,其作用机制主要是结合CD20靶点后会使CD20固化在B细胞膜上,并使B细胞发生溶解反应,使之凋亡,其耐受性好,不良反应少。有研究证明Rituximab在治疗MG时不仅能够使B细胞发生凋亡,而且还能抑制T细胞的功能,在治疗MG方面具有独特的效果[17]。有研究表明在浆细胞合成免疫球蛋白的过程中产生过多游离的轻链,这种过多的轻链水平被认为是不同全身炎症-自身免疫疾病中B细胞活性的直接标志物,经过Rituximab治疗后的MG患者,游离的轻链的水平会发生明显下降,并且病情也会得到缓解[18]。Eculizumab是一种能够结合补体C5蛋白的人源性单克隆抗体,能抑制C5蛋白裂解为C5a和C5b,防止补体复合物生成,从而起到终端补体抑制的作用。一项大型的临床研究表明对于由抗AchR抗体造成的全身型MG患者进行了长期的Eculizumab治疗,与安慰剂组相比患者的病情得到了显著的缓解,并且恶化率也得到了明显的下降[19]。2017年美国FDA批准Eculizumab用于治疗由抗AchR抗体造成的全身型MG。Etanercept是腫瘤坏死因子α(TNF-α)拮抗剂,属于全人源抗体,是全球第一个用于治疗强直性脊柱炎和类风湿关节炎的生物制剂。一项临床试验表明,在炎症因子水平较高的MG患者中给予Etanercept治疗会较大程度抑制MG病情的发展[20]。Belimumab是以B淋巴细胞刺激因子(B lymphocyte stimulating factor,BLyS)为靶点的全人源单克隆,能够阻止BLyS与其在B细胞上的受体结合,从而促使B细胞凋亡,从而抑制免疫反应。目前尚无充足的临床数据证明Belimumab在治疗MG的有效性,关于评估Belimumab在治疗由抗MuSK抗体造成的全身型MG患者疗效的国际Ⅱ期临床试验正在进行中[21]。治疗MG的生物制剂药物见表1。
2.2 糖皮质激素
糖皮质激素是国际上通用的治疗重症肌无力的首选药物,具有抑制免疫应答、抗毒、抗炎的功能等,能够改善大部分MG患者的病情。激素疗法要掌握足量、缓慢减量和适当维持剂量的原则,由于MG患者个体差异性大,单纯用糖皮质激素主料效果不太理想,一般联合免疫抑制剂给药效果会更好,其不良反应主要包括骨质疏松、骨折和类固醇糖尿病等。有临床数据显示糖皮质激素联合环磷酰胺治疗MG,患者的临床症状得到明显改善切副作用小[22]。
2.3 胆碱酯酶抑制剂
胆碱酯酶抑制剂是对症治疗MG,治标不治本,难以治愈MG,长期使用会导致很多不良反应,如恶心、腹泻和神经肌肉接头处病变加重等,不能单独给药,应服从小剂量递增疗法。其代表药物有嗅吡斯的明、新斯的明和安贝氯铵,其中嗅吡斯的明是最常用的胆碱酯酶抑制剂药物。
2.4 胸腺切除
绝大部分MG患者伴有胸腺增生、胸腺瘤和淋巴滤泡增生等,这些增生的组织往往会产生很多抗自身免疫的抗体,尤其是抗AchR抗体,随着医学技术的不断发展,胸腺切除术已经相当成熟。胸腺切除术可以有效抑制活跃的生发中心和疾病诱导的T淋巴细胞持续释放。但是胸腺切除术不适用于迟发型MG患者,这类患者的胸腺往往是萎缩的。对于MG合并良性胸腺瘤的患者来说,胸腺切除术无疑是最好的治疗方法。一项大型回顾性资料显示,从1990-2016年接受胸腺切除术治疗的大部分MG患者病情均得到缓解,具有长期效果[23]。
2.5 中醫治疗
中医上讲MG归为“痿症”,主要以健脾扶正、阴阳平衡、补益元气、养血平肝、强筋壮骨等为主要治疗宗旨,调节机体免疫力促进血液循环。对于脾胃肾虚的患者给予参芪扶正注射液,具有扶正固本,提高身体免疫机能的作用。对于中气亏损的MG患者给予黄芪、人参、白术、茯苓、炙甘草、当归、红花和丹参补气益血,温肾益阳。一项临床数据结果表明,经过中医补气疗法辅佐治疗的MG患者疾病得到缓解且复发率降低相比较于没有经过辅佐治疗的患者[24]。对于脾肾两虚的MG患者给予黄芪复方治疗。对于肝肾亏虚的MG患者给予牛膝、山萸肉、杜仲、熟地黄、白芍、鸡血藤、天麻、桑枝、鹿衔草和黄芪治疗。针灸辨证治疗主要针对脾肾气虚所导致的咀嚼吞咽无力等症状的MG患者,疗效较好。总体而言,中医治疗MG对患者的不良反应较小,但症状缓解慢,治疗时间长。一项大型临床数据结果表明,短期中医补气疗法
3 展望
MG是一类高发病率的器官特异性自身免疫性疾病,严重影响患者的正常生活和身心健康,给社会和家庭带来严重的负担。MG患者的临床和病理表现多样,发病机制复杂,由于MG患者的个体化差异,比如病情严重程度、病发年龄、体内抗体状态、并发症和不良反应等,应给予个体化的治疗方案,准确的MG分型是选择治疗的第一步。此外,有研究表明给予轻度MG患者进行适当的体育锻炼可以增强患者的功能性骨骼肌参数,对健康成人一般建议进行的体育锻炼可以安全地应用于轻度MG患者[25]。随着科技的不断发展和对MG发病机制的不断了解,治疗MG的新方法可能得到普遍应用,从而给予MG患者更安全、有效和精准的治疗。
参考文献
[1] Zhu K,Chen J,Li J,et al.Myasthenia Gravis With Thymoma,Manifesting as AChR-Ab-Positive,Distinct Bulbar Palsy Accompanied by Dysgeusia:A Case Series and Review of Literature[J].Front Neurol,2018,9:214.
[2] McGrogan A,Sneddon S,De Vries C S.The incidence of myasthenia gravis:a systematic review[J].Neuroepidemiology,2010,34(3):171-183.
[3] Zieda A,Ravina K,Glazere I,et al.A nationwide epidemiological study of myasthenia gravis in Latvia[J].Eur J Neurol,2018,25(3):519-526.
[4] Rodriguez C P M,Al-Hajjar M,Huda S,et al Clinical features and diagnostic usefulness of antibodies to clustered acetylcholine receptors in the diagnosis of seronegative myasthenia gravis[J].JAMA Neurol,2015,72(6):642-649.
[5] Ohnari K,Okada K,Higuchi O,et al.Late-onset Myasthenia Gravis Accompanied by Amyotrophic Lateral Sclerosis with Antibodies against the Acetylcholine Receptor and Low-density Lipoprotein Receptor-related Protein 4[J].Intern Med,2018,57(20):3021-3024.
[6] Park K H,Waters P,Woodhall M,et al.Myasthenia gravis seronegative for acetylcholine receptor antibodies in South Korea:Autoantibody profiles and clinical features[J].PLoS One,2018,13(6):e0200225.
[7] Mantegazza R,Antozzi C.When myasthenia gravis is deemed refractory:clinical signposts and treatment strategies[J].Ther Adv Neurol Disord,2018,11:175.
[8] Sengupta M,Wang B D,Lee N H,et al.MicroRNA and mRNA expression associated with ectopic germinal centers in thymus of myasthenia gravis[J].PLoS One,2018,13(10):e0205464.
[9] Lu Y,Meng F,Yang Y,et al.Significance of B10 cell in patients with thymoma complicated with myasthenia gravis[J].Oncotarget,2017,8(43):73774-73786.
[10] Dube M,Sodani A,Chouksey D.Outcome of Myasthenia gravis treated with high-dose prednisolone and azathioprine:A single centre ambispective study from India[J].Acta Neurol Taiwan,2017,25(6):106-119.
[11] Dimachkie M M,Abuzinadah A R,Barohn R J,et al.Myasthenia gravis exacerbation after discontinuing mycophenolate:A single-center cohort study[J].Neurology,2016,87(19):2067-2068.
[12] Pasnoor M,He L,Herbelin L,et al.A randomized controlled trial of methotrexate for patients with generalized myasthenia gravis[J].Neurology,2017,88(4):417-418.
[13] Buzzard K A,Meyer N J,Hardy T A,et al.Induction intravenous cyclophosphamide followed by maintenance oral immunosuppression in refractory myasthenia gravis[J].Muscle Nerve,2015,52(2):204-210.
[14] Nakamura S,Kaneko S,Shinde A,et al.Prednisolone-sparing effect of cyclosporin A therapy for very elderly patients with myasthenia gravis[J].Neuromuscul Disord,2013,23(2):176-179.
[15] Bao J,Gao S,Weng Y,et al.Clinical efficacy of tacrolimus for treating myasthenia gravis and its influence on lymphocyte subsets[J].Rev Neurol,2018,175(1-2):65-72.
[16] Takizawa T,Kojima M,Suzuki S,et al.New onset of myasthenia gravis after intravesical Bacillus Calmette-Guerin:A case report and literature review[J].Medicine(Baltimore),2017,96(46):e8757.
[17] Marino M,Bartoccioni E,Alboini P E,et al.Rituximab in myasthenia gravis:a“to be or not to be”inhibitor of T cell function[J].Ann N Y Acad Sci,2018,1413(1):41-48.
[18] Basile U,Marino M,Napodano C,et al.Serological Immunoglobulin-Free Light Chain Profile in Myasthenia Gravis Patients[J].J Immunol Res,2018,2018(3):1-8.
[19] Howard J F J,Barohn R J,Cutter G R,et al.A randomized,double-blind,placebo-controlled phase Ⅱ study of eculizumab in patients with refractory generalized myasthenia gravis[J].Muscle Nerve,2013,48(1):76-84.
[20] Lee J S,Joo I S,Seok J I.Widely varying TNF-alpha levels in patients with myasthenia gravis[J].Neurol Sci,2009,30(3):259-262.
[21] Guptill J T,Soni M,Meriggioli M N.Current Treatment,Emerging Translational Therapies,and New Therapeutic Targets for Autoimmune Myasthenia Gravis[J].Neurotherapeutics,2016,13(1):118-131.
[22]趙辉.糖皮质激素联合环磷酰胺治疗重症肌无力的疗效及安全性[J].临床研究,2018(6):98-99.
[23] Gonzalez L R,Riquelme U A,Fuentealba S M,et al.Results of extended transsternal thymectomy for Myasthenia gravis.Experience with 58 patients[J].Rev Med Chil,2018,146(4):460-469.
[24] Yang X Q,Liu L,Yang W Y,et al.Efficacy and Safety of the TCM Qi-Supplementing Therapy in Patients with Myasthenia Gravis:A Systematic Review and Meta-Analysis[J].Evid Based Complement Alternat Med,2017,2017(5):6512572.
[25] Westerberg E,Molin C J,Sp?rndly N S,et al.The impact of physical exercise on neuromuscular function in Myasthenia gravis patients:A single-subject design study[J].Medicine,2018,97(31):e11510.
