磁共振成像表现为双侧桥臂病变的多系统萎缩4例报告及临床分析
2019-07-09姜季委林梅青周雅萍赵久晗商秀丽
姜季委,林梅青,周雅萍,赵久晗,商秀丽
多系统萎缩(multiple system atrophy,MSA)是一种病因不明的以进展性自主神经功能障碍,伴帕金森症状、小脑性共济失调和锥体束征为主要临床表现的神经系统变性疾病[1]。MSA仍以病理诊断为“金标准”,神经影像学以壳核、小脑、脑桥萎缩、脑桥基底部“十字征”、壳核背外侧缘“裂隙征”为相对特异表现[2]。目前,国内仅见散发的3例MSA伴有双侧桥臂病变的报道,且均未对出现该影像特点的可能机制做进一步探讨[3,4]。因此,我们收集4例磁共振成像表现为双侧桥臂对称异常信号的多系统萎缩患者的临床资料,总结出现该影像学表现的可能原因及临床意义,以提高临床认识。
1 临床资料
病例1:男,55岁,以“走路不稳1 y、进行性加重伴晕厥两次”为主诉于2018年1月入我院。患者1 y前出现走路不稳,不能走直线,未在意;半年前出现排尿困难、尿潴留,于沈阳军区总医院行“经尿道前列腺电切术”症状未见明显改善;3个月年前逐渐出现饮水呛咳但无吞咽困难,于当地医院诊断“脑梗死”,对症治疗后上述症状未见好转,3个月来间断晕厥两次。否认高血压、糖尿病及冠心病病史。否认家族类似疾病史。神经查体:卧位血压:130/86 mmHg,站立5 min后立位血压:81/53 mmHg。意识清楚,言语略笨拙,双侧瞳孔等大同圆,直径3.0 mm,对光反射灵敏,无眼震,四肢肌力Ⅴ级,四肢腱反射亢进,肌张力略高,双侧Hoffmann征和Babinski征阳性。深浅感觉查体未见明显异常,双侧指鼻、轮替及跟膝胫试验欠稳准,余查体未见明显异常。实验室检验未见确切异常。膀胱彩色多普勒超声示:排尿后膀胱内可见尿液回声,容量约297 ml。头部MRI+弥散成像示:双侧小脑中脚对称性斑片状长T1、长T2、Flair高信号影,DWI示高信号、相应ADC图略高信号;T2WI可见脑桥垂直高信号影(见图1)。随访10 m后患者走路不稳、构音障碍较前加重,出现尿失禁,临床诊断为多系统萎缩(MSA-C型)。
病例2:男,62岁,以“走路不稳1 y、加重伴言语不清5 m”为主诉于2016年12月入我院。患者1 y前出现走路不稳,5 m前上述症状加重出现走路右偏,容易摔倒,伴言语不清,伴饮水呛咳及吞咽困难,尿频、尿不尽,自述性功能减退。否认高血压、糖尿病史以及类似家族病史。吸烟史30 y,10支/d,饮酒史40 y,日常饮酒量不超过1两白酒。卧位血压130/85 mmHg(1 mmHg=0.133 kPa),站立3 min后血压为98/60 mmHg。神经查体:意识清楚,言语不清,回答切题,面部表情少,双侧瞳孔等大正圆,直径3.0 mm,对光反应灵敏,双眼水平眼震;四肢肌力Ⅴ级,肌张力偏高,四肢腱反射亢进,双侧病理征未引出,颈强阴性,深浅感觉未见确切异常。左上肢轮替试验差,双侧指鼻试验、跟膝胫试验欠稳准。头部MR示:双侧桥臂对称性团状长T1、长T2信号影,DWI序列呈明显高信号,相应ADC图略高信号影;T2WI可见脑桥十字征(见图2)。随访1 y后,患者上述症状明显加重,出现尿潴留和双下肢轻度抖动,临床诊断多系统萎缩(MSA-C型)。
病例3:女,55岁,以“双下肢无力16 m,进行性加重伴尿失禁1 y”为主诉于2017年10月入我院。患者16 m无明显诱因出现双下肢无力,直线走路不能,自述踩棉花感,于当地医院诊断“亚急性联合变性”,对症治疗后未见好转,1 y前出现尿频、尿失禁,行“盆底肌修复”康复锻炼,半年来频繁摔倒。否认高血压、糖尿病及冠心病病史。否认家族类似疾病史。神经查体:卧位血压:115/80 mmHg,站立3 min后立位血压:80/55 mmHg。神志清楚,言语正常,双侧瞳孔等大同圆,直径3.0 mm,对光反射灵敏,双眼水平眼震、轻度垂直眼震,四肢肌力Ⅴ级,肌张力正常,四肢腱反射活跃,双侧Hoffmann征和Babinski征未引出。深浅感觉查体未见明显异常,双侧指鼻及跟膝胫试验欠稳准,余查体未见明显异常。头部MR示:双侧桥臂对称性斑片状长T1、长T2信号影,DWI和ADC示高信号影;T2WI示脑桥基底部十字征(见图3)。随访半年,患者出现排尿困难,腰椎MRI未见明显异常,走路不稳较前加重,临床诊断为多系统萎缩(MSA-C型)。
病例4:男,61岁,以“头晕、走路不稳15 m”为主诉于2018年4月入我院。患者15 m前出现头晕、无恶心、呕吐,走路不稳向左右倾斜,于当地医院诊断“脑梗死”,对症治疗后未见好转,1 y前自述出现阳痿,尿频、尿急,偶有晕厥,此后上述症状进行性加重,影响日常生活。否认高血压、糖尿病及冠心病病史。否认家族类似疾病史。神经查体:卧位血压135/80 mmHg,站立3 min后立位血压93/60 mmHg。意识清楚,轻度构音障碍,双侧瞳孔等大同圆,直径3.0 mm,对光反射灵敏,无眼震,四肢肌力Ⅴ级,肌张力正常,四肢腱反射亢进,双侧Hoffmann征和Babinski征阳性。深浅感觉查体未见明显异常,双侧指鼻及跟膝胫试验欠稳准,余查体未见明显异常。头部MR示:双侧小脑中脚对称性斑片状长T1、长T2、Flair高信号影,脑桥基底部清晰可见“十字征”(见图4)。随访9 m,患者运动较前明显缓慢,双下肢轻度震颤,查体:双眼水平眼震,四肢肌张力升高,频繁摔倒,临床诊断为多系统萎缩(MSA-C型)。
2 讨 论
桥臂又称小脑中脚(middle cerebellar peduncle,MCP)由来自对侧脑桥核的传入纤维(脑桥小脑束)组成,连接小脑和脑桥基底部。既往研究发现,双侧桥臂对称性病变可见于神经系统变性疾病、脑血管病、脱髓鞘疾病、代谢性疾病等,神经系统变性疾病累及双侧桥臂较多见于橄榄脑桥小脑萎缩(olivopontocerebellar atrophy,OPCA)[5]。目前已摒弃OPCA这一称呼,将MSA以“多巴胺反应不良的帕金森综合征”为突出表现的临床亚型称为MSA-P型;以“小脑性共济失调”为突出表现的临床亚型称为MSA-C型。迄今为止,MSA确诊以病理学证实“在少突胶质细胞胞浆内存在以α-突触核蛋白为主要成分的嗜酸性包涵体,并伴有橄榄脑桥小脑萎缩或黑质纹状体变性”为金标准[6]。由于临床病理活检的难实现性以及MSA与帕金森病和进行性核上性麻痹症状的重叠性,使得MSA诊断较难,尤其是疾病早期,误诊率较高[7]。
2008年,Gilman等人提出的第二版MSA诊断标准,可能的、很可能的MSA等级诊断标准仍着重于临床症状和体征,影像学无特征性诊断,目前临床上仍以脑桥“十字征”和壳核外侧缘“裂隙征”为MSA相对特异的影像学表现[8]。脑桥“十字征”的出现表明脑桥和脑桥小脑束变性而皮质脊髓束的相对保留。Horimoto等人观察42例MSA患者头部磁共振动态演变,将“十字征”划分为6期:0期,未见异常信号;Ⅰ期,脑桥开始出现垂直的T2WI高信号影;Ⅱ期,脑桥可见清晰的垂直高信号影;Ⅲ期,开始出现水平的高信号影;Ⅳ期,可见清晰的十字征;Ⅴ期,水平线前方的脑桥腹侧出现高信号,或脑桥腹侧体积变小伴脑桥基底部萎缩。同样地,将“裂隙征”划分为4期:0期,未见异常;Ⅰ期,一侧壳核外侧缘出现裂隙样高信号;Ⅱ期,双侧壳核外侧缘均出现裂隙样高信号,但一侧不十分明显;Ⅲ期,两侧可见清晰高信号[9]。本文仅例2和例4可见清晰的“十字征”,且存在小脑、脑桥基底部明显萎缩,应为Ⅴ期;而例1和例3均仅在T2WI可见清晰的垂直线,归为Ⅱ期。由此可见脑桥十字征在疾病不同时期表现的不典型性,疾病早期甚至可以不出现。
目前,国外已有报道称传统的MRI显示壳核、脑桥以及小脑的病变特点可能有助于鉴别MSA的不同亚型:壳核萎缩或壳核背外侧缘裂隙状T2高信号更常见与MSA-P,脑桥萎缩以及脑桥基底部十字征则更常见于MSA-C型[10]。 本文4例均以小脑性共济失调为突出表现,临床诊断MSA-C型,且均存在脑桥基底部改变而无明显的壳核萎缩或壳核外侧缘裂隙征,与上述文献报道的结论一致。然而,尽管上述典型的影像学表现对诊断MSA以及分型有一定提示作用,有研究发现脑桥“十字征”对诊断MSA-C亚型的敏感性仅有50%,T2WI显示壳核外侧缘“裂隙征”的敏感性仅为72%;其他的改变如T1W1显示壳核萎缩、低信号影或使用1.5T磁共振敏感性和特异性则更低[11]。近几年,有学者在MSA影像学诊断中发现,双侧小脑中脚对称性高信号在MSA的诊断中,尤其是MSA-C亚型的特异性高达82%,敏感性可达100%[2,12]。我国一项纳入237例MSA的回顾性分析显示MSA-P亚型出现双侧桥臂对称高信号约为19%,MSA-C亚型可高达25.3%,由此可见,双侧桥臂病变在MSA中是不可忽视的[13]。我们4例MSA-C型患者仅2例存在明显的脑桥十字征,但均存在清晰可见的双侧桥臂对称性T2高信号,因此,早期识别双侧桥臂高信号,结合其与经典的影像学表现对于诊断MSA疾病的不同时期以及鉴别不同亚型有重要的提示意义。
MSA的病因尚不十分明确,病理学证实其所有亚型中均存在大量沉积的少突胶质细胞包涵体。目前有两种途径的发病机制普遍被接受,一是先出现以“α-突触核蛋白”阳性包涵体为特征的少突胶质细胞变性,导致神经元髓鞘变性脱失,进而导致神经元变性坏死;二是神经元本身的“α-突触核蛋白”异常聚集,造成神经元变性死亡[14]。少突胶质细胞包涵体及其引起的神经退行性变典型的分布在多个系统中,包括纹状体、橄榄-脑桥-小脑系统、脑干自主神经核(蓝斑、中缝核、迷走神经背核等)、脊髓和骶骨内脏感觉通路[15]。这可能是不同的启动子靶向作用于不同的少突胶质细胞亚型或不同的启动子表达α-突触核蛋白的效率不同所致[16]。因此,神经变性疾病累及双侧桥臂存在直接的机制,脑桥、小脑或者橄榄优先丢失浦肯野细胞或灰质核团,随后双侧桥臂变性出现T2WI高信号。有报道称MSA-C亚型的患者中,43%可存在对称性双侧桥臂高信号[17]。我们报道的4例患者均为MSA-C型,且都存在脑桥的萎缩和随后双侧桥臂的变性,与上述研究结论一致,由此表明双侧桥臂高信号在MSA出现的合理性以及对MSA-C型的重要提示作用。
3 总 结
综上所述,部分脑桥“十字征”或壳核外缘“裂隙征”不典型甚至不存在的MSA患者可出现明显的双侧桥臂病变,这可能与疾病的不同时期及不同亚型有关。MSA累及双侧桥臂更常见与MSA-C型,正确识别该影像特点有助于MSA的早期诊断。
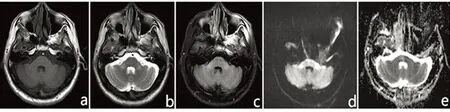
图1 双侧小脑中脚可见对称性斑片状长T1、长T2、FLAIR高信号影(a~c);DWI序列呈明显高信号,相应位置表观弥散系数图呈略高信号影(d、e);小脑、脑干可见轻度萎缩,脑桥基底部隐约可见“十字征”
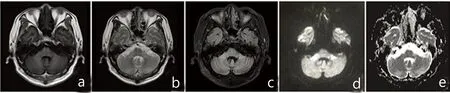
图2 双侧小脑中脚可见对称性斑片状长T1、长T2、FLAIR高信号影(a~c);DWI序列呈明显高信号,相应位置表观弥散系数图呈略高信号影(d、e);脑桥基底部清晰可见“十字征”;小脑、脑干明显萎缩
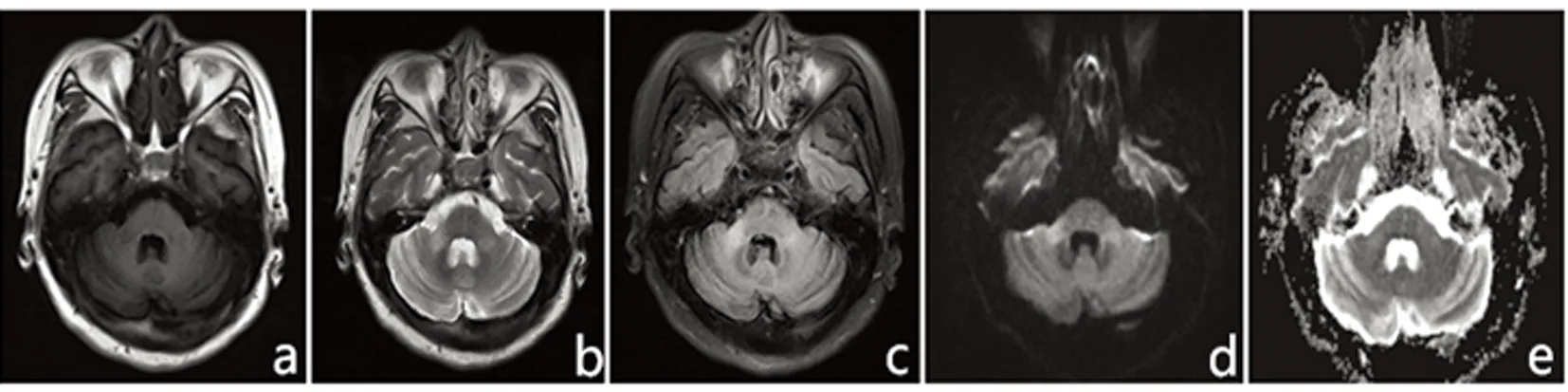
图3 双侧小脑中脚可见对称性斑片状长T1、长T2、FLAIR高信号影(a~c);DWI序列和相应ADC图均呈明显高信号影(d、e);T2加权成像示:脑桥基底部“十字征”,垂直线较水平线更明显;小脑、脑干明显萎缩
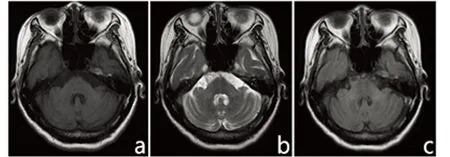
图4 双侧小脑中脚可见对称性斑片状长T1、长T2、FLAIR高信号影(a~c);脑桥基底部“十字征”,小脑、脑干以及双侧桥臂均明显萎缩
