复方薄荷酚酸酊的质量标准研究
2019-07-05李静娴陈万生
李静娴,陈万生
(海军军医大学长征医院药学部,上海 200003)
复方薄荷酚酸酊(曾用名 皮炎酊)是海军军医大学长征医院的非标准制剂[批准文号:总制字(2017)F506036],为本院皮肤科外用特色制剂之一,由苯酚、地塞米松磷酸钠、硼酸、薄荷脑、乙醇组成,临床上主要用于治疗夏季接触性皮炎、皮肤瘙痒症,疗效显著。由于该制剂的质量标准制定年代较早,原标准仅通过测定苯酚和地塞米松磷酸钠的含量来控制制剂的质量,对其他主要成分缺乏相应的质量控制,不能全面反映制剂质量。作者查阅资料,发现2015年版《中华人民共和国药典》(简称药典)二部中地塞米松磷酸钠的含量测定以地塞米松磷酸酯为定量指标[1],有别于原标准中用地塞米松磷酸钠对照品直接测定含量。为了更好地控制复方薄荷酚酸酊的质量,保证临床用药安全,本研究以薄荷脑为定性指标建立了薄层色谱法(TLC);以硼酸为定量指标建立了酸碱滴定法;以苯酚、地塞米松磷酸钠为定量指标,用地塞米松磷酸酯代替地塞米松磷酸钠作为对照品,重新建立HPLC定量法;并测定了乙醇的含量,制定了合理限度标准。
1 仪器和试药
1.1 仪器 Agilent 1260高效液相色谱仪(美国Agilent公司,包括G1311C输液泵、G1329B自动进样器、G1316A柱温箱、G4212B-DAD二极管阵列检测器和Chemstation色谱工作站);XA205DU型电子天平(瑞士梅特勒-特利多仪器公司,精度0.01 mg);WL-901 Vortex旋涡振荡混和器(海门市其林贝尔仪器制造有限公司);SK7200H型超声仪(上海科导超声仪器有限公司);硅胶G薄层板(预制板,青岛海洋化工集团公司)。
1.2 试药 复方薄荷酚酸酊(海军军医大学长征医院药学部自制,批号150424、150520、150528、150604、150611、150616、150710、150721、150722、150813,规格60 ml/瓶);地塞米松磷酸酯对照品(含量98.6%,批号101116-201102)、苯酚对照品(批号100509-201203)、薄荷脑对照品(批号110728-200506)购自中国食品药品检定研究院;硼酸(批号20140305)、甘露醇(批号20120220)、甲苯、乙酸乙酯、甲醇、无水乙酸钠、冰乙酸(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,德国默克公司);香草醛(纯度>98%,广东光华科技股份有限公司);氢氧化钠滴定液(0.1 mol/L,自行配制标定,F值1.002 2);注射用水(自制)。
2 方法和结果
2.1 薄荷脑定性鉴别[1]取复方薄荷酚酸酊(批号150721、150722、150813)适量作为供试品溶液。取薄荷脑对照品加甲醇制成浓度为10 mg/ml的对照品溶液。按照制剂处方制备不含薄荷脑的复方薄荷酚酸酊阴性样品,取阴性样品适量作为阴性对照。按2015年版药典四部TLC实验操作方法[1],吸取上述3种溶液各2 μl,分别点于同一硅胶G薄层板上,以甲苯-乙酸乙酯(V∶V=19∶1)为展开剂,展开,取出,晾干,喷以5%香草醛浓硫酸-乙醇(1∶4)的混合溶液,在105 ℃加热至斑点显色清晰。在供试品色谱中,与对照品色谱相应的位置上,显相同颜色的斑点,阴性对照色谱无相应斑点,见图1。
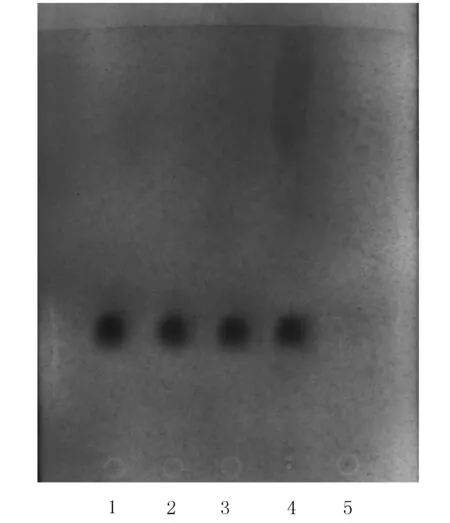
图1 薄荷脑的TLC谱图Figure 1 TLC chromatograms of menthol1~3:供试品溶液(批号分别为150721、150722、150813);4:薄荷脑对照品溶液;5:缺薄荷脑的阴性对照溶液
2.2 乙醇含量测定 取1.2项下10个批次的复方薄荷酚酸酊,各精密量取25 ml,置150~200 ml蒸馏瓶中,加水约50 ml。按照2015年版药典四部通则0711乙醇量测定法第二法蒸馏法[1],测定样品中乙醇的含量,每批次平行测定2份。结果显示,样品中乙醇的含量为44%~50%,平均值为47%,拟定复方薄荷酚酸酊中乙醇的量在42%~52%。
2.3 酸碱滴定法测定硼酸的含量[1]
2.3.1 供试品溶液的制备 精密量取复方薄荷酚酸酊(批号150721、150722、150813)5 ml,置锥形瓶中,加入甘露醇4 g及新沸过的冷水10 ml,摇匀,即得。
2.3.2 样品含量测定 供试品溶液中加入酚酞指示液4滴,用标定好的氢氧化钠滴定液(0.1 mol/L)滴定至溶液显粉红色。每1 ml氢氧化钠滴定液(0.1 mol/L)相当于6.184 mg的硼酸(H3BO3)。结果见表1。
表 1 复方薄荷酚酸酊中苯酚、地塞米松磷酸钠和硼酸的含量测定结果Table 1 Content determination results of phenol,dexamethasone sodium phosphate and boric acid in Fufangbohefensuan tincture 标示量%)
2.4 苯酚、地塞米松磷酸钠的含量测定
2.4.1 色谱条件 色谱柱为Agilent Zorbax SB C18柱(250 mm×4.6 mm,5 μm);流动相:0.05 mol/L乙酸钠溶液(用冰乙酸调节pH至4.0)-甲醇(40∶60);检测波长:242 nm;进样量20 μl;流速:1.0 ml/min;柱温:30 ℃。
2.4.2 溶液配制 (1)苯酚对照品储备液:精密称取苯酚对照品1.004 0 g,置50 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,得浓度为20.08 mg/ml的苯酚对照品储备液。(2)地塞米松磷酸酯对照品储备液: 精密称取地塞米松磷酸酯对照品10.4 mg,置25 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,得浓度为0.41 mg/ml的地塞米松磷酸酯对照品储备液。(3)混合对照品溶液:分别精密量取苯酚对照品储备液、地塞米松磷酸酯对照品储备液各2.5 ml,置同一50 ml量瓶中,用流动相稀释并定容至刻度,摇匀,得苯酚、地塞米松磷酸酯浓度分别为1004、20.5 μg/ml的混合对照品溶液。(4)供试品溶液:精密量取复方薄荷酚酸酊(批号150721、150722、150813)5 ml,置50 ml量瓶中,加流动相稀释并定容至刻度,摇匀,做为供试品溶液。(5)阴性对照溶液:按复方薄荷酚酸酊处方分别配制缺苯酚和地塞米松磷酸钠的阴性样品,再按(4)项下方法制成阴性对照溶液。
2.4.3 专属性实验 分别取苯酚、地塞米松磷酸酯混合对照品溶液、供试品溶液、苯酚阴性对照溶液和地塞米松磷酸钠阴性对照溶液,按 2.4.1项下色谱条件测定,记录色谱图,结果见图2。结果显示,供试品与对照品溶液中待测物保留时间一致,阴性对照溶液在相应位置无吸收峰,表明制剂中其他成分对苯酚和地塞米松磷酸钠的测定无干扰。
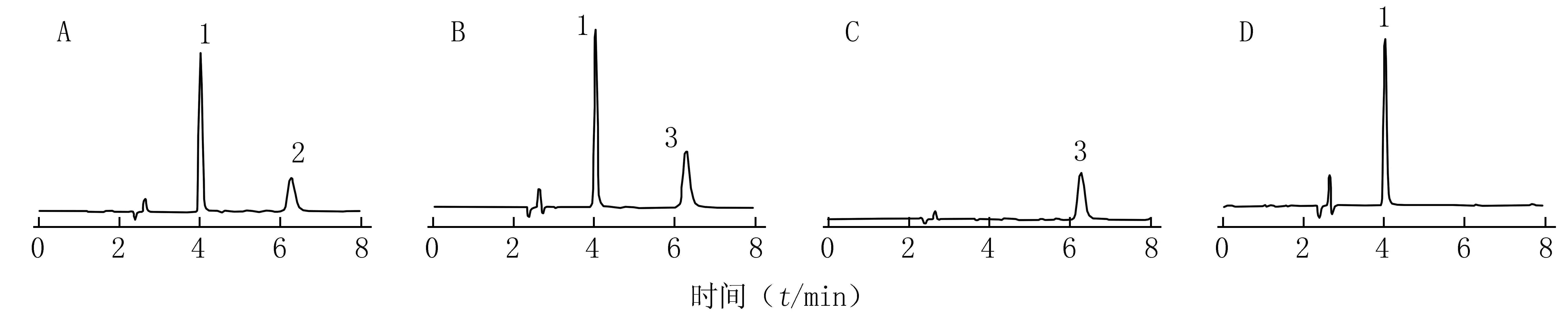
图2 复方薄荷酚酸酊的HPLC谱图Figure 2 HPLC chromatograms of Fufangbohefensuan tinctureA:混合对照品溶液;B:供试品溶液;C:缺苯酚的阴性对照溶液;D:缺地塞米松磷酸钠的阴性对照溶液;1:苯酚;2:地塞米松磷酸酯;3:地塞米松磷酸钠
2.4.4 线性关系考察 (1)精密量取2.4.2(1)项下苯酚对照品储备液2.5、4、5、6、7.5 ml,置100 ml量瓶中,用流动相定容至刻度,摇匀,制成浓度为502、803、1004、1205、1506 μg/ml的系列对照品溶液;(2)取2.4.2(2)项下地塞米松磷酸酯对照品储备液适量,采用逐级稀释的方法,加流动相制成地塞米松磷酸酯浓度分别为82.0、41.0、20.5、10.25、5.13 μg/ml的对照品溶液,按2.4.1项下色谱条件进行测定,分别以苯酚和地塞米松磷酸酯浓度(c)和峰面积(A)进行线性回归分析,得回归方程分别为A1=1.015 2c1-8.977 6(r=0.999 9)、A2=33.095c2-26.232(r=0.999 9)。结果表明,苯酚和地塞米松磷酸酯分别在502~1506 μg/ml和5.13~82.0 μg/ml范围内线性关系良好,计算得地塞米松磷酸钠在5.61~89.63 μg/ml范围内线性关系良好。
2.4.5 精密度实验 精密吸取 2.4.2(3)项下混合对照品溶液适量,按2.4.1项下色谱条件平行进样6次。结果显示,苯酚、地塞米松磷酸酯峰面积的RSD分别为0.11%和0.36%(n=6),表明仪器精密度良好。
2.4.6 重复性实验 精密量取复方薄荷酚酸酊(批号150721)适量,按2.4.2(4)项下方法平行制备6份供试品溶液,再按2.4.1项下色谱条件进样测定。结果显示,苯酚和地塞米松磷酸钠峰面积的RSD分别为0.20%和0.30%(n=6),表明方法重复性良好。
2.4.7 稳定性实验 取同一供试品溶液分别于0、2、4、6、8、12、16、24、36、48 h按2.4.1项下色谱条件进样分析,结果苯酚、地塞米松磷酸钠的色谱峰面积RSD分别为0.35%和0.37%(n=10),结果表明供试品溶液在室温下放置48 h稳定。
2.4.8 加样回收率实验 分别精密量取已知含量的复方薄荷酚酸酊(批号150721)5 ml,置9个100 ml量瓶中,分为3组,每组3份,每组分别精密加入苯酚、地塞米松磷酸酯对照品储备液各2、2.5、3 ml,用流动相定容至刻度,摇匀。按2.4.1项下色谱条件进样,记录峰面积,苯酚按外标法以峰面积计算含量,地塞米松磷酸钠按外标法以峰面积乘以1.093 1计算含量[1],结果苯酚和地塞米松磷酸钠的平均加样回收率分别为(99.4±0.36)%、(100.1±0.29)%(n=3)。
2.4.9 含量测定 取批号分别为150721、150722、150813的复方薄荷酚酸酊样品,按照2.4.2(4)项下方法制备并按2.4.1项下色谱条件进样后记录峰面积,分别按外标法以峰面积计算苯酚的含量,按外标法以峰面积乘以1.093 1计算地塞米松磷酸钠的含量,结果见表1。
3 讨 论
3.1 乙醇含量限度标准的确定 酊剂系指将原料药物用规定浓度的乙醇提取或溶解而制成的澄清液体制剂[1],2015年版药典四部通则对酊剂的有关规定中新增了乙醇量的检查要求。乙醇量测定法分为气相色谱法和蒸馏法,本制剂中乙醇含量>30%,考虑到日常检测的便捷,使用了第二法蒸馏法进行乙醇量的测定。经过10个批次的测定并计算,最终确定42%~52%为复方薄荷酚酸酊中乙醇量的合格范围,为日常检测提供了依据。
3.2 苯酚和地塞米松磷酸钠的含量测定 2015年版药典出版以前,多数文献[2-5]报道地塞米松磷酸钠的含量测定以地塞米松磷酸钠为指标物,同样包括本制剂原质量标准。本研究参照2015年版药典二部中地塞米松磷酸钠的含量测定方法[1],以地塞米松磷酸酯作为指标物对地塞米松磷酸钠进行定量研究,波长为242 nm。根据制剂处方,复方薄荷酚酸酊中苯酚的浓度高达10 mg/ml,为地塞米松磷酸钠浓度的50倍,原标准中采用样品直接过滤进样,供试品中苯酚浓度过高,系统残留严重,且不利于色谱柱的维护和保养。因此,作者参照文献[6-8]中苯酚的线性范围,将复方薄荷酚酸酊稀释至原浓度的1/2、1/5、1/10、1/20,作为供试品进行研究,并在不同浓度下同时监测地塞米松磷酸钠的响应强度,发现将复方薄荷酚酸酊稀释为原浓度的1/10,即苯酚浓度为1 mg/ml时最优。流动相的选择则根据文献[2]进行比例上的优化,使苯酚和地塞米松磷酸钠的峰形及分离度更好。
综上所述,本研究建立的方法简便,并增加了乙醇含量检查,使复方薄荷酚酸酊的质量标准更加完善,为该制剂的质量控制提供了更准确、可靠的依据。
