MiR-29b inhibitor基因修饰的骨髓间充质干细胞分化潜能的实验研究
2019-06-24马钢肖云峰刘晓民丁良甲刘长路高博
马钢 ,肖云峰 ,刘晓民 ,丁良甲 ,刘长路 ,高博
1.内蒙古医科大学第二附属医院,内蒙古呼和浩特 010030;2.内蒙古医科大学新药安全评价研究中心,内蒙古呼和浩特 010100
关节软骨损伤在临床十分常见,可由外伤、手术、感染和退变等引起。关节软骨自身修复能力有限[1],损伤继发退变,最终引起疼痛、关节活动受限等一系列临床症状。目前修复软骨损伤常用的治疗方法能够取得一定疗效,但长期表现不尽如人意。microRNA-29b(miR-29b)家族在调控BMSCs成骨分化过程中具有正性调节作用[2],miR-29b对BMSCs来源的软骨细胞的肥大化进程具有重要的正性调控作用。所以我们推断,抑制通过miR-29b调控软骨细胞肥大化的进程,可能会延缓组织工程软骨的衰退和钙化。2017年1月—2018年1月内蒙古医科大学选用新西兰大白兔2只,研究miR-29b inhibitor基因修饰的骨髓间充质干细胞成骨分化及成软骨分化的潜能。
1 材料与方法
1.1 实验动物
新西兰大白兔2只,雌性不限,体重2.6 kg左右,均由内蒙古大学动物实验中心提供。
1.2 主要材料、试剂和设备
兔 BMSCs 分 离 液 1.090;CD34、CD44、CD45、CD105抗兔单克隆抗体;DMEM/F12培养基、LDMEM培养基;miR-29b inhibitor过表达慢病毒;鼠抗兔I型胶原单克隆抗体;鼠抗兔Ⅱ型胶原单克隆抗体;SABC二抗试剂盒。台式离心机,恒温二氧化碳细胞培养箱,倒置相差显微镜(1×70),流式细胞仪。
1.3 方法
首先做兔BMSCs的分离、纯化、培养和鉴定,其次做慢病毒的miR-29b inhibitor质粒基因转染,然后做BMSCs分别向成骨及成软骨细胞诱导分化及检测。
实验分为实验组A、实验组B和对照组予以不同的处理,实验组A:miR-29b inhibitor基因修饰的BMSCs分别进行成骨及成软骨诱导培养;实验组B:P3代BMSCs分别进行成骨及成软骨诱导培养;对照组:P3代BMSCs采用10%FBS的DMEM完全培养液连续培养。显微镜下观察细胞形态、生长及增殖情况。成骨培养后进行碱性磷酸酶染色、茜素红染色、I型胶原免疫组化染色,成软骨培养后进行甲苯胺蓝染色、番红O、Ⅱ型胶原免疫组化染色。所有计数阳性细胞率的方法均为随机计数3张玻片,每片200倍镜下随机取2个视野,采用网格计数法计算阳性细胞的百分比。
1.4 统计方法
应用SPSS 13.0统计学软件进行数据统计学处理,所有数据均以(±s)表示,多组间比较采用方差分析,组间比较采用Welch’s anova检验,P<0.05为差异有统计学意义。
2 结果
BMSCs体外向成骨及成软骨细胞诱导分化及检测。
2.1 成骨诱导分化
碱性磷酸酶染色:实验组A、实验组B与对照组比较,差异有统计学意义(P<0.05),实验组A与实验组B比较,差异有统计学意义(P<0.05),见表1。
表1 各组不同时间点碱性磷酸酶染色(±s)
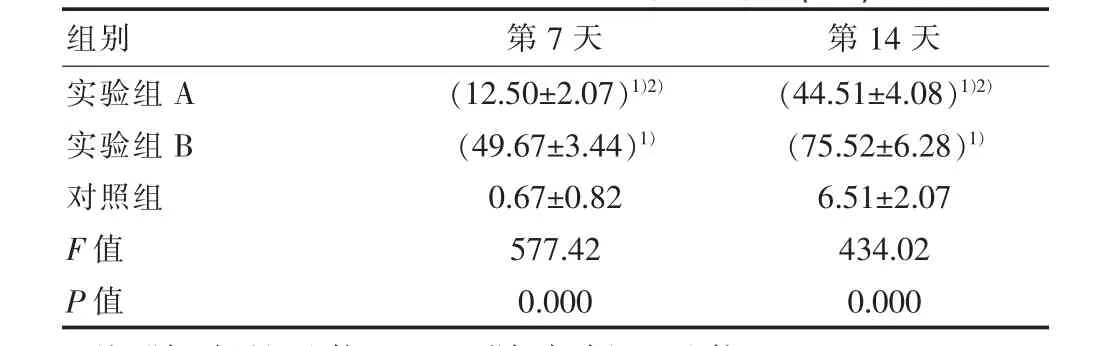
表1 各组不同时间点碱性磷酸酶染色(±s)
注:1)与对照组比较,P<0.05;2)与实验组 B 比较,P<0.05。
组别 第7天 第14天实验组A实验组B对照组F值P值(12.50±2.07)1)2)(49.67±3.44)1)0.67±0.82 577.42 0.000(44.51±4.08)1)2)(75.52±6.28)1)6.51±2.07 434.02 0.000
茜素红染色:实验组A:表现出成骨细胞特性,但较实验组B缓慢。实验组B:14 d后表现出明显的成骨细胞特性。对照组:未见明显细胞团块,未见钙化结节。
Ⅰ型胶原免疫细胞化学染色:实验组A、实验组B与对照组比较,差异无统计学意义(P<0.05),实验组A与实验组B比较,差异有统计学意义。见表2。
表2 各组不同时间点Ⅰ型胶原免疫组化染色(±s)
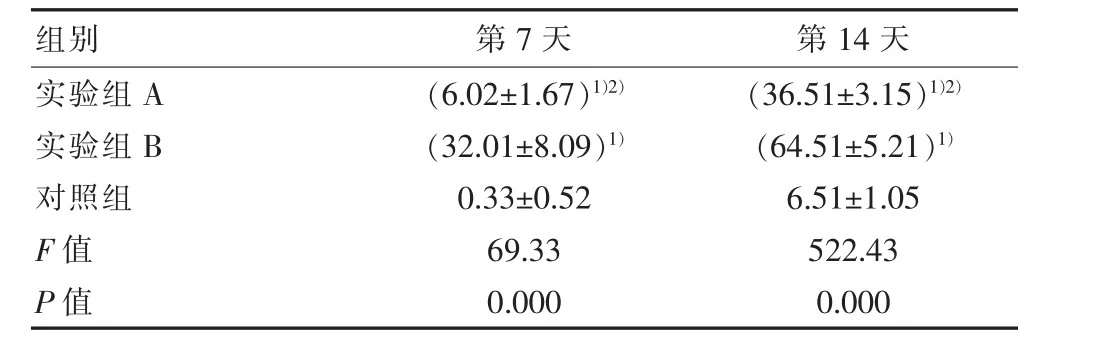
表2 各组不同时间点Ⅰ型胶原免疫组化染色(±s)
注:1)与对照组比较,P<0.05;2);2)与实验组 B 比较,P<0.05。
组别 第7天 第14天实验组A实验组B对照组F值P值(6.02±1.67)1)2)(32.01±8.09)1)0.33±0.52 69.33 0.000(36.51±3.15)1)2)(64.51±5.21)1)6.51±1.05 522.43 0.000
2.2 成软骨诱导分化
显微镜下:实验组A与B组无明显差别;甲苯胺蓝染色:实验组A与实验组B相似;对照组14 d时可见胞浆异染弱阳性。
番红O染色:实验组A与实验组B相似,对照组14 d时可见胞浆异染弱阳性。
Ⅱ型胶原免疫细胞化学染色:实验组A与实验组B相似,实验组A、实验组B与对照组比较,差异有统计学意义(P<0.05),见表3,实验组 A与实验组B比较,差异无统计学意义(P>0.05)。
表3 各组不同时间点Ⅱ型胶原免疫组化染色(±s)
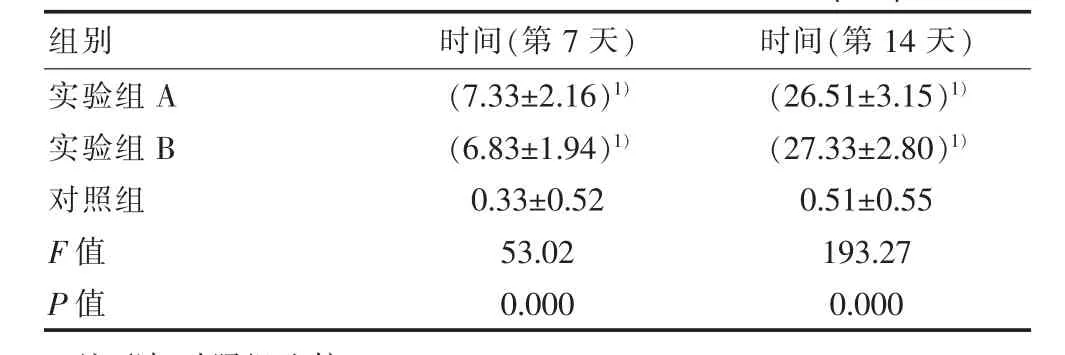
表3 各组不同时间点Ⅱ型胶原免疫组化染色(±s)
注:1)与对照组比较,P<0.05。
组别 时间(第7天) 时间(第14天)实验组A实验组B对照组F值P值(7.33±2.16)1)(6.83±1.94)1)0.33±0.52 53.02 0.000(26.51±3.15)1)(27.33±2.80)1)0.51±0.55 193.27 0.000
3 讨论
该次研究结果显示Ⅰ型胶原免疫细胞化学染色实验组 A:(6.02±1.67)、实验组 B:(32.01±8.09)与对照组(0.33±0.52)比较,差异有统计学意义(P<0.05),实验组A与实验组B比较,差异有统计学意义。这表明 miR-29b inhibitor基因修饰的骨髓间充质干细胞成骨分化能力较P3代骨髓间充质干细胞弱 (P<0.05);Ⅱ型胶原免疫细胞化学染色实验组A (7.33±2.161)、实验组 B(6.83±1.94)与对照组(0.67±0.82)比较,差异有统计学意义(P<0.05),实验组A与实验组B比较,差异无统计学意义(P>0.05),提示成软骨分化能力两者相似。BMSCs具有多向分化潜能,在不同的环境中可以向各自不同的方向进行分化[3]。而骨软骨组织工程的目的就是将BMSCs进行定向诱导分化,使其成为所需的成骨细胞或软骨细胞。目前研究的目的基因主要有刺激软骨增殖分化和基质形成、抑制软骨细胞肥大和成骨分化、抗炎性反应、抑制衰老和抑制凋亡等。但是,大多数基因转染方法都是以促进软骨组织修复为目的,提供促进蛋白合成类因子的基因,忽略了抑制软骨肥125-大和成骨化等基因的调节作用,因此长期表现都不尽如人意。microRNA广泛存在于自然界中,是一种大小约为22nt的内源性非编码的单链RNA,是调控BMSCs成骨分化的正调控基因,并且影响BMSCs成软骨分化过程,使之向肥大化软骨细胞分化,在胚胎发育及细胞增殖分化和凋亡等多种生命活动中发挥着重要的作用[4-6]。
在该实验中,miR-29b inhibitor基因修饰的BMSCs经诱导成骨分化,显微镜下观察到细胞可贴壁,并逐渐形成集落层叠状,然后形成细胞团块或结节状,分泌骨基质并最终形成矿化结节。进行ALP染色、茜素红染色、Ⅰ型胶原免疫细胞化学染色,发现诱导后的细胞ALP染色可见细胞胞浆内出现红色颗粒;茜素红染色可见钙结节形成;Ⅰ型胶原免疫细胞化学染色呈阳性,细胞被染成黄褐色,但较P3代BMSCs表现出较弱的成骨特性。推断miR-29b inhibitor虽然影响BMSCs的成骨诱导,但可能因miR-29b inhibitor持续分泌不足或条件培养基的成骨诱导作用强于miR-29b inhibitor的作用,最终仍表现出成骨细胞生物学特性,向成骨细胞分化。而经成软骨诱导后,P3代BMSCs和miR-29b inhibitor基因修饰的BMSCs甲苯胺蓝染色均可见细胞内、外的物质均被染成紫红色,说明细胞合成分泌酸性的糖胺多糖;番红O染色可见细胞聚集部位被染成红色,表明局部合成和分泌糖胺多糖;Ⅱ型胶原免疫细胞化学染色呈阳性,细胞被染成棕褐色,进一步证实细胞表现出软骨细胞的生物学特性,向软骨细胞分化。在苗莹[7]等的研究中发现当BMSCs向肥大化的软骨细胞分化过程中,miR-29b表达量呈渐增状态,表明miR-29可能是软骨细胞肥大化的正性调节因子。而miR-29b表达上调对软骨细胞肥大化进程有促进作用,而抑制其表达时在肥大化阶段的第21天后,ColII表达明显上升而ColX表达明显降低,提示抑制miR-29表达后会阻碍软骨细胞肥大化,这一结果与此次研究的结果相一致。
该次研究表明,在干细胞成骨分化的过程中,miR-29b的表达上调可能对组蛋白去乙酰化酶4(histone deacetylase,HDAC4)进行调节,从而影响BMSCs成软骨细胞分化的过程。而软骨肥大化过程与转录因子 Sox9和Runx2密切相关。HDAC4通过和Runx2结合,抑制 Runx2和DNA的结合,进一步影响Sox9-Runx2平衡,从而调节软骨肥大化进程。有研究[8]发现,细胞内miR-29b表达上调可以促进软骨细胞的肥大化进程,通过抑制miR-29b的表达,可推迟软骨细胞的肥大化进程。所以,该实验中,通过miR-29b inhibitor的抑制作用,抑制BMSCs中的miR-29b的表达,可能通miR-29b/HDAC4/Sox9-Runx2信号通路,在调控BMSCs成骨诱导的同时,也推迟BMSCs诱导的软骨细胞肥大化进程,为组织工程骨软骨修复缺损提供一种新的探索。
4 结论
miR-29b inhibitor基因修饰的骨髓间充质干细胞在诱导剂作用下具有向成骨细胞和成软骨细胞分化的潜能,为组织工程中关节软骨及软骨下骨损伤的修复提供新思路。
