CRM197重组慢病毒对前列腺癌PC-3细胞作用的初步研究*
2019-06-24唐艺媛代吕霞
刘 双,李 艳,唐艺媛,曹 康,代吕霞△
1.成都医学院 临床医学院(成都 610500);2.成都医学院 病原生物学教研室(成都 610500)
CRM197是白喉毒素突变体中的一种。由于错义突变,CRM197细胞毒性明显降低,但仍能抑制细胞蛋白质的合成,导致靶细胞死亡[1-4]。近年来有多项研究[1-2]表明,CRM197具有抗肿瘤作用。目前,CRM197蛋白治疗卵巢癌和腹膜癌的研究已进入Ⅰ期临床试验阶段[5]。复发性卵巢癌和腹膜癌患者腹壁皮下注射CRM197蛋白进行治疗,结果显示,CRM197治疗效果良好,其疗效与剂量存在正相关[6-7]。细胞凋亡是抗肿瘤药物发挥抗肿瘤作用的重要机制之一,Caspase-9是分子量为46 KD细胞凋亡启动因子,在凋亡信号传导过程中先于其他蛋白酶被活化,继而引起Caspase-3的活化。Caspase-3是分子量约为32 KD的细胞凋亡执行因子,是细胞凋亡过程中最主要的终末剪切酶。本研究通过观察CRM197重组慢病毒对PC-3细胞生物学特性的影响,初步探讨CRM197重组慢病毒抗前列腺癌的作用机制,为前列腺癌的治疗提出新的构思与想法。
1 材料与方法
1.1 材料
PC-3细胞由成都医学院科研中心保存,新生牛血清购自浙江天杭生物科技有限公司,DMEM培养基购自HyClone,BCA蛋白定量试剂盒、Caspase-3、Caspase-9、GAPDH购自碧云天生物技术有限公司,PCDH-CRM197-copGFP重组慢病毒、CRM197多克隆抗体已由本课题组制备完成。
1.2 方法
1.2.1 细胞复苏 取出冻存的PC-3细胞,37 ℃融化后,转移至15 mL离心管中。加入10%血清的DMEM培养液5 mL,1 000 r/min,离心半径14 cm,离心5 min,小心弃上清。重新加入10%血清的DMEM培养液5 mL,轻轻吹打混匀后转移至75 mL 细胞培养瓶中,置于37 ℃、5%CO2培养箱培养。
1.2.2 实验分组 空白对照组(Con组):PC-3细胞,加入10%血清的DMEM培养液;空病毒组(EV组):PC-3细胞,加入空载体病毒液(MOI=2),感染24 h后,更换为10%血清的DMEM培养液;CRM197组(CRM197组):PC-3细胞,加入CRM197病毒液(MOI=2),感染24 h后,更换为10%血清的DMEM培养液。
1.2.3 MTT实验 当PC-3细胞生长状态良好,达80%~90%融合时,0.25%胰酶进行消化。显微镜下观察细胞收缩、变圆后,加入等量10%血清的DMEM培养液终止消化。轻柔吹打,1 000 r/min,离心半径14 cm,离心5 min,弃上清。加入10%血清的DMEM培养液5 mL,轻柔吹打重悬细胞沉淀。按5×103/孔的密度接种于96孔板,每组设3个复孔,37 ℃、5%CO2培养箱培养24 h,至细胞达30%~40%融合,进行相应组别处理,37 ℃、5%CO2培养箱中继续培养72 h。每孔加入5 μL MTT,37 ℃、5%CO2培养箱4 h。小心吸出培养液,每孔加入150 μL 二甲亚砜(DMSO),轻柔振摇10 min,酶标仪上测OD490。用不含细胞的空白孔调零,将Con组细胞存活率记为100%,分析EV组、CRM197组细胞存活率变化。实验重复3次,取均值。
1.2.4 Hoechst染色 当PC-3细胞生长状态良好,达60%~80%融合时,0.25%胰酶消化细胞。计数后按5×105/孔的密度接种6孔板,37 ℃、5%CO2培养箱中培养。当细胞密度达40%~50%,分别进行Con组、EV组和CRM197组的相应处理(每组设3个复孔,重复3次)。细胞分组处理72 h后,吸去各孔培养液。加入500 μL Hoechst 33258染色液,37 ℃、5%CO2培养箱中放置15 min。荧光显微镜下观察细胞核形态。
1.2.5 流式细胞术检测 细胞分组处理72 h后,0.25%胰酶消化细胞,收集细胞1 000 r/min,离心半径14 cm,离心5 min,弃上清。加入预冷的PBS重悬细胞,1 000 r/min,离心半径14 cm,离心5 min,弃上清。加入1 mL预冷的75%乙醇,涡旋振荡重悬细胞,4 ℃放置24 h,3 000 r/min,离心半径14 cm,离心5 min,弃上清。加入预冷的PBS重悬细胞,3 000 r/min,离心半径14 cm,离心5 min,弃上清。加入预冷的PBS重悬细胞,3 000 r/min,离心半径14 cm,离心5 min,弃上清。加入PI染液500 μL(含PI 20 μg/mL),重悬细胞,室温避光2 h。调整细胞浓度为1×106/mL,上机检测。实验重复3次。
1.2.6 Western blot检测Caspase-3、Caspase-9蛋白的表达 PC-3细胞分组处理72 h后,0.25%胰酶消化细胞,1 000 r/min,离心半径14 cm,离心5 min,弃上清,收集各组细胞。加入200 μL RIPA和4 μL PMSF混匀,冰上30 min。设置功率40 W、破碎2 s、间隔3 s、总时间20 s的工作模式,冰上超声破碎细胞。4 ℃,13 000 r/min,离心半径14 cm,离心20 min,收集上清,定量蛋白。Western blot检测Caspase-9、Caspase-3蛋白的表达,凝胶图像分析系统Quantity One 4.5分析,保存实验结果。实验重复3次。
1.3 统计学方法

2 结果
2.1 CRM197蛋白在前列腺癌PC-3细胞中的表达
以抗CRM197多克隆抗体为一抗,Western blot验证CRM197慢病毒作用PC-3细胞后能否正确表达CRM197蛋白。Western blot结果显示,CRM197组PC-3细胞出现特异性条带,而Con组、EV组细胞无特异性条带的出现,这提示CRM197慢病毒作用前列腺癌PC-3细胞后能正确表达CRM197蛋白(图1)。
2.2 CRM197慢病毒对细胞增殖的影响
将PC-3细胞接种于96孔板并分组处理细胞,MTT检测并计算细胞增殖的抑制率。MTT结果显示,CRM197组PC-3细胞的增殖抑制率为34.3%。与Con组和EV组相比,CRM197慢病毒明显抑制PC-3细胞的增殖,差异有统计学意义(P<0.05)。而EV组和Con组相比,差异无统计学意义(P>0.05)(图2、表1)。

图2 CRM197慢病毒对PC-3细胞存活率的影响注:A:PC-3 细胞;B:空载体慢病毒作用后的PC-3细胞;C:CRM197慢病毒作用后的PC-3细胞

表1 CRM197慢病毒对PC-3细胞存活率的影响
注:与Con组相比,*P<0.05;与EV组相比,#P<0.05
2.3 CRM197处理细胞导致的凋亡形态学分析
将PC-3细胞接种6孔板,分组处理细胞后,倒置显微镜下观察细胞形态。显微镜下观察到,CRM197慢病毒作用72 h后,细胞变圆、皱缩、空泡、脱落、生长缓慢;而Con组细胞生长状态良好,细胞增殖迅速(图3)。
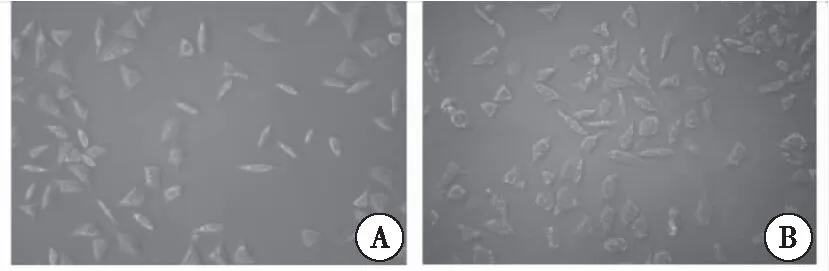
图3 PC-3肿瘤细胞的形态变化注:A:PC-3 细胞;B:CRM197慢病毒作用后的PC-3细胞
2.4 CRM197处理细胞导致的细胞核形态改变
将PC-3细胞接种6孔板,分组处理细胞72 h后行Hoechst 33258染色,荧光显微镜下观察细胞核形态。荧光显微镜下观察到,CRM197组凋亡细胞比例明显增加,细胞核出现核固缩、碎块状致密浓染或凋亡小体,而Con组和EV组凋亡细胞较少且细胞核没有明显变化。提示CRM197明显促进细胞凋亡的进程(图4)。

图4 CRM197慢病毒对PC-3细胞核形态的影响 注:A、D:PC-3 细胞;B、E:空载体慢病毒作用后的PC-3细胞;C、F:CRM197慢病毒作用后的PC-3细胞
2.5 CRM197慢病毒对Cleaved Caspase-9、Cleaved Caspase-3蛋白表达的影响
Western blot检测Con组、EV组和CRM197组Cleaved Caspase-9、Cleaved Caspase-3凋亡相关蛋白的表达情况,比较各蛋白与β-actin的相对表达量。结果显示,与Con组和EV组相比,CRM197组Cleaved Caspase-9、Cleaved Caspase-3的表达量都增加,差异有统计学意义(P<0.05)。而EV组与Con组相比,Cleaved Caspase-9、Cleaved Caspase-3的表达量差异无统计学意义(P>0.05)。提示CRM197启动线粒体凋亡途径,从而诱导细胞凋亡(表2、图5)。


组别Cleaved Caspase-9Cleaved Caspase-3Con组0.05±0.020.07±0.03EV组0.06±0.010.08±0.02CRM197组 0.17±0.03∗# 0.28±0.04∗#F28.50043.552P<0.001<0.001
注:与Con组比较,*P<0.05;与EV组比较,#P<0.05
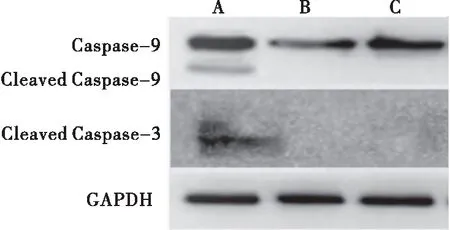
图5 CRM197慢病毒对Cleaved Caspase-9和Cleaved Caspase-3蛋白表达的影响注:A:CRM197慢病毒作用后的PC-3细胞;B:PC-3 细胞;C:空载体慢病毒作用后的PC-3细胞
2.6 CRM197处理细胞导致的细胞凋亡率改变
将PC-3细胞接种6孔板分组处理细胞72 h后,通过PI染色检测sub G1期细胞所占比例,定量凋亡的细胞数目。结果显示,CRM197作用后PC-3细胞的凋亡率为13.7%,与Con组和EV组相比,CRM197明显促进细胞凋亡,差异有统计学意义(P<0.05)。EV组与Con组相比,差异无统计学意义(P>0.05)。结果提示,AdCRM197能够诱导PC-3前列腺癌细胞发生凋亡(图6、表3)。

图6 CRM197慢病毒对PC-3细胞凋亡率的影响注:A:PC-3 细胞;B:空载体慢病毒作用后的PC-3细胞;C:CRM197慢病毒作用后的PC-3细胞

表3 CRM197慢病毒对PC-3细胞凋亡率的影响
注:与Con组比较,*P<0.05;与EV组比较,#P<0.05
3 讨论
前列腺癌是欧美国家男性高发恶性肿瘤,目前在我国也呈现出逐年增长的趋势[8]。由于我国群众重视程度不高,常导致发现时已经处于前列腺癌晚期[6]。我国目前在前列腺癌治疗方面多采用传统的化疗方法,但由于耐药频发,患者治疗效果不佳,死亡率高[9-11]。面对重重障碍,寻找到一种新的治疗方法迫在眉睫。
既往实验[12-14]证实,CRM197蛋白干扰EGFR与HB-EGF结合,下调HB-EGF的表达,抑制细胞有丝分裂。CRM197蛋白还被用于治疗口腔癌、黑色素瘤、急性T淋巴细胞性白血病等[15-17],CRM197通过抑制细胞蛋白质的生成,抑制肿瘤细胞的迁移、侵袭以及诱导肿瘤细胞凋亡,从而实现抗肿瘤作用。
CRM197重组慢病毒作用PC-3细胞后,Western blot检测到CRM197的表达,这提示CRM197重组慢病毒在靶细胞中能正确表达CRM197蛋白。CRM197作用PC-3细胞后,细胞增殖的抑制率为34.3%。与Con组、EV组相比,CRM197明显抑制PC-3细胞的增殖。Hoechst染色观察到细胞核出现核固缩及凋亡小体。流式细胞检测术显示,CRM197作用后PC-3细胞的凋亡率为13.7%,与Con组和EV组相比,CRM197使sub G1期细胞增多,凋亡率升高。
Caspase-3、Caspase-9蛋白可促进细胞凋亡。Caspase-3通过裂解核小体间的DNA,引起细胞凋亡,且Caspase-3是各凋亡通路枢纽最重要的凋亡效应分子,Caspase-9作为Caspase-3最重要的激活剂,是调节细胞凋亡的关键分子[18]。为了探索CRM197诱导肿瘤细胞凋亡的机制,本研究对Caspase-3、Caspase-9凋亡相关蛋白的表达进行了检测。Western blot显示CRM197作用后,PC-3细胞中Cleaved Caspase-9和Cleaved Caspase-3表达呈上调状态。结果提示,CRM197通过激活线粒体凋亡途径而诱导肿瘤细胞凋亡。本研究显示,CRM197重组慢病毒可通过抑制PC-3前列腺癌细胞的增殖,诱导PC-3细胞凋亡,增加Caspase-3和Caspase-9的表达,从而抑制前列腺癌的生长和增强化疗药物的敏感性。
