二甲双胍对小鼠肝纤维化保护作用的研究*
2019-06-24郭莉娜谭悦浩孔德华胡康安邓峰美王航宇刘漪沦
郭莉娜,李 灿,谭悦浩,孔德华,胡康安,邓峰美△,王航宇,马 燕,刘漪沦
1.成都医学院 基础医学院(成都610500);2.新疆石河子大学 药学院(石河子832000);3.成都医学院第一附属医院(成都610500)
肝纤维化是全球常见疾病,主要由病毒性、酒精性、药物性、代谢性、胆汁淤积性等慢性肝脏损伤引起。当这些损伤反复持续存在时,机体发生修复反应,形成了肝脏纤维化。细胞外基质(extracellular matrix,ECM)过度沉积是肝纤维化最具特征性的改变,其合成与降解水平失衡是肝纤维化发生的主要原因,这一过程可在一定程度上发生可逆性改变[1-2]。肝纤维化特点是胶原蛋白过度积累和肝星状细胞(hepatic stellate cells,HSCs)异常激活。当HSC发生激活、增殖和趋化反应后,引起多种促纤维化细胞因子分泌,从而促进胶原合成增加[3]。肝纤维化可发展为肝硬化,甚至肝癌,所以需积极探索其逆转方法。目前,主要治疗肝纤维化的方法是药物治疗,通过减少肝脏持续损伤,逆转肝纤维化。积极探索新药应用于肝纤维化疾病,可以明显减少肝硬化、肝癌发生。
二甲双胍作为双胍类口服降糖药,是治疗2型糖尿病的首选药物,已在临床应用多年[4]。研究[5-6]证明,二甲双胍除降糖作用外,还有抗癌、抗炎、抗衰老等作用。二甲双胍在多囊卵巢综合征临床治疗中已得到认可[7]。在动物实验[8-10]中也证明,该药物对子宫内膜癌、结直肠癌、肝癌等有一定改善作用。近期文献[11]显示,二甲双胍可以治疗小鼠肝纤维化,具体机制需进一步验证。本实验利用CCl4建立小鼠肝纤维化模型,通过二甲双胍进行干预,初步研究二甲双胍对肝纤维化的保护作用及其潜在机制。
1 材料与方法
1.1 实验材料
1.1.1 动物 雄性C57BL/6J小鼠、SPF级别、4周龄、体重20~25 g。购自成都达硕公司,实验动物生产许可证:SCXK(川)2013-024。实验前动物适应环境1周,饲养条件:温度20~25 ℃,相对湿度35%~40%,自由进食饮水。
1.1.2 细胞 LX-2细胞购自复旦IBS细胞中心,于CO2培养箱内培养。生长环境为:温度37 ℃,CO2浓度5%;给予10%胎牛血清+双抗+DMEM-H培养基,隔天换液,3~5 d传代,于超净工作台进行细胞复苏、换液等操作。
1.1.3 试验药物与试剂 二甲双胍(北京索莱宝生物科技有限公司);CCL4分析纯AR(500 mL/瓶)(购自成都科龙化工试剂厂);ALT、AST试剂盒(购自南京建成试剂公司);HE染色试剂(博谷生物);天狼星红染色试剂盒(博谷生物);兔抗α-SMA抗体(中杉金桥),山羊抗兔IgG(中杉金桥);DMEM-H培养基购自美国Gibco公司;胎牛血清购自美国Gibco公司;双抗购于 R&D公司;PDGF-BB购自美国PeproTech公司;基质胶(Matrigel)购自湖南佳浩能生物科技公司;24孔Transwell小室购自海狸生物科技有限公司等。
1.1.4 实验仪器 组织切片机(RM2016)、组织包埋机(EG1150H)购自LEICA;生物显微镜(CX21FS1C)购自奥林巴斯工业有限公司;Roche Modular D2400生化分析仪购自瑞士Roche公司;倒置相差显微镜购自日本Olympus公司;CO2培养箱购于Thermo公司;超净工作台购于Thermo公司等。
1.2 方法
1.2.1 动物分组与给药方法 将45只4周龄的小鼠随机分为3组,每组各15只,即正常组、模型组和二甲双胍治疗组;模型组给予橄榄油、CCL4混合物处理,按1∶3比例,经腹腔注射,2 次/周,剂量为0.4 mL/kg;正常组给予相同容量橄榄油,经腹腔注射,2 次/周,剂量为0.4 mL/kg;二甲双胍治疗组造模方法同模型组。造模3周后,给予各组小鼠相对应药物,二甲双胍治疗组给予二甲双胍200 mg/次,1次/d,灌胃;正常组、造模组给予生理盐水,200 mg/次,1 次/d,灌胃,造模6周后处死小鼠,收集标本。
1.2.2 细胞分组与给药方法 将对数生长期的LX-2细胞,用0.25%的胰蛋白酶消化制成细胞悬液,接种于12个培养皿中,平均分为4组,即空白对照组、PDGF-BB组、PDGF-BB+Met低剂量组和PDGF-BB+Met高剂量组。空白对照组不做处理;PDGF-BB组给予10 ng/mL的细胞因子PDGF-BB诱导细胞活化;PDGF-BB+Met低剂量组给予10 ng/mL的细胞因子PDGF-BB和5 mmol/L的二甲双胍;PDGF-BB+Met高剂量组给予10 ng/mL的细胞因子PDGF-BB和10 mmol/L的二甲双胍。于48 h后,观察细胞状态,收集各组细胞蛋白。
1.2.3 实验指标测定 检测血清中AST、ALT的含量,实验步骤根据试剂盒说明操作。
1.2.4 组织病理学检测 取出的小鼠肝脏经甲醛固定、石蜡包埋、切片后,行天狼星红染色,将烤片机温度调至65 ℃,在烤片机中将片子复烤约 40 min,二甲苯脱蜡,酒精水化,片子在自来水下轻冲3 min×3 次,标本处滴加天狼星红染色液时间约60 min,自来水冲洗,用 Mayer 苏木素复染细胞核时间约1 min,自来水冲洗7~8 min,进行乙醇脱水处理,将片子放入二甲苯Ⅰ和二甲苯Ⅱ透明各 15 min,中性树脂封片,生物显微镜观察拍照。HE染色,烤片、脱蜡、水化步骤同上,染色时先用苏木精染色约3 min,自来水轻轻冲洗4 min,1%盐酸酒精分化15 s,再次用自来水轻冲约1.5 min,氨水反蓝染色1 min,自来水轻轻冲洗约5 min,再用1%伊红染色3 min,再次自来水洗4 min,片子脱水、透明同天狼星红染色,生物显微镜镜检,并拍摄照片。
1.2.5 免疫组织化学染色分析 取5 μm切片,行烤片、脱蜡、水化操作。用EDTA抗原修复液修复抗原。在组织上滴加3%H2O2阻断过氧化物酶活性,使其完全覆盖组织,在37 ℃恒温培养箱孵育0.5 h。滴加已配好的α-SMA抗体(即一抗),将切片放入湿盒,4 ℃冰箱过夜。次日,取出切片,放入1×PBS中浸泡,3 min/次×3次。切片组织上加山羊抗兔二抗,室温下放置约30 min,1×PBS中浸泡,3 min/次×3次,在组织上滴上二氨基联苯胺显色,苏木素复染3 min,脱水、透明、封片,于显微镜下观察显色情况,选取不同视野拍照。
1.2.6 细胞克隆形成实验 将对数生长期的细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,计数后稀释,将细胞悬液平均种于六孔板中。将六孔板放入CO2培养箱待细胞贴壁,次日将细胞培养基更换为无血清的DMEM约10 h,再次给细胞换液,根据分组给予每孔不同的处理方式,正常组加10%胎牛血清的DMEM培养基,其他组在此基础分别多加入PDGF-BB、PDGF-BB+5 mg/mL Met、PDGF-BB+10 mg/mL Met,每个孔设置3个复孔,当六孔板中出现肉眼可见的克隆时,终止培养,弃上清液,用PBS小心浸洗2次。加4%多聚甲醛固定细胞,时间约15 min,弃固定液,加适量GIMSA应用染色液,时间约20 min,水流轻冲染色液,空气干燥,将六孔板倒置,叠加网格透明胶片,用肉眼直接计数克隆。
1.2.7 Western blot检测 将已处理好的细胞用PBS缓慢冲洗3次后刮下,收集细胞加入离心管中,置于离心机中离心,3 000 r/min,离心半径8 cm,离心5 min,弃上清,得细胞沉淀,加入裂解液,使细胞与裂解液充分混合后,移入EP管,将EP管置于冰面上40 min,每10 min旋转混匀1次,促进细胞裂解,再次离心,条件:4 ℃,12 000 r/min,离心半径13.5 cm,离心20 min,离心所得上清液即为所需蛋白。使用5×蛋白上样缓冲液混匀蛋白上清后,于95 ℃中加热10 min,待其充分变性。上机跑电泳,随后转膜并置于5%脱脂牛奶中封闭1 h,TBST冲洗,用5%脱脂牛奶稀释α-SMA抗体,将膜浸于其中,封口机封闭,将膜浸于其中,置于4 ℃冰箱过夜;将PVDF膜取出,TBST溶液洗涤,时间10 min,重复3次;稀释山羊抗兔抗体,封口机封闭,置于37 ℃恒温摇床上孵育 2 h,将PVDF膜取出,丢弃二抗,TBST溶液洗涤,时间10 min,重复3次。配置显色液A液和B液,按比例1∶1(体积/体积),混匀。将显色液均匀滴加与PVDF膜上,置于化学发光显影仪中进行显影。
1.3 统计学处理
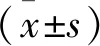
2 结果
2.1 肝脏功能的变化
模型组小鼠的肝脏功能相关指标AST、ALT含量较正常组明显升高,差异有统计学意义(P<0.01);与模型组相比,二甲双胍治疗组小鼠AST、ALT含量明显降低,差异有统计学意义(P<0.01)(图1)。
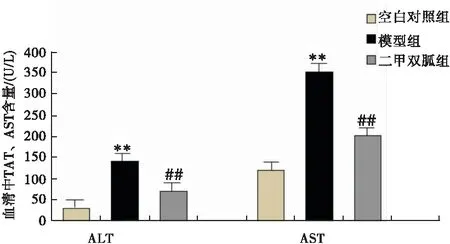
图1 血清中肝功能相关指标ALT、AST含量注:与正常组比较,**P<0.01;与模型组比较,##P<0.01
2.2 肝脏组织病理学的变化
2.2.1 HE染色 正常小鼠肝脏内肝小叶正常,肝细胞索整齐排列,间质内无炎性细胞浸润;与正常组比较,模型组小鼠汇管区内出现粗大的胶原纤维条索分割包绕,纤维间隔明显增厚,肝小叶结构明显异常,有假小叶形成,肝细胞索排列紊乱,间质内炎性细胞浸润明显;与模型组相比,二甲双胍治疗组胶原纤维的增生减轻,假小叶形成改善,炎性细胞浸润程度减轻(图2)。
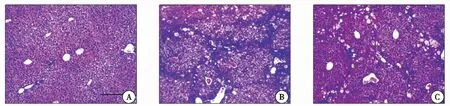
图2 肝脏HE染色(×100)注:A:正常组;B:CCL4+PBS组;C:CCL4+二甲双胍组
2.2.2 天狼星红染色 正常组中可见少量胶原分布;与正常组比较,模型组中出现大量胶原沉积,分布广泛,在汇管区间分布较多与模型组比较,二甲双胍治疗组有部分胶原增生,肝小叶中可见少量间隔形成(图3)。
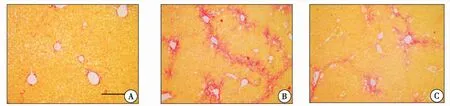
图3 肝脏天狼星红染色(×100)注:A:正常组;B:CCL4+PBS组;C:CCL4+二甲双胍组
2.2.3 免疫组化检测小鼠肝脏组织α-SMA表达 正常组小鼠肝脏基本无α-SMA表达;与正常组比较,模型组α-SMA表达明显增高;与模型组比较,二甲双胍治疗组α-SMA表达降低(图4)。

图4 肝脏α-SMA免疫组化的染色结果(×100)注:A:正常组;B:CCL4+PBS组;C:CCL4+二甲双胍组
2.2.4 细胞克隆形成实验观察细胞增殖能力 与空白对照组比较,PDGF-BB组细胞增殖能力明显升高;与PDGF-BB组比较,PDGF-BB+Met低剂量组细胞增殖能力下降;与PDGF-BB+Met低剂量组比较,PDGF-BB+Met高剂量组细胞增殖能力进一步下降,呈剂量依赖性(图5)。

图5 LX-2细胞克隆形成
2.2.5 二甲双胍能抑制肝星状细胞活化 Western blot检验结果示:与空白对照组比较,PDGF-BB组α-SMA表达明显升高(P<0.01);与PDGF-BB组比较,PDGF-BB+Met低剂量组α-SMA表达明显降低(P<0.01);与PDGF-BB+Met低剂量组比较,PDGF-BB+Met高剂量组α-SMA表达进一步降低(P<0.01)(图6)。
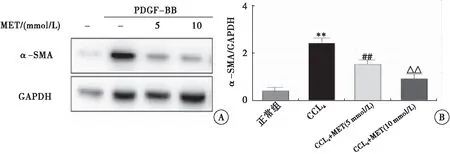
图6 Western blot检测二甲双胍干预后LX-2细胞内α-SMA的表达注:A:Western blot检测各组细胞α-SMA的表达;B:各组细胞α-SMA蛋白表达水平统计结果;与正常组比较,**P<0.01;与模型组比较,##P<0.01;与PDGF-BB+Met低剂量组比较,△△P<0.01
3 讨论
肝纤维化是各种致病因子作用、ECM积累和损伤修复长期持续存在导致的病理过程[12]。肝纤维化损伤修复破坏肝脏正常结构,肝小叶结构出现异常改变,血管结构发生紊乱,同时肝细胞数量减少。各致病因素作用于肝细胞,使其分泌多种细胞生长因子、纤维化相关细胞因子、炎性因子等,从而刺激HSCs活化。HSCs一直被认为是肝纤维化发生发展环节中的最关键因素,其在静息期可调节肝内脂质平衡[13]。HSCs活化后,细胞内脂类丢失,增殖、迁移能力增强,可分泌大量 ECM能力。α-SMA表达量也明显增加,其含量且与细胞活化程度呈正相关。同时,HSCs与周围细胞相互作用,分泌大量细胞因子、趋化因子而促进肝纤维化发生[14]。因此,抑制HSCs活化可有效改善肝纤维化的发生。
肝纤维化最终向肝硬化、肝癌发展。肝癌是一种快速生长的恶性肿瘤,有60%~80%的患者诊断时即为肝癌晚期,且根治性切除机会极少,从而丧失了治疗机会,对人类是一种严重而危险的威胁[15],肝纤维化可在一定程度上逆转,所以可通过预防或治疗肝纤维化而有效减少肝癌发生。因此,要积极探索肝纤维化治疗新药,迫切需要发现更有效的治疗靶点,以改善治疗效果。
二甲双胍为胰岛素增敏剂,抑制糖异生及肝糖原的分解,是非常有效的降糖药物,现为2型糖尿病治疗首选药物[16]。近年通过流行病学调查研究[17-18]发现,二甲双胍具有保护心血管、抑制肿瘤、治疗非酒精性脂肪肝等作用。二甲双胍可激活蛋白激酶(AMPK),缓解心脏缺血后的炎性反应,保护心脏功能;AMPK活化还能够抑制多种器官纤维化发生,其中对肝纤维化有明显影响[19-20]。本实验从病理学角度研究二甲双胍对CCL4诱导的小鼠肝纤维化的影响,结果显示,二甲双胍可改善肝脏内炎性细胞浸润,减轻胶原纤维的形成,纤维化病变程度明显减轻。同时,二甲双胍可抑制HSCs活化与增殖。
综上所述,二甲双胍可通过抑制HSCs活化而在一定程度上改善肝纤维化发展,其具体机制需进一步研究发现。
