17-β雌二醇对人舌鳞癌细胞侵袭能力的影响及其机制探讨
2019-06-22陈英钟雅静曾钦罗丽
陈英 钟雅静 曾钦 罗丽
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)为常见的恶性肿瘤之一,多呈侵袭性生长,TSCC患者治疗后肿瘤极易复发转移[1-2]。遏制TSCC转移是临床治疗OSCC亟待解决的问题。17β-雌二醇(17β-estradiol,E2)是人体尤其是女性体内重要的性激素,主要通过雌激素受体(estrogen receptor,ER)发挥其生物学效应[3-4]。E2还可以调节雌激素相关受体(estrogen-related receptor alpha,ERRα)表达从而调控肿瘤细胞的恶性生物学行为[5]。ERRα是孤儿核受体家族的成员,其在恶性肿瘤迁移和侵袭中发挥一定作用[6-7]。但ERRα下游信号机制还有待于进一步研究。本研究以人舌鳞癌TCA8113细胞为研究模型,E2刺激模型细胞,观察细胞侵袭能力的变化,探讨ERRα及其下游信号在其中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞系 人口腔鳞癌Tca8113细胞(中国科学院上海细胞库)。
1.1.2 试剂 RPMI 1640培养基、胎牛血清(FBS)、 磷酸盐缓冲液(PBS)(Gibco公司, 美国); 总蛋白提取试剂盒和细胞裂解液(上海碧云天公司);FN siRNA转染试剂盒(上海吉玛公司); 抗FN抗体(sc-69681,Santa Cruz公司, 美国);抗GAPDH抗体(AP0063,内参)、羊抗小鼠IgG-HRP(BS13278)(南京巴傲得公司); 聚偏二氟乙烯膜(PVDF)(Millipore公司, 美国)。
1.1.3 仪器 移液器(Gilson公司, 法国); CKX41倒置显微镜(Olympus公司, 日本); Allegra 64R Centrifuge台式高速冷冻离心机(Beckman Coulter公司, 美国); SW-CJ-2FD超净工作台(苏州净化设备有限公司); DYY-7C电泳仪(GE公司, 美国)。
1.2 方法
1.2.1 细胞培养 以含12% FBS及1%青链霉素的RPMI 1640高糖培养基于37 ℃、 5% CO2的培养箱中培养细胞,生长至70%汇合度进行传代。
1.2.2 侵袭小室实验 实验前拿出Matrigel胶放于冰上融化,用RPMI 1640培养基稀释Matrigel胶至浓度为250 μg/ml。准备好transwell侵袭小室(规格:24 孔; 孔径: 8 μm),吸取稀释好的培养基基质胶混合物100 μl于小室中,避免打入气泡。将培养板放置到培养箱静置3 h。 将同步化24 h的Tca8113细胞或FN siRNA处理过的Tca8113细胞消化制成细胞悬液并调整细胞密度至1×106个/ml, 吸取混合均匀的细胞悬液200 μl轻轻加入Transwell小室。在小室外的24 孔板下室中加入800 μl含趋化因子及高浓度FBS的RPMI 1640培养基,放置于培养箱培养24 h。 24 h后倒掉侵袭小室中的培养基并用PBS洗2 遍,甲醇固定20 min, PBS洗2 遍,放入到0.5%结晶紫水溶液中染色20 min,PBS洗2 遍,用棉签轻轻擦掉小室内房细胞,放置5~10 min风干。倒置显微镜下观察并取6 个视野拍照并计数,计算侵袭率。
1.2.3 蛋白印迹检测蛋白表达 用总蛋白提取试剂RIPA细胞裂解液(使用前20 min加蛋白酶抑制剂,使其终浓度为1 mmol/L)裂解细胞, 12 000 r/min离心20 min,吸取上清,采用BCA试剂盒蛋白定量,计算并制备样品。进行蛋白印记检测,每泳道上样量为30 μg, SDS-PAGE电泳分离蛋白,然后将分离蛋白电转移至PVDF膜上;配制5%脱脂牛奶封闭PVDF膜2 h,TBST缓冲液洗膜3 次,每次15 min;然后按要求加入FN抗体(1∶ 1 000)4 ℃孵育过夜。一抗处理后,TBST洗膜3 次,再加入相应的辣根过氧化物酶标记二抗(1∶2 000),室温杂交1 h,PVDF膜以化学发光试剂盒进行显色,凝胶成像仪进行成像,以imageJ对蛋白印迹条带进行处理和分析。
1.2.4 FN siRNA转染沉默FN蛋白表达 转染前24 h用1 ml 高糖 1640全培养基将模型细胞接种在6 孔板上,每孔4×105个细胞,细胞汇合度达到70%~90%时,更换培养基。siRNA的转染浓度为60 pmol/ml,提前准备配制siRNA-lipo2000混和液,预先将lipo2000试剂轻轻摇匀,按需取出适量,用高糖1640培养基稀释并轻轻混和,常温放置5 min;高糖1640培养基稀释siRNA,轻轻混和;将稀释好的lipo2000与稀释好的siRNA混和并轻轻混匀,常温放置20 min以形成siRNA-lipo2000混和物。将相应siRNA-lipo2000混和液加入含有细胞以及培养液的6 孔板中,十字摇晃混和。置于37 ℃的CO2培养箱中24 h后进行后续实验。
1.3 统计学方法
2 结 果
2.1 E2增强TCA8113细胞侵袭能力
以1‰体积的DMSO处理TCA8113细胞并作为对照, 1‰体积的E2(100 nmol/L)处理TCA8113细胞24 h, 两处理组侵袭细胞数分别为(51.5±4.1) 个和(73.7±4.7) 个(P<0.01)(图 1)。
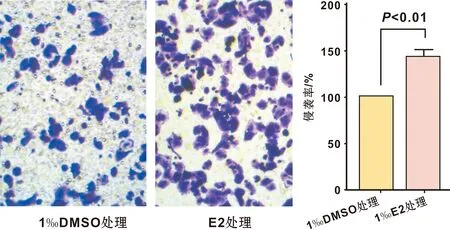
图 1 E2对TCA8113细胞侵袭能力的影响
(×100)
Fig 1 The effect of E2 on the invasion of TCA8113 cells
(×100)
2.2 E2增强TCA8113细胞FN蛋白表达水平
以1‰体积的DMSO处理TCA8113细胞并作为对照, 1‰体积的E2处理TCA8113细胞24 h能显著上调FN蛋白表达水平(48.2±7.8)%(P<0.01)(图 2)。
2.3 ERRα特异性抑制剂XCT-790逆转E2对TCA8113细胞FN表达的影响
分别以1‰ DMSO和1‰ ERRα特异性抑制剂XCT-790(1 μmol/ml)预处理TCA8113细胞,然后以E2刺激细胞24 h, 结果显示XCT-790预处理可显著抑制E2诱导的FN表达上调,与DMSO预处理相比,XCT-790预处理后TCA8113细胞FN表达下调(53.3±7.2)%(P<0.01)(图 3)。
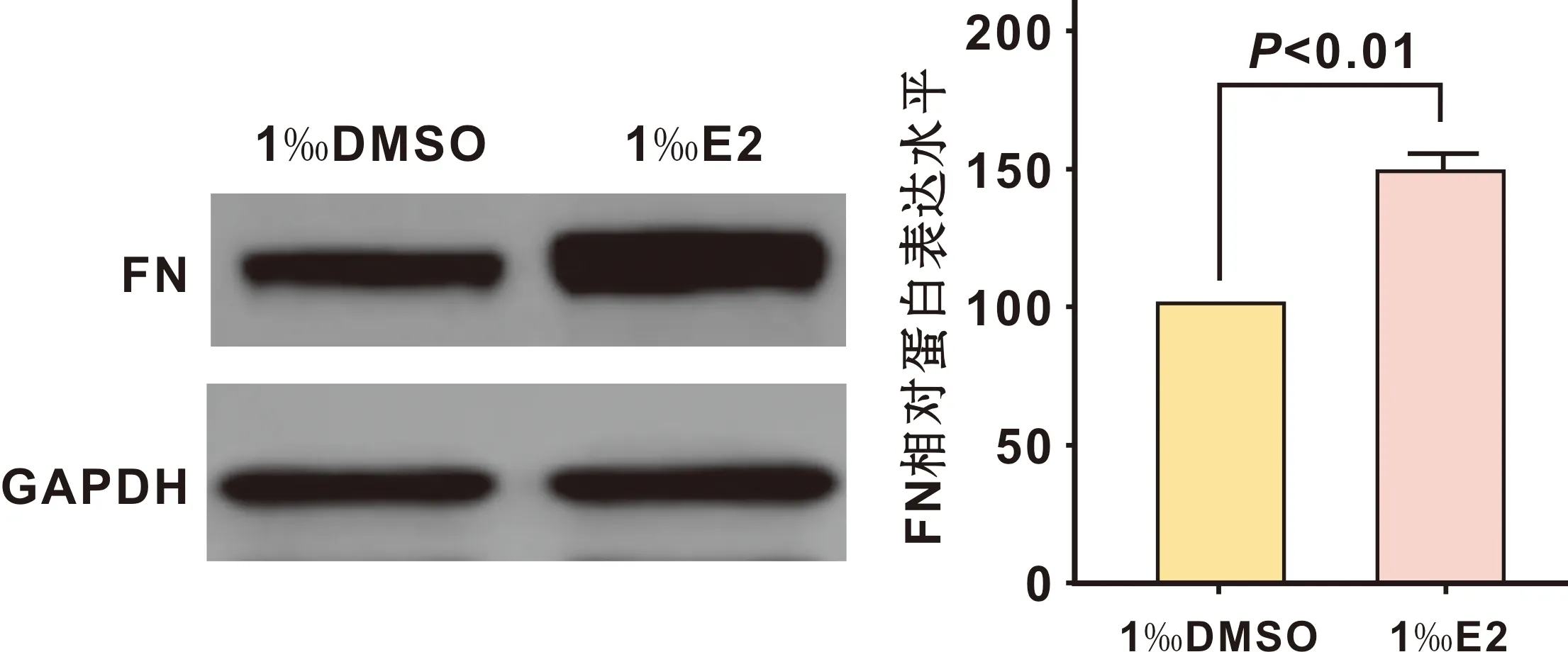
图 2 E2对TCA8113细胞FN蛋白表达的影响

图 3 XCT-790对E2诱导的FN表达上调的影响
2.4 siRNA转染高效沉默FN蛋白表达
转染对照组与未转染模型细胞FN表达无明显差异, FN siRNA转染细胞FN蛋白表达明显降低(91.3±3.6)%(P<0.01)(图 4)。
2.5 FN siRNA转染抑制E2对FN表达的诱导
siRNA转染沉默FN蛋白表达后,E2处理siRNA转染对照细胞和siRNA转染沉默FN细胞24 h,结果显示,与siRNA转染对照细胞相比,siRNA转染沉默FN细胞蛋白表达明显下调(88.9±6.7)%(P<0.01)。 提示, siRNA转染沉默FN蛋白表达可明显抑制E2对FN表达的诱导(图 5)。
2.6 XCT-790预处理或siRNA干扰TCA8113细胞FN蛋白表达均抑制E2诱导的侵袭活动
分别以E2 刺激DMSO预处理的未转染模型细胞、siRNA转染对照细胞、XCT-790预处理的未转染模型细胞及siRNA转染沉默FN细胞,各组细胞侵袭数分别为(102.6±9.3) 个、 (96.8±8.7) 个、 (51.1±5.6) 个、 (40.5±4.2) 个。 与DMSO预处理的未转染模型细胞相比,XCT-790预处理的未转染模型细胞侵袭率明显降低(50.2±4.4)%(P<0.01);与siRNA转染对照细胞相比,siRNA转染沉默FN细胞侵袭率显著降低(61.3±5.8)%(P<0.01)(图 6)。

A: 模型细胞; B: FN siRNA对照细胞; C: FN siRNA转染细胞
图 4 siRNA转染沉默FN蛋白表达
(×100)
A: Model cells; B: Control cells for siRNA transfection; C: FN siRNA transfected cells
Fig 4 Silencing of FN protein expression by FN siRNA
(×100)
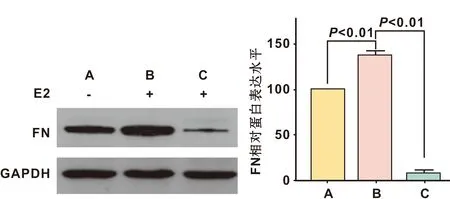
A: 模型细胞; B: FN siRNA对照细胞; C: FN siRNA转染E2预处理的细胞
图 5 siRNA转染抑制E2对FN蛋白表达的诱导
A: Model cells; B: Control cells for siRNA transfection; C: siRNA transfected cells with E2 pretreatment
Fig 5 Inhibition of E2 induced FN protein expresion by FN siRNA
3 讨 论
纤连蛋白(fibronectin,FN)是存在于多种动物细胞表面的大分子细胞外膜蛋白,是细胞外基质和基底膜中的主要非胶原性糖蛋白, 在细胞黏附中起重要作用,可调节细胞极性、分化和生长[8-9]。业已证明FN参与包括舌鳞癌在内的恶性肿瘤细胞的迁移和侵袭活动[8,10-11]。本研究发现E2能增强TCA8113细胞FN蛋白表达和侵袭活动。提示E2增强TCA8113细胞侵袭活动可能与FN表达上调有关。进一步实验,本研究发现siRNA转染沉默FN蛋白表达能抑制E2对TCA8113细胞侵袭能力的影响。这些提示,E2通过上调FN蛋白表达增强TCA8113细胞侵袭活动。研究显示,双酚S能通过ERRα调节FN和基质金属蛋白酶(MMP-2和MMP-9)表达,从而促进嗜铬细胞瘤PC12细胞迁移和侵袭[7]。提示,肿瘤细胞内存在ERRα-FN信号通路。为此,本研究观察了ERRα抑制剂XCT-790预处理对E2诱导效应的影响。结果发现,XCT-790预处理能显著抑制E2诱导的TCA8113细胞侵袭和FN表达上调。提示ERRα参与E2对TCA8113细胞侵袭活动和FN蛋白表达的调控。

A: DMSO预处理的模型细胞; B: siRNA转染对照细胞; C: XCT-790预处理的模型细胞; D: FN siRNA转染细胞
图 6 XCT-790预处理或FN沉默在E2诱导TCA8113细胞侵袭中的作用
(×100)
A: DMSO pretreated model cells; B: Control cells for siRNA transfection; C: XCT-790 pretreated model cells; D: FN siRNA transfected cells
Fig 6 The role of XCT-790 pretreatment or FN silencing in E2-induced invasion of TCA8113 cells
(×100)
综上所述,E2能诱导人舌鳞癌细胞侵袭能力增强,该作用与ERRα-FN信号通路有关。肿瘤细胞转移包括细胞从原发部位脱落、迁移、黏附、侵袭和血管生成等[12-13]。侵袭是肿瘤转移的必要条件之一,本研究发现E2通过ERRα-FN信号通路促进舌鳞癌细胞侵袭,因此,抑制ERRα-FN信号通路可能会抵抗人体内E2的诱导效应,遏制舌鳞癌的转移。
