Axl抑制剂R428诱导口腔鳞癌Cal27细胞自噬的研究
2019-06-22朱钧一唐清明陈莉莉贾玉林
朱钧一 唐清明 陈莉莉 贾玉林
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部最常见的恶性肿瘤,其5 年总体生存率约为60%左右[1]。尽管综合序列治疗有效提高了口腔鳞癌的局部控制率,但临床晚期的口腔鳞癌患者生存率仍无明显改善。近年来,随着肿瘤基础研究和转化医学的不断发展,分子靶向治疗为口腔鳞状治疗提供了新的思路。Axl 激酶属于受体酪氨酸激酶TAM家族,能与配体Gas 6结合而激活其酪氨酸激酶活性,进而活化其下游的信号通路,与肿瘤细胞增殖、血管生成、转移等恶性行为密切相关[2]。近来研究发现,Axl在口腔鳞癌中高表达,且有望成为口腔鳞癌新的分子治疗靶点[3]。
自噬是真核细胞降解受损细胞器或蛋白,维持内环境稳定的高度保守的生物学过程,在多种生理病理学过程中起着重要作用[4]。自噬与肿瘤的发生和发展具有重要关系,并且为肿瘤治疗提供了新思路,是目前国际上肿瘤研究中的热点。目前关于靶向Axl对于肿瘤细胞自噬的研究尚未见报道。本研究选取口腔鳞癌细胞系Cal27为研究对象,探究Axl特异性分子抑制剂R428对口腔鳞癌细胞系细胞活力的影响,并进一步研究R428诱导口腔鳞癌细胞的自噬现象,及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞培养 口腔鳞癌细胞系Cal27(ATCC, 美国), Cal27细胞使用含有10%胎牛血清(Gibco,美国)和1%青霉素-链霉素(Hyclone,美国)的DMEM高糖培养基(Hyclone,美国)培养,隔天换液,每隔3 天传代1 次,细胞培养于37 ℃和5% CO2浓度的细胞培养箱内。
1.1.2 主要试剂 Axl抑制剂R428(Selleck,美国);自噬抑制剂3-MA(Selleck,美国);自噬抑制剂CQ、 活性氧清除试剂NAC、 MTT、 DMSO、 G418(Sigma,美国); 细胞蛋白裂解液RIPA(上海碧云天);BCA蛋白定量试剂盒(上海康成生物);DNA转染试剂(Biotool, 上海);活性氧检测试剂盒(Solarbio, 北京)。
1.2 方法
1.2.1 MTT法测定细胞活力 收集对数期Cal27细胞,调整细胞悬液浓度为50 000 个/ml,在96孔板中每孔加入100 μl细胞悬液(每孔5 000 个细胞),接种细胞后12 h(此时Cal27细胞已良好贴壁)使用不同浓度的药物处理Cal27细胞24 h。 24 h后去除原有培养基并加入含10% MTT的DMEM培养基,培养4 h后,去除培养液后加入DMSO溶解紫色结晶,使用酶标仪读取570 nm吸光度并计算细胞活力。
1.2.2 透射电镜 收集的细胞团块经2.5%戊二醛固定过夜, 1% OsO4处理后入梯度酒精脱水,环氧树脂包埋,切成65 nm超薄切片, 2%醋酸铀酰染色, Hitachi H-600型透射电镜观察。
1.2.3 GFP-LC3免疫荧光检测 使用DNA转染试剂将GFP-LC3质粒转染Cal27细胞后,利用G418筛选细胞。转染结束后,使用PBS清洗细胞两遍,更换为新鲜DMEM培养基做进一步处理。使用荧光显微镜观察Cal27细胞的LC3荧光,按照先前文献记载方法对细胞的LC3荧光点状结构进行计数统计[5]。
1.2.4 Western Blot Cal27细胞接种于60 mm培养皿,按实验分组处理24 h后提取细胞总蛋白,BCA法测定总蛋白浓度。经SDS-PAGE、转膜、封闭、一抗4 ℃ 过夜孵育、二抗室温1 h孵育等过程后,显影成像分析。
1.2.5 细胞内活性氧检测 将细胞接种于24 孔板中,完成加药处理细胞后,加入活性氧检测试剂盒中的DCFH-DA荧光探针, 37 ℃孵育30 min后,PBS洗涤细胞3 次, 加入新鲜培养基,放入荧光酶标仪中进行荧光检测[6]。
1.3 统计学分析
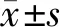
2 结 果
2.1 Axl抑制剂R428对Cal27细胞活力的影响
MTT细胞活力实验结果表明,Axl抑制剂R428处理口腔鳞癌Cal27细胞24 h后能显著降低其细胞活力,且R428对Cal27细胞的杀伤作用呈剂量依赖性(图 1)。R428的半抑制药物浓度(IC50)为1.317 μmol/L,后续实验选择0.5、 1、 1.5 μmol/L作为R428的药物作用浓度。
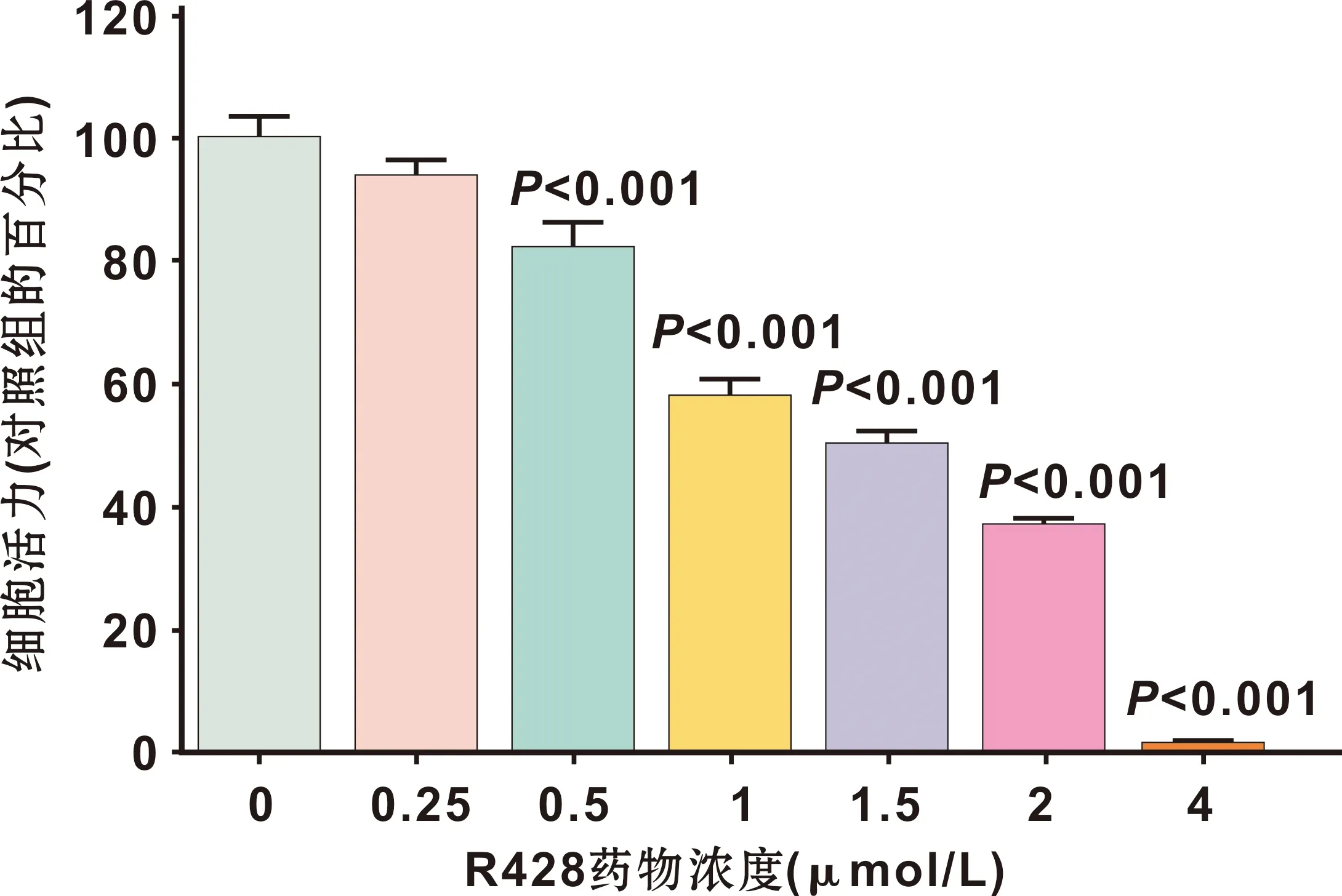
图 1 不同浓度的R428对Cal27细胞活力的影响
2.2 Axl抑制剂R428对Cal27细胞自噬活动的影响
结果表明,与对照组相比(图 2A),R428处理组的细胞内呈现出自噬泡(autophagic vacuoles)累积(图 2B),自噬泡体积较大,占据了细胞质大量空间(图 2B),且自噬泡内有较多细胞内容物(图 2C)。R428处理Cal27细胞后,细胞内的GFP-LC3荧光点数目明显增多(图 3),且GFP-LC3的荧光增多效应与R428药物作用浓度呈正相关(图 4)。Western blot实验表明,R428能够剂量依赖性地引起Cal27细胞中Atg5(自噬正向调控分子)的表达升高和P62(自噬底物)的表达降低(图 5)。这些结果均表明Axl抑制剂R428能够导致Cal27细胞自噬水平升高。
2.3 R428诱导的细胞自噬对Cal27细胞活力的影响
实验发现,与R428单独处理Cal27相比(1 μmol/L R428处理Cal27细胞24 h),使用自噬抑制剂3-MA预处理(4 mmol/L 3-MA预处理细胞1 h)Cal27后其细胞活力明显降低(图 6)。与此同时, 使用另一种抑制剂CQ阻断自噬(10 μmol/L CQ预处理细胞1 h)也能够增强R428对Cal27的细胞杀伤作用(图 6)。
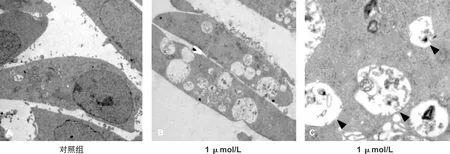
图 2 Cal27细胞自噬
(TEM, A、 B: ×1 500, C: ×3 000)
Fig 2 Autophagy of Cal27 cells
(TEM, A, B: ×1 500, C: ×3 000)
图 3 Cal27细胞自噬
(免疫荧光显微镜, ×40)
Fig 3 Autophagy of Cal27 cells
(IFM, ×40)
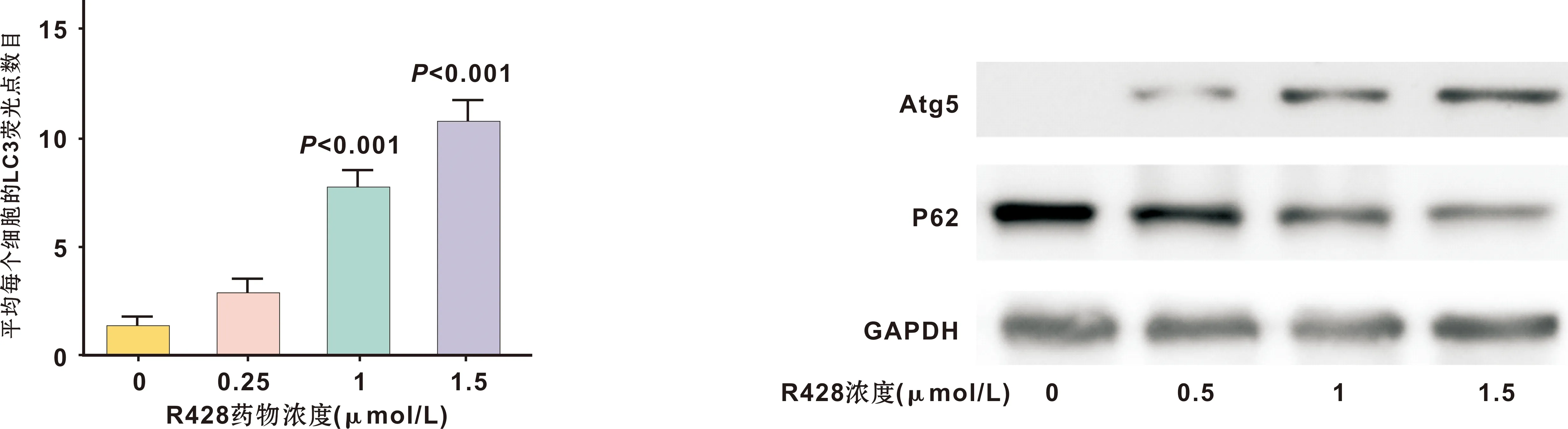
图 4 Cal27细胞内LC3荧光点数目 图 5 R428对Cal27细胞自噬相关蛋白表达的影响
Fig 4 LC3 fluorecent plot in Cal27 cells Fig 5 Autophagy related protein expression of Cal27 cells
2.4 细胞内活性氧在R428诱导的Cal27细胞自噬中的作用
细胞内活性氧(reactive oxygen species, ROS)与自噬关系密切而复杂。本研究结果表明,Axl抑制剂R428能显著升高Cal27细胞内ROS水平,且R428对ROS的刺激作用呈浓度依赖性(图 7)。使用活性氧清除试剂NAC来降低细胞内ROS水平, 结果表明,NAC不仅能有效降低细胞内ROS水平(图 7),而且能够显著抑制R428诱导的细胞内LC3荧光聚集,表明NAC能够抑制R428诱导的细胞自噬(图 7)。此外, R428单独作用能有效杀伤Cal27细胞,而活性氧清除试剂NAC与R428联合作用能进一步增强其细胞杀伤效果(图 7)。这些结果提示ROS对R428诱导的Cal27细胞自噬发挥促进作用。
3 讨 论
口腔鳞癌是头颈部最常见的恶性肿瘤之一,其恶性程度较高,生长快,浸润性强, 容易沿颈部淋巴结途径转移,晚期口腔鳞癌患者常因局部复发和颈部淋巴结及全身转移而导致死亡[7]。化疗作为目前广泛应用于口腔鳞癌手术前后的重要辅助治疗,是口腔鳞癌综合序列治疗的重要环节。随着肿瘤细胞生物学和分子生物学的不断发展进步,分子靶向治疗在口腔鳞癌治疗中的价值和意义逐渐凸显出来,成为未来临床治疗发展的重要突破方向[8]。近年来研究发现,Axl 激酶作为受体酪氨酸激酶 TAM 家族的一员,在肿瘤生长、转移和耐药性等生物学行为中发挥重要作用,有望成为恶性肿瘤治疗一个新的分子靶点[9]。与此同时,研究表明Axl不仅在口腔鳞癌中表达明显升高,且体外细胞实验和人源性肿瘤组织异种移植实验均证实针对Axl的分子靶向药物在口腔鳞癌治疗中具有重要价值[3]。R428作为Axl的一种特异性抑制剂,能够阻断Axl的催化和促癌活性,是目前研制出针对Axl最有效的分子靶向药物之一[10]。然而,Axl抑制剂R428用于口腔鳞癌治疗的作用机制较为复杂,其药理机制仍不明确。
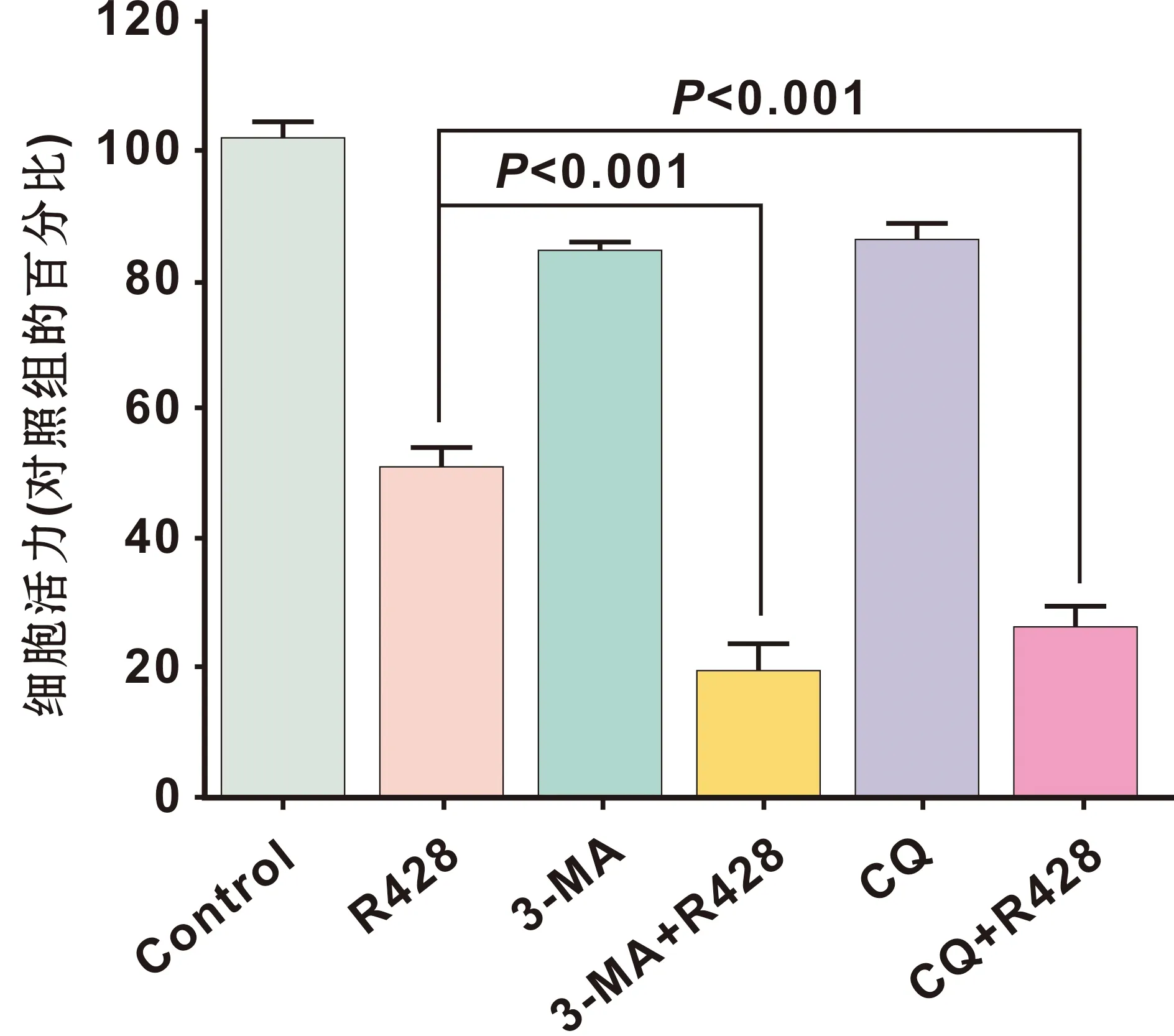
图 6 R428诱导的细胞自噬对Cal27细胞活力的影响
Fig 6 The effects of R428-induced autophagy on the viability of Cal27 cells

图 7 细胞内活性氧在R428诱导的Cal27细胞自噬中的作用(与空白对照组相比,①P<0.01,②P<0.001; 与R428单独处理组相比, ③P<0.001)
Fig 7 The role of intracellular ROS in R428-induced autophagy of Cal27 cells (versus the blank group,①P<0.01,②P<0.001; versus the R428 treatment group, ③P<0.001)
自噬是真核细胞普遍存在的生命现象。在自噬过程中,细胞通过形成双层膜样结构包裹受损或变性的蛋白质和细胞器形成自噬体,再与溶酶体融合形成自噬溶酶体,最后通过溶酶体降解其所包裹的内容物并加以回收利用,从而维持细胞内环境的稳定和能量代谢的平衡[4]。大量研究表明,自噬在肿瘤的发生、发展及放化疗抵抗中亦扮演着至关重要的角色[11]。在药物作用等应激条件下,自噬通常具有“两面性”特征:在一些情况下(如DNA损伤或它莫西芬等抗激素药物作用)自噬可以发挥促生存作用,抑制细胞死亡,而在另一些情况下(如Bcl-2或PKC蛋白抑制剂作用),自噬可以发挥促死亡作用,引起自噬性细胞死亡[12]。本研究发现,Axl抑制剂R428作用于口腔鳞癌Cal27细胞后,能明显抑制其细胞活力,导致细胞死亡; 借助透射电镜、LC3免疫荧光和Western blot多种检测手段,发现R428在诱导Cal27细胞死亡的同时,还可以显著升高Cal27的细胞自噬水平,这表明R428对Cal27细胞具有促自噬作用。为了探究R428诱导的自噬对Cal27细胞存亡的作用,本研究使用2 种常用抑制剂阻断了Cal27细胞自噬,结果表明抑制细胞自噬可增强R428对口腔鳞癌细胞的杀伤作用,这提示联合应用R428和自噬抑制药物可能成为Axl分子靶向治疗的新策略,增强其对口腔鳞癌的抗肿瘤作用。
细胞内ROS是机体内有氧代谢产生的一类活性含氧化合物的总称,能够调控多种细胞生理和病理反应,在维持细胞稳态和细胞信号转导方面具有重要作用[13]。近年来一系列研究表明,细胞内ROS可作为一种细胞内信号分子参与细胞自噬的激活[14]。本研究发现,R428能够升高Cal27细胞内ROS水平。进一步研究表明,使用活性氧清除试剂NAC阻断细胞内ROS产生后,R428诱导的细胞自噬水平明显降低,且细胞活力亦明显降低,这提示细胞内ROS可能是R428诱导的细胞自噬信号通路中的一个正向调控信号分子(图 8)。综合R428对Cal27细胞的效应,本研究发现R428在诱导口腔鳞癌细胞死亡的同时,还可以激活口腔鳞癌细胞的防御反应——细胞自噬,而细胞内ROS对自噬发挥正向调控作用(图 8)。
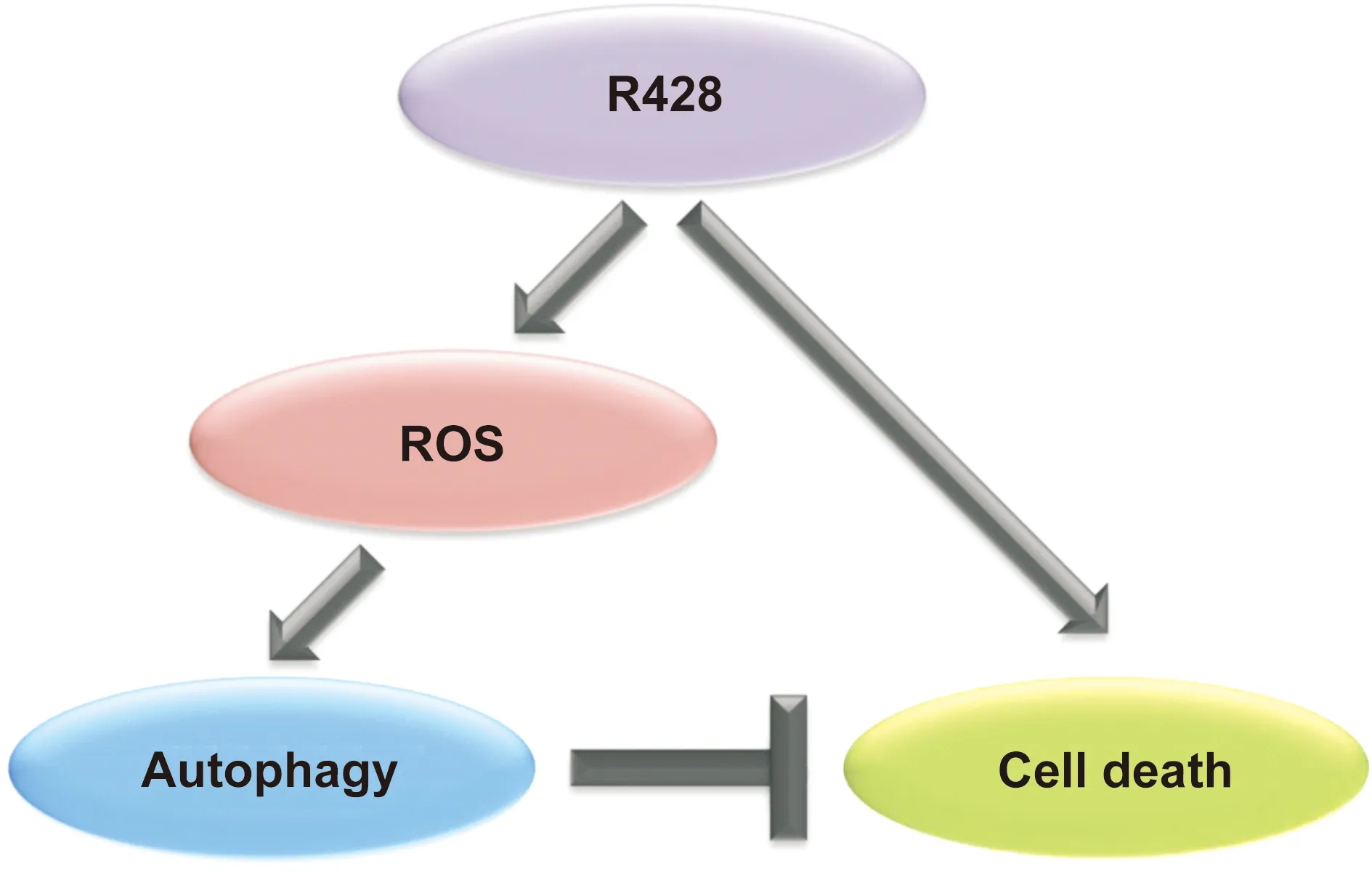
图 8 R428诱导的细胞自噬作用示意图
综上所述,本研究首次发现Axl抑制剂R428可同时诱导口腔鳞癌细胞死亡和细胞自噬,抑制细胞自噬可增强R428对口腔鳞癌细胞的杀伤作用,针对Axl的分子靶向药物R428有望成为口腔鳞癌新的治疗选择。
