正畸加力过程中外周血和脾脏中炎性单核细胞比例和CD226分子表达水平变化
2019-06-22王宪马千里金作林陈丽华
王宪 马千里 金作林 陈丽华
正畸牙齿移动(OTM)和生理牙齿移动被认为是以破骨细胞和成骨细胞动态平衡引发骨重塑为特征的反应过程;而不同之处则在于正畸牙齿移动过程中牙齿移动的速度更快,正畸力引起的组织变化更加显著和广泛[1]。正畸力需要作用于牙周膜和牙槽骨才能启动正畸牙齿移动这一反应。正畸力的大小、方向和持续时间等都会对牙齿移动的效果产生影响, 1951 年Reitan[2]的研究结果使人们开始重视“牙齿移动是一系列骨吸收及改建的过程”这一理论。而破骨细胞作为目前可以溶解骨组织的重要细胞参与了正畸牙齿移动过程中骨吸收及骨改建的过程。破骨细胞由单核/巨噬细胞而来,现已证明在体外诱导的情况下,单核细胞在M-CSF与RANKL的共同刺激下可以诱导分化为成熟的破骨细胞[3],而在正畸过程中牙周膜内的基质细胞及成骨细胞所表达的RANKL和OPG等分子均参与了破骨细胞的分化和成熟过程[4-5]。但是这些分子的诱导作用首先都需要破骨前体细胞成功地从血管内皮细胞间迁出血管到达作用部位才能得以实现。单核细胞是骨髓来源的细胞,存在于外周血和脾脏,被认为是破骨细胞的前体[6],正畸加力可以使脾脏和外周血中炎性单核细胞的比例在加力初期有所减少,但是加力7 d时炎性单核细胞比例恢复正常[7],但是具体影响单核细胞比例变化的机制尚不明确。CD226分子是炎性单核细胞表面重要的分子标志[8],参与炎性单核细胞的迁移和功能[9],但其在正畸加力过程中炎性单核细胞表面表达水平未见报道。鉴于此,本研究以小鼠为实验模型,在观测正畸加力过程中小鼠脾脏和外周血中炎性单核细胞比例改变的基础上,进一步观测CD226分子表达水平的变化。
1 材料与方法
1.1 主要材料及试剂
正畸用镍钛拉簧(上海埃蒙迪);电子测力计(SF-5,浙江艾普);0.1 mm结扎钢丝(上海晨曦);酸蚀剂(西湖巴尔);EasyBond粘接剂、 Z350复合树脂(3M, 美国);开口器及可移动实验平台(自制);光固化灯(LED.B,广西啄木鸟);戊巴比妥钠(默克,德国);流式荧光抗体(Biolegend,美国);小鼠淋巴细胞分离液(达优,深圳达科为); RPMI培养基(Hyclone, 美国);体式显微镜(Leica,德国)。
1.2 实验动物
6~8 周龄无特定病原体(SPF级)的雌性C57小鼠(空军军医大学实验动物中心提供),体重18~20 g(饲养于第四军军医大学基础医学院免疫教研室动物房),提供消毒饲料及消毒饮用水。
1.3 小鼠牙齿正畸加力模型的建立
选择雌性C57小鼠,随机分为3 组(加力1 d组、加力3 d组和加力7 d组),每组中分为实验组及对照组(加力3 d组、加力7 d组各4 只, 加力1 d组中实验组5 只,对照组3 只)。使用0.01 g/ml的戊巴比妥钠对小鼠进行进行腹腔注射(回抽无血,避免伤及内脏),注射量为1.5 ml。小鼠麻醉后将小鼠仰卧固定于实验台上,使用自制开口器打开小鼠口腔,充分暴露左侧上颌第一磨牙,使用乙醇棉球清洁牙面后酸蚀牙面,酸蚀60 s后使用酒精棉球擦拭牙面,吹干至牙齿表面呈现白垩色,涂布粘接剂后光固化10 s;拉簧长度修建至4 mm,将一侧第一圈弯折90°,另一侧与0.1 mm结扎丝固定。将弹簧弯折侧放置于第一磨牙上,使用适量粘接树脂进行粘接,而后光固化40 s。相同方法在双侧切牙上粘接一“绿豆粒”大小的树脂球,将结扎丝置于树脂球两侧,与测力计连接;移动实验平台待测力计数值显示为0.39 N时停止在此位置上进行结扎。术后喂以面包,每日早晚2 次观察口内弹簧如出现脱落,及时重新进行粘接;加力7 d在3 d时再次对弹簧进行加力。
1.4 标本采集
小鼠在加力1、 3、 7 d后,摘除眼球法采集外周血于抗凝管中用以后续的流式细胞术检测;之后将小鼠浸泡于70%乙醇溶液中5 min进行消毒,而后将小鼠置于解剖台上分离获得脾脏,采用研磨的方法获得脾脏的单细胞,用于流式细胞术检测; 迅速分离小鼠上颌骨,放入多聚甲醛固定液中固定24 h后取出小鼠上颌骨标本置于10% EDTA溶液中常温进行脱钙, 3 d换脱钙液, 3 周后使用针刺法检查脱钙情况;脱钙结束后将骨标本进行修整,仅保留小鼠左侧上颌磨牙,而后进行包埋,石蜡切片进行免疫组化及HE染色。
1.5 流式细胞术检测
加入小鼠淋巴细胞分离研磨获得的小鼠脾脏单细胞悬液上放置1.5 ml RPMI培养基,在800 g下离心30 min(去刹车),可见明显的“白膜层”,使用弯头滴管小心吸取白膜层细胞,注意勿将下层分离液吸出。使用5 ml流式洗液在1 000 r/min离心5 min, 2 遍后将细胞稀释为10 ml,进行细胞计数,根据计数结果每个流式管中放入1 ×106个细胞进行检测,每只小鼠设ISO(同型对照组),FMO(荧光减一组)及EXP(实验组)分别进行检测,在每个流式管内加入相应流式荧光抗体,常温下孵育20 min,洗涤两遍后将细胞稀释至适宜浓度进行检测。每管中加入外周血100 μl, 分组同脾脏,在每个流式管内加入相应流式荧光抗体,常温下孵育20 min后每管中加入1 ml红细胞裂解液,裂解红细胞20 min(如20 min裂解不彻底可再次裂解),而后使用流失洗液清洗2 遍后进行检测。
1.6 HE染色
常规HE染色封片, 光镜下观察小鼠第一磨牙牙根近远中根的不同部位来确定是否有破骨细胞生成。
1.7 免疫荧光染色
常规染色封片, 荧光显微镜下观察小鼠第一磨牙牙根近远中根的不同部位破骨细胞生成情况。
1.8 统计方法
应用SPSS16.0统计软件(SPSS Inc,Chicago,USA)对所取得的数据资料进行统计分析,所取得的计量资料均选择两样本Kolmogorov-Smirnov检验(K-S检验)进行统计对比分析, 检验水平取0.05,双侧检验。
2 结 果
2.1 成功建立小鼠牙齿正畸移动模型
模型建立期间均未出现拉簧脱落的情况,加力1、 3、 7 d后均可在体式显微镜下观察到小鼠上颌第一磨牙远中存在间隙,证明小鼠上颌第一磨牙近中移动有效,实验模型建立成功(图 1A);在体式显微镜下进行拍照,测量间隙,并将数据进行统计学分析,加力1 d时小鼠第一磨牙近中移动(50.76±7.483) μm,加力3 d时小鼠第一磨牙近中移动(85.95±4.532) μm,而加力7 d时小鼠第一磨牙近中移动(121.1±7.468) μm,组间比较P<0.05。 将小鼠上颌骨标本制作切片后行免疫荧光染色可见在加力7 d时, 小鼠近中根牙周膜近中侧出现破骨细胞(图 1B)。
2.2 正畸加力后脾脏及外周血中的炎性单核细胞比例和CD226分子表达水平发生变化
取小鼠脾脏和外周血单个核细胞进行流式细胞术检测, 检测发现脾脏及外周血中的炎性单核细胞比例均在正畸加力过程中出现了变化(图 2A、2B)。 在脾脏中加力1 d时实验组中炎性单核细胞较对照组无明显差异, 加力3 d时实验组中的炎性单核细胞(2.88%)比例较对照组(0.93%)中明显增高,而到加力7 d时实验组中的炎性单核细胞比例仍较对照组无明显差异, 在加力3 d时和加力7 d时脾脏炎性单核细胞表面CD226分子的平均荧光强度分别为5941和4997,均低于对照组(9758和8770)(图 3A、3B),在外周血中可见加力1 d时外周血中的炎性单核细胞比例(1.16%)较对照组(2.46%)出现了明显的下降,而在加力3 d时外周血中的炎性单核细胞比例(9.02%)较对照组(2.23%)

图 1 第一磨牙移动和牙周膜中破骨细胞生成
(×25)
Fig 1 The movement of first molar and the osteoclasts in periodontal ligaments
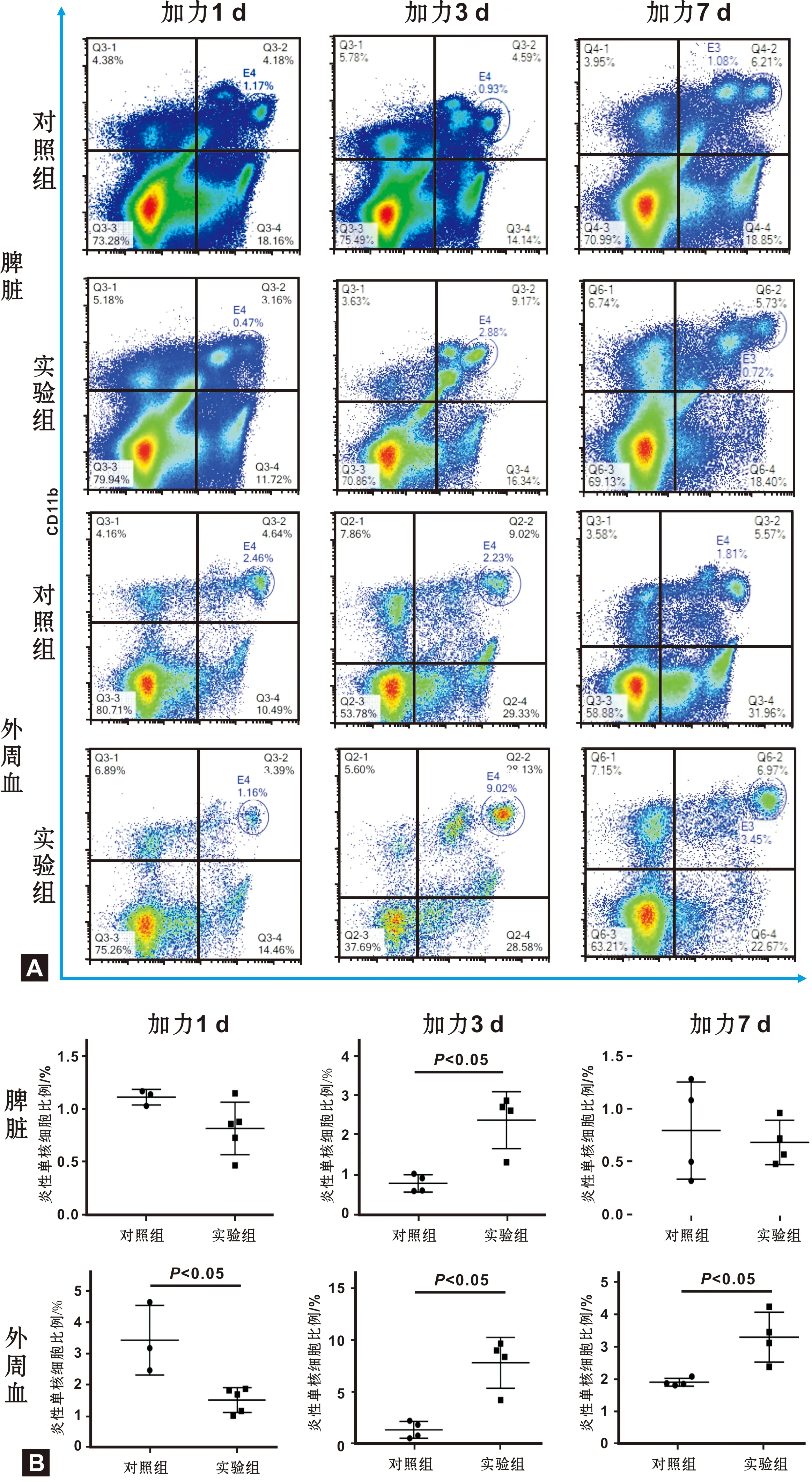
图 2 加力不同天数小鼠脾脏和外周血中炎性单核细胞比例变化
Fig 2 The ratio of inflammatory monocytes in the spleen and the peripheral blood of mouse in different periods
出现了明显的升高,而在加力7 d时外周血中的炎性单核细胞比例(6.97)与对照组(1.81%)相比仍增高,但相比加力3 d组比例有所减少(图 2B)。相较于对照组(6854和10078),外周血中的炎性单核细胞表面CD226的平均荧光强度也在加力3 d(4302)及加力7 d(6766)时出现降低(图 3B)。在加力1、 3、 7 d时炎性单核细胞中CD226+细胞比例均无明显差异(图 3C)。
2.3 小鼠正畸加力后牙周组织的变化及破骨细胞生成
取对照组、加力1 d、加力3 d和加力7 d组小鼠标本制作石蜡切片行HE染色,光镜下观察,发现加力1 d时小鼠第一磨牙近中侧牙周膜间隙变窄,但未见明显破骨细胞;在加力3日时可见在近中侧牙周膜处出现破骨细胞(1.5±0.29);加力7 d时可见在近中侧牙周膜处出现更多的破骨细胞(2.5±0.29)(图 4A),并随着加力时间的延长破骨细胞的数量有所增加(图 4B)。
3 讨 论
破骨细胞在正畸治疗过程中具有重要的功能,因此对于破骨细胞的研究一直是正畸领域的热点问题。目前为止正畸过程中牙周膜内破骨细胞的分化增殖过程已基本清晰,当正畸力加载于牙周膜,压力侧的牙周膜被压缩,同时伴随牙周膜血管的压缩,造成局部供血不畅,形成局部的氧缺乏微环境。这将引发局部的炎症反应,炎症因子如IL-1β、TNFα、PGE2、CSF-1、VEGF等大量分泌,这些因子的分泌使得局部血管通透性改变,大量成骨前体细胞募集至牙周膜,在局部成骨细胞和基质细胞表达的RANKL刺激下使得破骨前体细胞逐渐分化为破骨细胞,从而产生破骨作用[10-12]。有文献表明,CD226分子作为炎性单核细胞表面一种高表达的分子在单核细胞迁移出血管内皮的过程中发挥重要作用[9,13],因此本实验通过观测正畸加力过程中小鼠体内炎性单核细胞比例和CD226分子表达水平的动态变化,旨在进一步探索和明确正畸加力过程中的细胞和分子机制。
Zeng等[7]在研究正畸力对于炎性单核细胞的影响时发现,在加力初期不论是脾脏还是外周血中,炎性单核细胞的比例均下降, 而在后期出现回升, 相较于Zeng等的研究, 本实验发现, 在小鼠牙齿正畸加力模型建立1 d时,只有外周血中的单核细胞比例发生了下降,而脾脏和炎性单核细胞表面CD226分子表达水平均无明显变化。正畸加力初始阶段,组织反应需要在一定的时间内才能启动,加力1 d时,牙周膜局部的变化只能招募外周血中的单核细胞募集至作用部位,但是脾脏中的单核细胞受到加力影响的效果尚未体现,骨髓中的新生单核细胞尚未补充至外周血及脾脏;而在加力3 d时脾脏及外周血中的单核细胞数量有所增加,同时CD226分子表达降低。有文献表明脾脏中贮存有大量的炎性单核细胞, 在炎症发生时可以快速补充至外周血,进而抵达作用部位[14],而脾脏中的炎性单核细胞由骨髓中的单核细胞迁移而来[15],在加力3 d时由于力量的持续刺激,脾脏中原有的炎性单核细胞补充至血液中,同时骨髓中产生的炎性单核细胞大量补充至外周血及脾脏,使得脾脏和外周血中炎性单核细胞比例均增加。而CD226分子表达水平降低可能是由于原本高表达CD226分子的炎性单核细胞已经移动至外周的作用部位所引起。加力7 d时,脾脏中炎性单核细胞比例与对照组无统计学差异,而CD226分子的表达出现降低可能是由于加力7 d时骨髓新生的炎性单核细胞已经通过血液补充至脾脏,但是由于血中炎性单核细胞的CD226分子表达低,因此补充至脾脏的炎性单核细胞表面CD226分子表达水平依旧较对照组降低。由于本实验采用的拉簧和流式细胞术检测方法与Zeng等[7]研究中所使用实验条件均不同,可能实验结果存在差异,故在后期实验中将加大样本量,确保实验结果的准确性。

图 3 加力不同天数小鼠脾脏和外周血中CD226+炎性单核细胞比例和平均荧光强度变化
Fig 3 The ratio and the MFI of CD226+inflammatory monocytes in the spleen and the peripheral blood of mouse in different periods
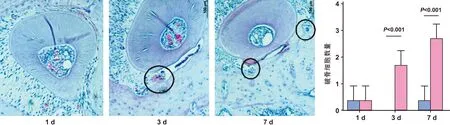
图 4 加力不同天数小鼠第一磨牙近中根牙周膜中破骨细胞数量变化
正畸力的加载可以影响外周血和脾脏中炎性单核细胞比例的变化,同时加力后炎性单核细胞表面CD226分子的表达水平也存在变化,说明在正畸过程中CD226分子极有可能参与了正畸力作用下的牙齿移动过程。CD226分子对正畸牙齿移动过程产生影响的细胞和分子机制尚须进一步深入探讨。
