RNA干扰FLOT2基因表达下调NF-κB信号对胃癌细胞凋亡诱导作用研究
2019-06-21吴春芝
雷 蕾,张 涛,叶 斌,吴春芝
1.成都市第六人民医院肿瘤科,四川 成都 610051; 2.西南医科大学附属成都三六三医院消化内科
胃癌是常见的危害人类健康的消化系统肿瘤之一,近年来发病率呈上升趋势[1]。大量研究表明,肿瘤发生、发展与基因表达失调、缺失、突变等多种因素有关[2],因此,寻找有效的肿瘤诊疗分子靶点受到广泛关注。作为众多生物学过程的分子物质平台,脂质筏可将多种信号分子通路转化为发挥各种功能的复合物,进而影响肿瘤发生、发展。脂筏结构蛋白为脂质筏的标志物,包含脂筏结构蛋白1(Flotillin-1,FLOT1)和脂筏结构蛋白2(Flotillin-2,FLOT2)两种同源亚型,FLOT2定位于染色体17q11-12,在人体不同组织细胞呈低表达,在多种肿瘤组织中FLOT2有高表达,影响肿瘤发生、发展。如肺癌组织和细胞中FLOT2均高表达,其蛋白表达与肿瘤分期、淋巴结转移呈正相关,FLOT2高表达患者生存期低于低表达患者[3]。干扰FLOT2在肾癌、乳腺癌细胞表达可明显抑制细胞增殖[4-5]。胃癌中FLOT2研究较少,有研究显示,胃癌组织FLOT2蛋白呈高表达,其表达与侵袭及转移密切相关,沉默其表达后可减弱癌细胞的增殖及侵袭能力[6]。FLOT2对胃癌细胞凋亡的影响及机制研究尚未明确。因此,本研究首先检测了不同胃癌细胞FLOT2表达,将设计合成的FLOT2 siRNA转染胃癌细胞,旨在探讨FLOT2表达抑制对胃癌细胞凋亡变化,并进一步研究其作用机制。
1 材料与方法
1.1 实验材料人胃癌BGC823、SGC7901和MKN28细胞及人正常胃黏膜上皮细胞GES1均购自美国ATCC。DMEM培养基(批号:NAD1367)购自美国Gibco;FBS(批号:2104)购自杭州四季青;Annexin V-FITC/PI试剂盒购自澳大利亚Bender Medsystems;FLOT2、NF-κB p65、IKKβ、pIKKβ和Bax抗体(批号:34365、83425、26845、149385、27745)均购自美国CST;流式细胞仪购自美国BD。
1.2 方法
1.2.1 细胞培养及转染:GES1、BGC823、SGC7901和MKN28细胞用DMEM培养基,在37 ℃、饱和湿度、体积分数为5%的CO2培养箱中常规传代培养。实验为生长至对数期的细胞。
1.2.2 siRNA设计合成:根据Genbank数据库提供的FLOT2基因序列及siRNA的设计原则,并参照有关文献[7]的siRNA片段,设计FLOT2 siRNA(si-FLOT2组)及阴性对照siRNA(阴性组)序列,序列如下(仅列出正义链):FLOT2 siRNA:5′-GCCUGUCCCUUCUGGUAAAdTdT-3′;阴性对照siRNA:5′-UUCUCCGAACGUGUCACGUTT-3′。经序列比对,与其他基因均无同源性,由上海吉玛合成。
1.2.3 siRNA转染:转染前1 d,接种BGC823细胞于无抗生素的DMEM完全培养基中,细胞70%~80%生长融合时,胰酶消化细胞,制备成细胞悬液,并调整细胞密度为1×105ml-1,每孔2 ml接种于6孔板。参照脂质体LipofectamineTM2000说明制备siRNA-LipofectamineTM2000复合物,并将复合物加入至6孔板,加等体积无菌水为空白组,每组设置5个复孔,37 ℃、体积分数为5%的CO2培养箱中培养6 h,更换为含血清的完全培养基。继续培养48 h,收集细胞用于后续实验研究。
1.2.4 Western blotting:RIPA细胞裂解液适量提取总蛋白,BCA法测定蛋白浓度,按照4∶1比例将蛋白样品与5×Loading buffer混合,煮沸变性3~5 min,取变性蛋白,每孔道40 μg,通过10%的SDS-PAGE,取分离后的蛋白电转至PVDF膜,质量浓度为50 g/L脱脂奶粉封闭膜1 h,加入FLOT2、NF-κB p65、IKK-β、pIKK-β和Bax一抗,工作液浓度均为1∶1 000,4 ℃孵育过夜,洗膜,加1∶2 000稀释的HRP标记的二抗,室温孵育2 h,洗膜,ECL试剂显色,Bio-Rad化学发光成像系统及配套的软件采集图像。以GAPDH为内参蛋白,以目的蛋白与内参灰度值比值为蛋白相对表达量。实验重复3次。
1.2.5 细胞凋亡检测:胰酶消化生长至对数期的BGC823细胞,调整细胞浓度为1×106ml-1,常规培养24 h,将siRNA转染细胞,收集转染48 h的细胞,取1 ml细胞,预冷PBS洗涤及1×Binding buffer重悬后,分别加入Annexin V-FITC和PI,各为5 μl和10 μl,室温避光15~20 min,加1×Binding buffer 300 μl,1 h内流式细胞仪检测。实验重复3次。
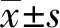
2 结果
2.1 FLOT2在胃癌细胞表达Western blotting检测人胃癌BGC823、SGC7901和MKN28细胞中FLOT2蛋白表达,结果如图1、表1所示,胃癌细胞中FLOT2蛋白表达均显著高于人正常胃黏膜上皮细胞GES1(P<0.05)。

图1 胃癌细胞FLOT2蛋白表达电泳图Fig 1 Electrophoretic diagram of FLOT2 protein expression in gastric cancer cells

组别FLOT2蛋白相对表达量GES10.062±0.007BGC8230.561±0.049∗SGC79010.323±0.030∗MKN280.270±0.026∗F值125.315P值0.000
注:与GES1细胞相比,*P<0.05。
2.2 si-FLOT2转染BGC823细胞效果si-FLOT2转染BGC823细胞48 h, Western blotting检测FLOT2蛋白表达,结果如图2、表2所示,si-FLOT2组FLOT2表达显著低于空白组(P<0.05),而FLOT2在阴性组表达与空白组比较,差异无统计学意义(P>0.05)。

图2 Western blotting检测si-FLOT2转染BGC823细胞后FLOT2蛋白表达
Fig 2 The expression of FLOT2 protein after si-FLOT2transfected into BGC823 cells detected by Western blotting
2.3 si-FLOT2转染诱导BGC823细胞凋亡各组细胞凋亡率检测结果如图3、表3所示,si-FLOT2组细胞凋亡率显著高于空白组(P<0.05)。



注:与空白组相比,*P<0.05。

图3 流式细胞术检测si-FLOT2转染的BGC823细胞凋亡率Fig 3 Apoptosis rate after si-FLOT2 transfected into BGC823 cells detected by flow cytometry



注:与空白组相比,*P<0.05。
2.4 si-FLOT2转染抑制BGC823细胞NF-κB信号Western blotting检测NF-κB信号通路NF-κB p65、IKK-β、p-IKK-β及下游促凋亡蛋白Bax的蛋白表达,结果如图4、表4所示,与空白组比较,si-FLOT2组NF-κB p65、IKK-β和p-IKK-β蛋白表达显著降低,Bax蛋白表达显著升高(P<0.05)。

图4 Western blotting检测si-FLOT2转染后BGC823细胞NF-κB信号相关蛋白表达
Fig 4 Expression of NF-κB signal related protein in BGC823cells after si-FLOT2 transfected detected by Western blotting

表4 NF-κB p65、IKK-β、p-IKK-β和Bax蛋白相对表达量Tab 4 Relative expressions of NF-κB p65, IKK-β, p-IKK-β and Bax proteins
注:与空白组相比,*P<0.05。
3 讨论
RNA干扰(RNAi)是指在真核生物内,在dsRNA的诱导作用下,siRNA特异性结合于靶基因mRNA同源性序列,引起mRNA降低,从而沉默靶基因表达,它是基因转录后对基因表达调节的机制之一,具有普遍性、高效性和特异性的优势,近年广泛地应用于基因功能研究、肿瘤治疗等方面[8-9]。因此,利用该技术抑制抑癌基因表达,可成为潜在的肿瘤治疗手段。FLOT在众多生物学过程中扮演重要角色,如细胞的增殖、凋亡、黏附等。FLOT2属于FLOT家族成员之一,参与多种肿瘤的发生、发展[10-11]。有研究显示,siRNA介导的FLOT2蛋白表达水平的降低可明显抑制Src酪氨酸激酶的活性,从而减缓TGF-β诱导的人鼻咽癌细胞株EMT过程[12];FLOT2 siRNA可降低食管鳞状细胞癌的生长和侵袭[13]。胃癌中FLOT2研究较少,有研究显示,siRNA介导的FLOT2表达下调可抑制胃癌细胞增殖、侵袭和迁移[6]。本研究旨在探讨FLOT2 siRNA对胃癌细胞凋亡的影响及机制。首先检测了不同胃癌细胞FLOT2蛋白表达,发现BGC823细胞中FLOT2表达最高,因此选择作为后续研究对象。将FLOT2 siRNA按照脂质体LipofectamineTM2000说明转染BGC823细胞,发现细胞中FLOT2表达明显降低,且可明显诱导细胞凋亡。
NF-κB是一种普遍存在的转录因子,属于NF-κB/Rel蛋白家族,可介导免疫应激、炎症反应等,近年研究显示,NF-κB在多种肿瘤中呈高表达,其表达参与细胞增殖、侵袭行为、凋亡抑制和血管形成等[14-15]。也有研究指出,抑制NF-κB信号可降低肿瘤生长。如NF-κB抑制剂PDTC可抑制人骨髓瘤U266细胞增殖,阻滞细胞周期,诱导细胞凋亡[16];丹参酮ⅡA可抑制人胃癌 SGC7901细胞增殖,促进其凋亡,其机制可能是降低NF-κB信号通路NF-κB p65、磷酸化IκB-α、IKK-β和磷酸化IKK-β表达[17]。此外,NF-κB信号激活后抗胃癌凋亡的分子机制是直接调控下游靶基因表达,如可通过调控Bcl-2家族蛋白及caspase家族蛋白发挥抗凋亡作用。Bax是Bcl-2家族中的一员,是近年发现的哺乳动物促细胞凋亡基因,其过度表达可抑制Bcl-2功能,加速细胞凋亡,有些学者认为Bcl-2/Bax比例是决定细胞是否凋亡的关键[18]。在包括胃癌在内的多种肿瘤中Bax低表达[19-20]。本研究检测了FLOT2 siRNA转染后的BGC823细胞NF-κB p65、IKK-β、p-IKK-β和Bax的蛋白表达,发现NF-κB p65、IKK-β和p-IKK-β表达明显降低,Bax表达升高。这提示FLOT2 siRNA对胃癌细胞凋亡诱导机制可能与NF-κB信号下调有关。
综上所述,RNAi抑制胃癌细胞FLOT2表达可诱导癌细胞凋亡,机制可能与NF-κB信号下调有关。该研究可能为FLOT2在胃癌中研究提供了一定的理论帮助,提示FLOT2可能是一个有效的诊疗靶点。值得进一步深入探究。
