APP基因启动子区甲基化与冠心病相关性的研究
2019-06-14季慧慧郑中华段世伟
季慧慧,郑中华,段世伟
(宁波大学医学院浙江省病理生理学技术研究重点实验室,中国浙江宁波315211)
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)简称“冠心病”,是全球死亡率最高的疾病之一,也是全球公共卫生面临的主要挑战。根据2014年世界卫生组织的报告,从2000年到2012年,全球有5 600万人死于CHD[1]。CHD是一种由多种因素导致的复杂疾病。相关研究表明,年龄、吸烟史、饮酒史、高血压病史、糖尿病史、肥胖、炎症、高血脂等是早发CHD的危险因素[2]。据报道,包括DNA甲基化、组蛋白修饰、染色质重构和非编码RNA调控在内的表观遗传因子通过改变基因与环境的相互作用而引起CHD[3]。DNA甲基化是指通过DNA甲基转移酶(DNA methyltransferase,Dnmt)的作用在 5′-CpG-3′二核苷酸胞嘧啶的第5个碳原子上合成甲基。DNA甲基化涉及多种细胞生理和病理活动,例如时间和空间特异性基因表达、X染色体失活、衰老、癌症和心血管疾病[4]。已知淀粉样前体蛋白(amyloid precursor protein,APP)高甲基化与阿尔茨海默病相关[5]。APP致病变体或重复会导致β淀粉样蛋白(β-amyloid protein,Aβ)相关的脑淀粉样血管病的发生,是原发性非创伤性脑出血的主要原因[6]。慢性炎症引起的疾病如动脉粥样硬化等是由多种遗传因素和环境因素共同作用的结果,并且这些疾病具有共同的分子机制。越来越多的小鼠模型表明APP在血管炎症中起核心作用,可激活内皮细胞和巨噬细胞中的一系列促炎事件[7~8]。本研究主要观察CHD患者APP甲基化水平并探讨其可能存在的调节机制,旨在阐明CHD与APP甲基化水平改变之间的关系。
1 研究对象与方法
1.1 研究对象
2015年2月至2018年2月,从浙江省宁波市第一医院收集CHD患者538名(63±10岁,男性378名,女性160名),作为病例组,同期健康体检者453名(59±10岁,男性249名,女性204名),作为正常对照组。纳入病例组的标准:采用Judkins冠状动脉造影术,将左回旋支、左前旋降支、左冠状动脉主干、右冠状动脉中至少有一支冠状动脉狭窄程度大于或等于50%的患者纳入病例组。排除标准:1)患有先天性心脏病、风湿性心脏病、肺性心脏病、高血压心脏病等的患者;2)患有精神疾病的患者;3)患有恶性肿瘤、肝肾功能不全、血液系统疾病的患者。对照组入选对象为该院同期健康体检者,无肝肾功能异常、恶性肿瘤、心脏病等。本研究获得了所有研究对象的知情同意,并且通过了宁波大学医学院伦理委员会的批准。
1.2 血液采集及一般临床资料
受试者空腹8 h后,抽取肘静脉血5 mL,用2%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)抗凝。收集一般资料,包括年龄、性别、吸烟史、高血压病史、糖尿病史、冠状动脉狭窄程度等。采用Beckman AU5800全自动生化分析仪测定低密度脂蛋白(low-density lipoprotein,LDL)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(highdensity lipoprotein,HDL)、甘油三酸酯(triglyceride,TG)、载脂蛋白 A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein B,ApoB)、载脂蛋白E(apolipoprotein E,ApoE)、脂蛋白(a)[lipoprotein(a),Lp(a)]、C-反应蛋白(C-reactin protein,CRP)、白蛋白(albumin)、球蛋白(globulin)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、碱性磷酸盐(alkaline phosphate,ALP)、γ-谷氨酰转移酶(γ-glutamyl transferase,γ-GT)等的浓度。
1.3 DNA提取及亚硫酸氢盐修饰
根据E.Z.N.A.TM血液试剂盒(Omega Bio-Tek,Norcross,GA)的说明书,提取基因组DNA,保存在-20℃冰箱中。通过Nanodrop 2000分光光度计(Thermal Scientific Co.Ltd,Wilmington,USA)测量DNA浓度。通过EZ DNA Methylation-Gold Kit(Zymo Research,Orange,USA)进行亚硫酸氢盐修饰。基因组DNA通过亚硫酸氢盐修饰后,未甲基化的胞嘧啶相应地转化为尿嘧啶,而已甲基化的胞嘧啶则保留在反应中。
1.4 甲基化特异性实时定量聚合酶链反应(quantitative methylation-specific PCR,qMSP)
将经过亚硫酸氢盐修饰的DNA用作qMSP测定中的模板,最终反应体系共20 μL,含有10 μL SYBR Green I Master(Roche,Basel,Switzerland)、0.5 μL 正向引物、0.5 μL 反向引物、1 μL DNA样本以及8 μL ddH2O。正向引物的序列为 5′-GTTGTCGTCGTTAGTAGTC-3′,反向引物的序列为 5′-TCGTTTCACCTTCCTCTC-3′。PCR 反应在Light Cycler 480(Roche,Basel,Switzerland)中进行,具体条件如下。首先,95℃下进行1个10 min的循环;其次,95℃下持续20 s,58℃下退火20 s,72℃持续30 s,循环45次;然后,1循环的融化分析曲线在下列条件进行:95℃15 s,60℃1 min,之后以每秒增加0.11℃的幅度升温至95℃;最后,40℃下延伸扩展10 min。
1.5 Sanger测序及毛细管电泳
我们随机选取亚硫酸氢盐修饰过的DNA进行Sanger测序。与原序列相比,亚硫酸氢盐修饰后的尿嘧啶完全转化为胸腺嘧啶,甲基化胞嘧啶保持不变,则转化过程得到验证。采用全自动高分辨率毛细管电泳仪(Qsep100,Bioptic Inc.,Taiwan,China)对qMSP产物进行分析,以验证产物的片段大小是否与理论片段长度相符。
1.6 统计分析
所有的统计分析均使用SPSS 18.0软件(SPSS Inc,Chicago,IL,USA)。独立样本t检验、卡方检验及Mann-Whitney U test检验用于评估临床特征及APP基因甲基化水平在CHD组与对照组之间的差异。采用Spearman相关性测试来评估APP甲基化与生化指标之间的相关性。DNA甲基化水平采用相对甲基化率(percentage of methylated reference,PMR)表示。每个样本的PMR使用2-△△Ct量化方法计算[9],具体公式为
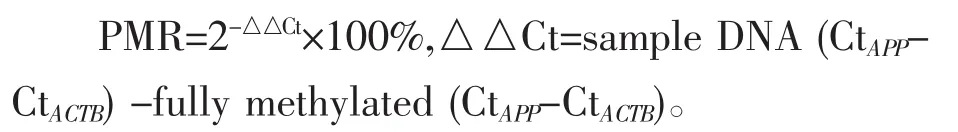
2 结果
2.1 受试者临床基线特征
我们一共收集了538名CHD患者(63±10岁,男性378名,女性160名)及453名正常对照(59±10岁,男性249名,女性204名)。其中,CHD组吸烟及糖尿病患者人数显著高于对照组(吸烟,P=0.001;糖尿病,P=0.019,表1),但白蛋白水平显著低于对照组(P=0.001,表 1)。此外,AST、ALP 及 γ-GT 水平在CHD组中显著高于对照组(AST,P=3.0E-04;ALP,P=0.001;γ-GT,P=0.018,表 1)。
年龄是CHD的重要影响因素[10],因此我们进一步根据年龄分层进行亚组分析。以CHD组的平均年龄63岁为界,结果发现在年龄≥63岁的人群中,CHD组白蛋白水平显著低于对照组(P=0.016,表2)。在年龄<63岁的人群中,CHD组糖尿病患者人数显著高于对照组(P=0.001,表2)。在两个亚组中,CHD组吸烟人数显著多于对照组(≥63岁,P=0.001;<63岁,P=5.0E-05,表 2);AST、ALP 水平在CHD组中显著高于对照组(表2)。
2.2 APP启动子CpG岛区域的靶序列说明
启动子CpG岛异常甲基化与基因转录失活有关[11]。由于甲基化往往发生在CpG二核苷酸的位置,所以我们选择了启动子区域CpG岛位置的位点(chr21:26 169 970~26 170 045)进行研究(图1A)。同时,我们的研究是基于平均甲基化率,而不是针对某个特定的cg位点。Sanger测序结果表明,扩增片段与目标序列吻合,亚硫酸氢盐转化效果良好(图1B)。毛细管电泳结果(图1C)证实扩增产物长度为76 bp。
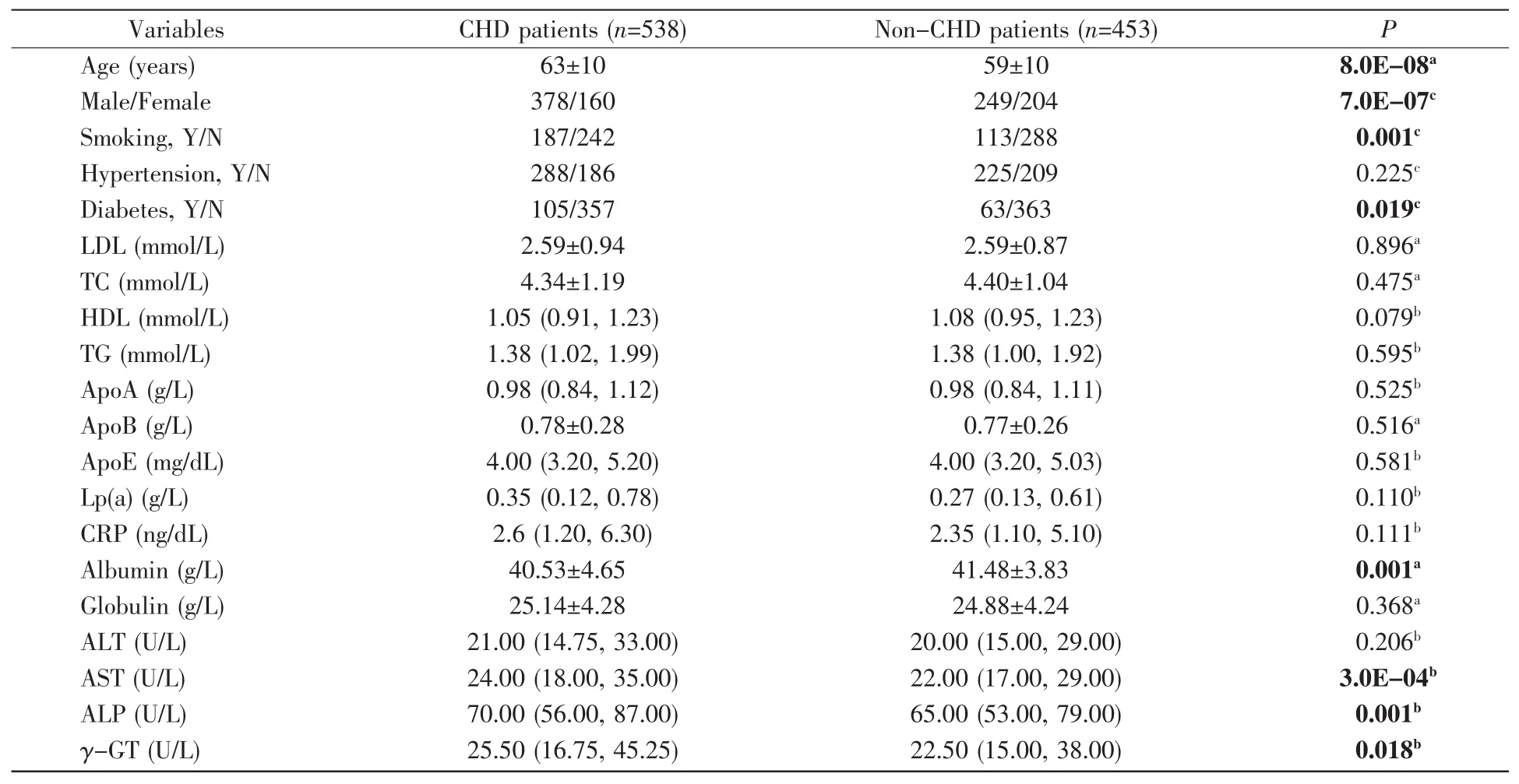
表1 根据CHD进行血管造影研究的人群的基线特征Table 1 Baseline characteristics of the population undergoing angiographic study according to CHD
2.3 CHD患者APP甲基化与正常对照之间的比较
qMSP检测发现APP基因甲基化水平在CHD组显著高于对照组(P=0.026,表3)。进一步的性别分层分析发现,APP基因甲基化水平在男性CHD组显著高于男性对照组(P=0.025,表3)。
2.4 CHD患者APP甲基化与冠脉狭窄程度之间的相关性
冠状动脉狭窄程度是CHD的主要评判依据。在CHD患者中,我们发现不吸烟患者的APP甲基化水平和狭窄程度(Gensini冠脉狭窄评分)呈正比(r=0.076,P=0.046,表4)。在CHD伴高血压患者中,APP甲基化水平和狭窄程度也呈正比(r=0.096,P=0.029,表4)。性别分层分析发现,在男性CHD伴高血压患者中,APP甲基化水平和狭窄程度呈正比(r=0.135,P=0.019,表 4)。
进一步的年龄分层分析发现,在年龄≥63岁的男性CHD伴高血压患者中,APP甲基化水平与狭窄程度呈正比(r=0.219,P=0.020,表5);在年龄<63岁的不吸烟或非高血压CHD患者中,APP甲基化水平与狭窄程度呈负相关(不吸烟,r=-0.223,P=0.008;非高血压,r=-0.216,P=0.010,表 5)。
2.5 受试者APP甲基化与临床特征之间的关系
如表6所示,在男性CHD患者中,APP甲基化水平与年龄呈正相关(r=0.163,P=0.001);在女性CHD患者中,APP甲基化水平与年龄呈负相关(r=-0.192,P=0.015)。此外,在正常对照组中,APP甲基化水平与Lp(a)水平呈正相关(r=0.108,P=0.031,表6)。在男性正常对照组中,APP甲基化水平与年龄呈负相关 (r=-0.203,P=0.001,表6);在女性正常对照组中,APP甲基化水平与ApoB、白蛋白及ALT水平呈负相关(ApoB,r=-0.160,P=0.028;白蛋白,r=-0.151,P=0.036;ALT,r=-0.163,P=0.024,表6)。
进一步的年龄分层分析发现,在年龄≥63岁的CHD患者及女性CHD患者中,APP甲基化水平与HDL水平呈正相关(总体,r=0.160,P=0.008;女性,r=0.261,P=0.012,表7)。在年龄≥63岁的女性CHD患者中,APP甲基化水平与ALP水平呈负相关(r=-0.250,P=0.040,表7)。在年龄≥63岁的正常对照组及女性正常对照组中,APP甲基化水平与ALP呈正相关(总体,r=0.223,P=0.009;女性,r=0.242,P=0.047,表7)。在年龄≥63岁的正常对照组中,APP甲基化水平与ApoB水平呈正相关(r=0.180,P=0.025,表7)。在年龄<63岁的男性CHD患者中,APP甲基化水平与年龄呈正相关(r=0.145,P=0.049,表8)。在年龄<63岁的正常对照组中,APP甲基化水平与年龄、白蛋白水平呈负相关(年龄,r=-0.124,P=0.038;白蛋白,r=-0.134,P=0.030,表8),与Lp(a)水平呈正相关(r=0.127,P=0.046,表8)。在年龄<63岁的女性正常对照组中,APP甲基化水平与白蛋白水平呈负相关(r=-0.197,P=0.036,表8)。在年龄<63岁的男性正常对照组中,APP甲基化水平与ALP水平呈负相关(r=-0.061,P=0.042,表 8)。
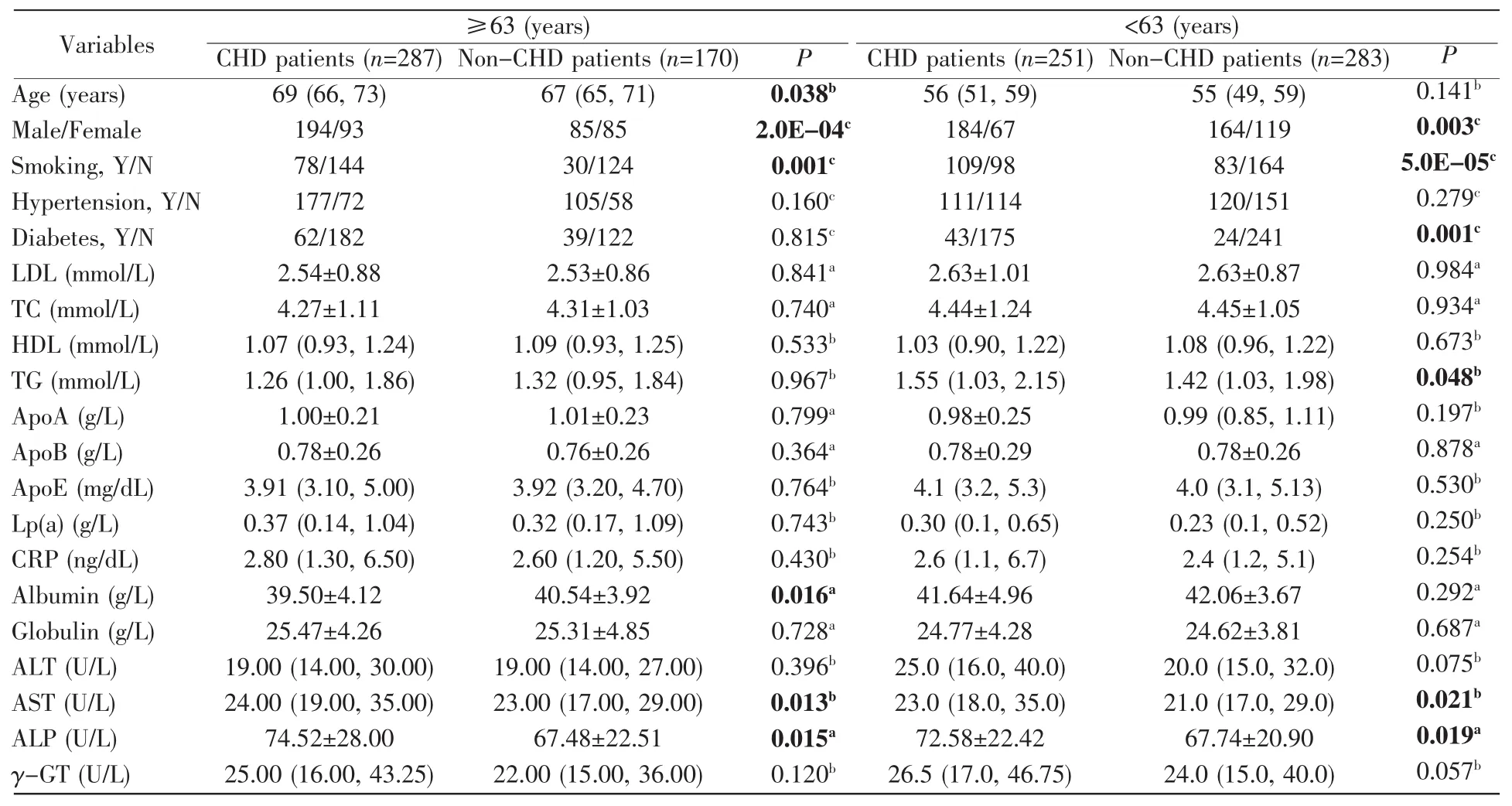
表2 根据CHD进行血管造影研究的人群的基线特征(按年龄分层)Table 2 Baseline characteristics of the population undergoing angiographic study according to CHD(age stratification)

表3 CHD患者与正常对照的APP甲基化差异Table 3 The difference of APP methylation between CHD patients and normal controls
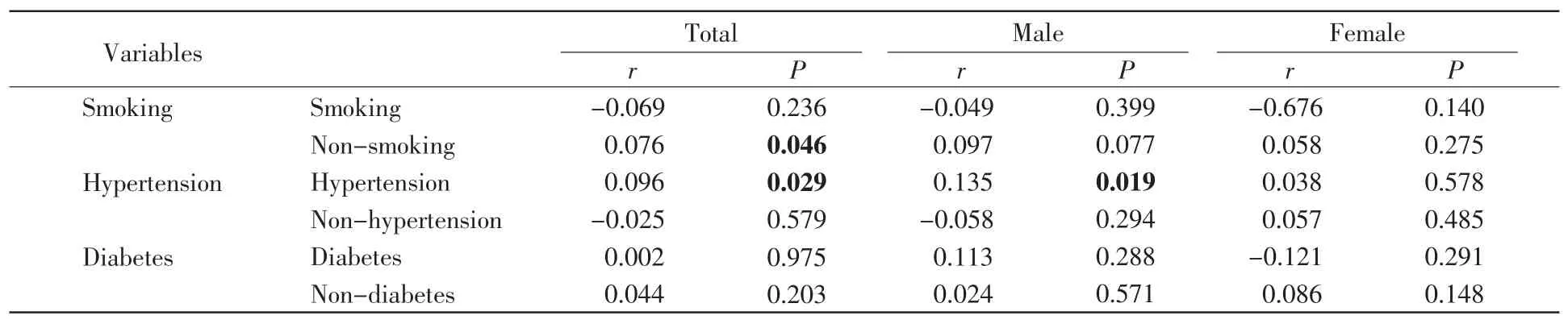
表4 CHD患者APP甲基化与冠状动脉狭窄积分的相关性Table 4 Correlation between APP methylation and stenosis score in CHD patients
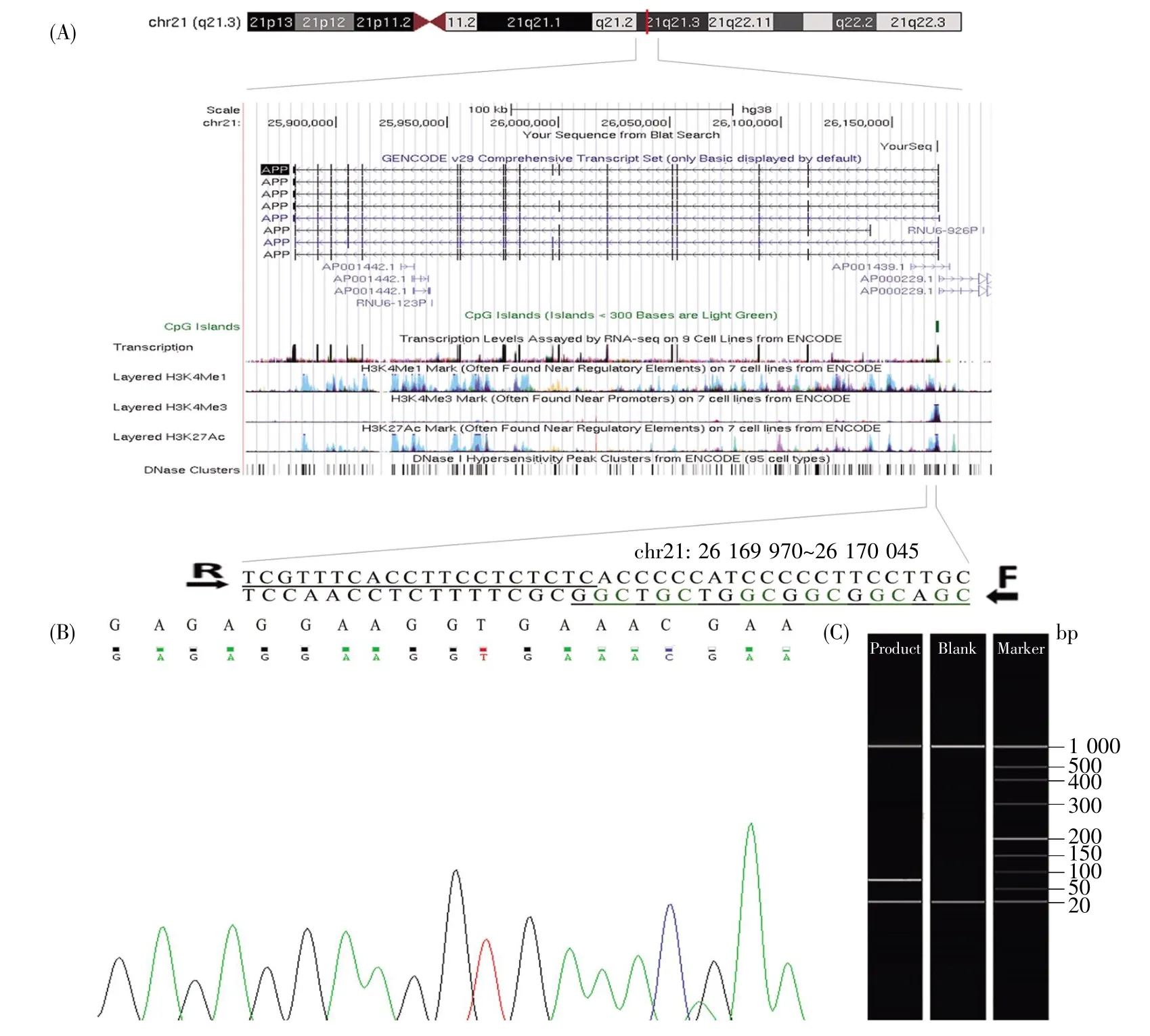
图1 APP启动子CpG岛的引物及目标扩增序列(A)目标序列定位及功能注释。根据人类2013(GRCh38/hg38)装配,来自UCSC基因组浏览器。目标序列位于APP的CpG岛区域,引物用下划线标示,F和R分别为正向引物和反向引物。图中淡蓝色代表HUVEC细胞系,紫色代表NHEK细胞系,绿色代表HSMM细胞系,红色代表GM12878细胞系,橘黄代表H1-hESC细胞系,粉红色代表NHLF细胞系,深蓝色代表K562细胞系。6个CpG位点为绿色;(B)部分Sanger测序结果;(C)毛细管电泳扩增片段结果。Fig.1 The target sequence and primers in APP promoter CpG island region(A)The location and functional annotation of the target sequence from the University of California Santa Cruz genome browser based on human 2013(GRCh38/hg38).The target sequence is located in the CpG island region of APP,and the primers are underlined and six CpG sites are in green.F and R are forward and reverse primers,respectively.Light blue represents HUVEC cell line,purple represents NHEK cell line,green represents HSMM cell line,red represents GM12878 cell line,orange represents H1-hESC cell line,pink represents NHLF cell line,and dark blue represents K562 cell line;(B)Sanger sequencing of the converted DNA;(C)The size verification of the amplified product by capillary electrophoresis.
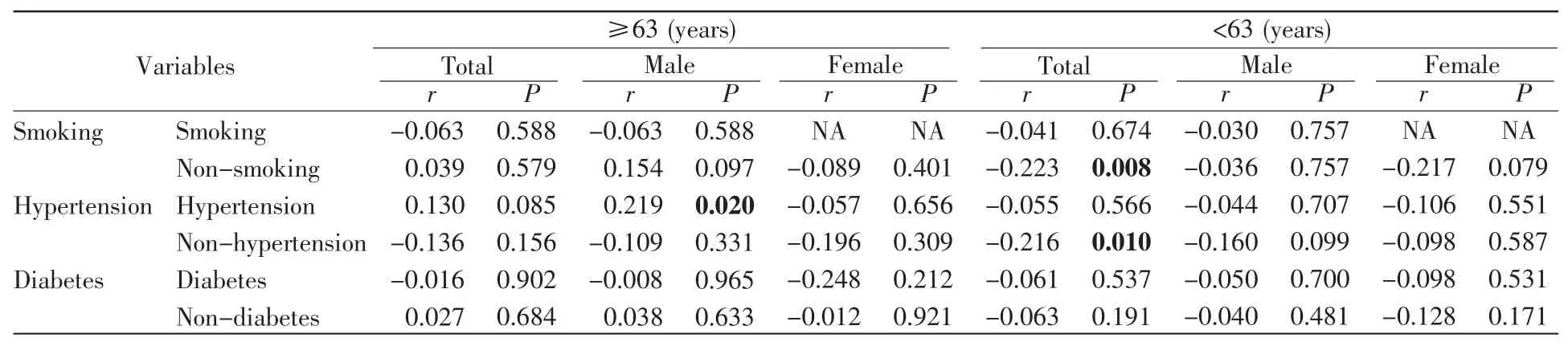
表5 CHD患者APP甲基化与冠状动脉狭窄积分的相关性(按年龄分层)Table 5 Correlation between APP methylation and stenosis score in CHD patients(age stratification)
3 讨论
本研究发现CHD组的年龄、男性人数、吸烟及糖尿病患者人数均高于对照组;CHD组白蛋白水平显著低于对照组,而AST、ALP及γ-GT的水平在CHD组中显著高于对照组(表1)。在总体样本及男性样本中,我们均发现APP基因甲基化水平在CHD组显著高于对照组(表3)。在非吸烟CHD患者中,我们发现APP甲基化水平与狭窄程度呈正比。在总体CHD伴高血压患者及男性CHD伴高血压患者中,APP甲基化水平和狭窄程度呈正比(表4)。年龄分层分析后发现,在年龄≥63岁的男性CHD伴高血压患者中,APP甲基化水平与狭窄程度呈正比;在年龄<63岁的不吸烟或非高血压CHD患者中,APP甲基化水平与狭窄程度呈负相关(表5)。性别分层分析结果显示,在男性CHD患者中,APP甲基化水平与年龄呈正相关;在女性CHD患者中,APP甲基化水平与年龄呈负相关。此外,在男性正常对照组中,APP甲基化水平与年龄呈负相关;在女性正常对照组中,APP甲基化水平与ApoB、白蛋白及ALT水平呈负相关;在正常对照组中,APP甲基化水平与Lp(a)水平呈正相关(表 6)。
血管会随着年龄的增长而老化,表现为血管弹性下降、血液难以透过血管壁。同时,被称为斑块的脂肪沉积也会沿着动脉壁堆积,进而减缓心脏的血液流动。因此,随着年龄的增长,CHD的患病风险也会增加。Fukumoto等[12]在628名日本CHD患者中发现,年龄、男性、HbA1c、血脂异常均能增加患CHD的风险。Abbott等[13]对18 456名年龄在45~93岁的样本进行了6年的随访,结果发现677名发生CHD,并且随着年龄的增长,危险因素(如高血压等)对CHD发病的影响增加。在本研究中,我们发现CHD组的年龄均高于对照组,且在男性CHD患者中,APP甲基化水平与年龄呈正相关。年龄分层分析后发现,在年龄≥63岁的男性CHD伴高血压患者中,APP甲基化水平与狭窄程度呈正比。已有的研究表明,在血小板活化后,sAPP由α-颗粒分泌并抑制凝血因子,从而防止脑、冠状动脉和外周动脉中的血栓形成[14]。APP能在血小板中表达,且是凝血酶的抑制剂,DNA甲基化很可能通过调控APP基因的表达水平,从而影响血小板的活性,进而对CHD的发生发展过程产生影响。

表6 受试者APP甲基化与临床特征的相关性分析Table 6 Correlation analysis between APP methylation and clinical characteristics of subjects
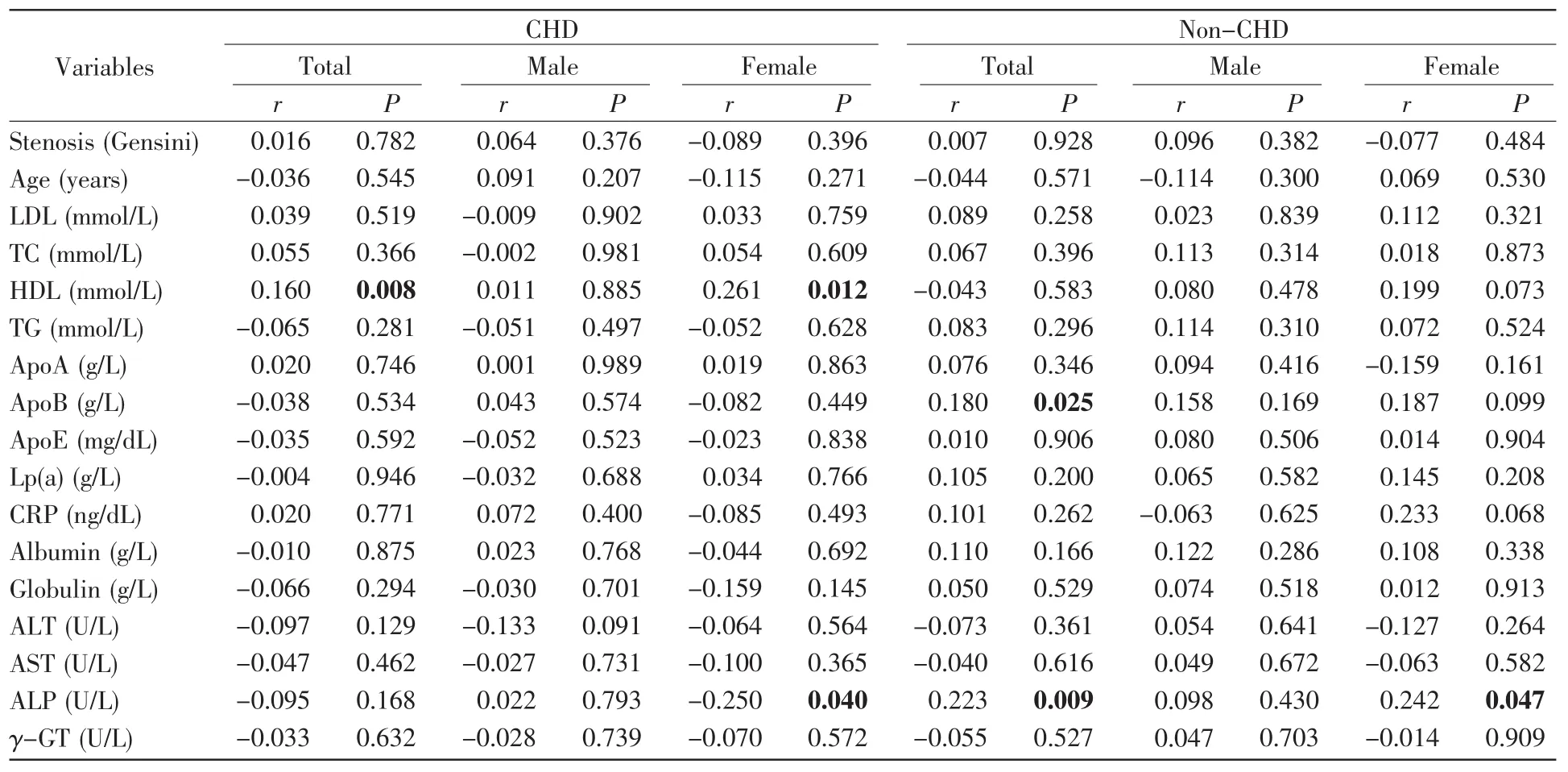
表7 年龄63岁以上受试者APP甲基化与临床特征的相关性分析Table 7 Correlation analysis between APP methylation and clinical characteristics of subjects above 63 years old
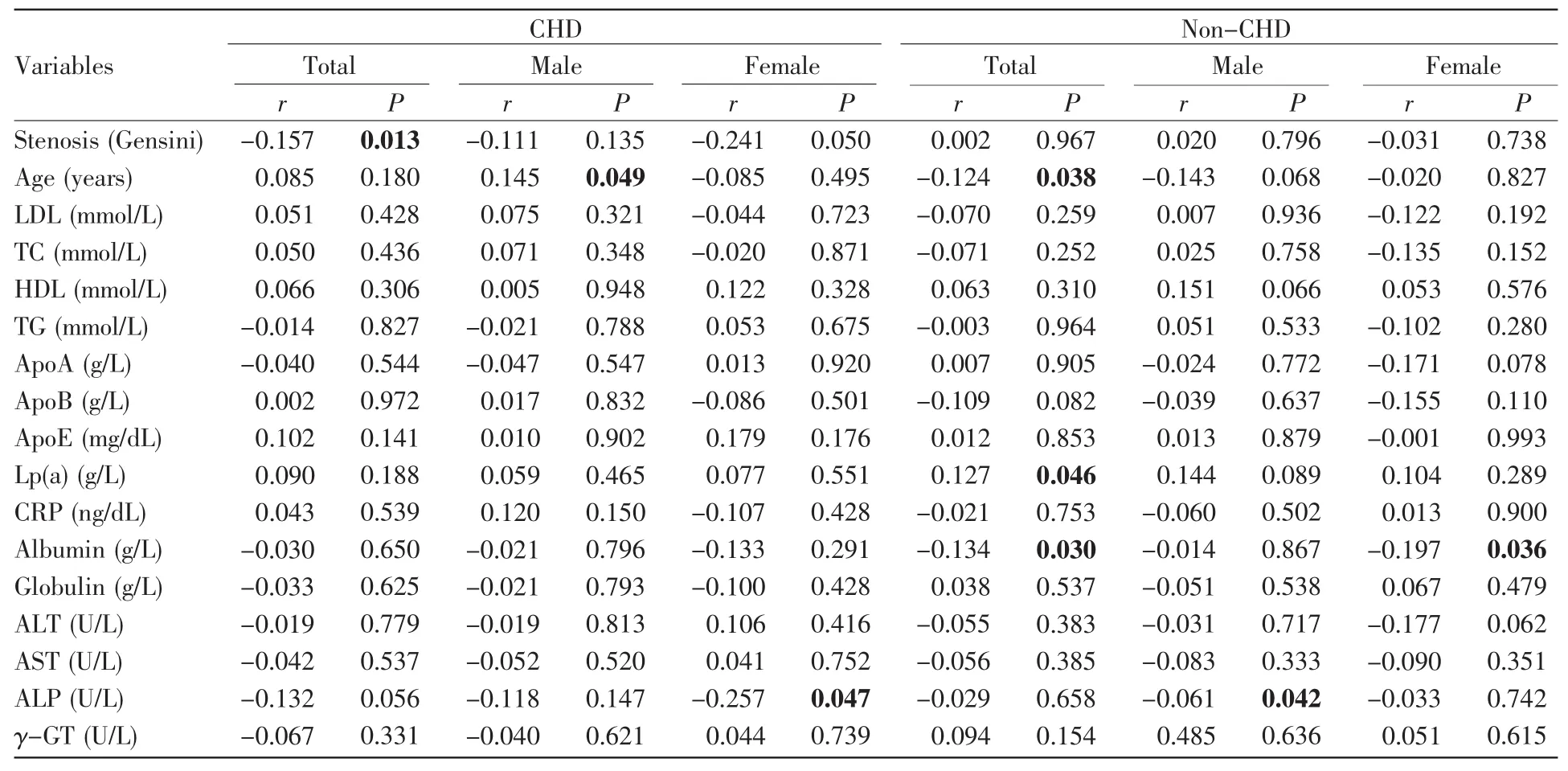
表8 年龄63岁以下受试者APP甲基化与临床特征的相关性分析Table 8 Correlation analysis between APP methylation and clinical characteristics of subjects under 63 years old
性别也是CHD患病风险的影响因素之一。近30年来,我国CHD发病率、死亡率呈上升趋势,且在不同的性别中呈现不同的发病率和死亡率,男性的患病率和死亡率明显高于女性[15]。Fukumoto等[12]在日本人群中的研究亦表明,男性患CHD的风险高于女性。另外,李威等[16]发现2010-2014年间,天津市报告的居民急性冠心病事件中,男性平均粗发病率多于女性,且男性平均发病年龄早于女性。本研究的结果表明,CHD组的男性人数高于对照组,且在总体样本及男性样本中,均发现APP基因甲基化水平在CHD组显著高于对照组。此外,在男性CHD患者中,APP甲基化水平与年龄呈正相关。两性的CHD患病风险因素及临床特征存在差异,很可能是DNA和组蛋白修饰的差异、X和Y染色体携带基因的不同、性激素等共同作用的结果[17]。由此,根据我们的结果推测,APP基因启动子甲基化水平存在性别差异是以上因素共同调节所导致的。
王广娟等[18]在山东人群中发现,冠心病组吸烟率及同型半胱氨酸血症(homocysteine,Hcy)均高于对照组,吸烟者患冠心病的风险是不吸烟者的4.832倍,高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)者患冠心病的风险是正常Hcy者的1.019倍,有HHcy且吸烟者患冠心病的风险是无HHcy且不吸烟者的2.473倍。HHcy正是高血压的一个独立风险因素[19],且能够刺激血管平滑肌细胞增殖,增强凝血功能和诱导血栓形成,促进炎症因子表达[20]。我们的研究发现CHD组的吸烟人数高于对照组,而且在总体CHD伴高血压患者及男性CHD伴高血压患者中,APP甲基化水平和狭窄程度呈正比。我们猜测,APP基因甲基化水平或许通过吸烟及HHcy水平的调节,对CHD的发病机制产生作用。
Booth等[21]在加拿大人群中发现,糖尿病患者较非糖尿病患者提前15年进入心血管疾病高风险状态。CHD合并糖尿病患者具有更高的斑块负荷、动脉粥样硬化体积和相对狭窄的冠脉血管直径[22]。和他们的研究结果一致,我们亦发现CHD组的糖尿病患者人数高于对照组。
本研究是通过qMSP技术来检测APP基因甲基化水平与CHD的相关性,从而探究CHD的发生与发展机制。qMSP技术是一种具有高度特异性、敏感性和重现性的方法,基因启动子的甲基化水平可以以百分比的形式实现,从而更精确、更容易解释高甲基化状态的识别[23]。结合高度精确的设置,qMSP技术适用于检测完全甲基化和未甲基化DNA的部分,可显示正确的甲基化和非甲基化DNA的比例[23]。同时,基于SYBR-green的PCR技术检测高甲基化基因表达的能力已被确定为诊断良性前列腺增生早期非侵袭性癌变的一个有价值的工具[24]。另外,目前关于APP基因启动子甲基化和CHD的研究国内外都很少,因此本研究具有一定的新颖性和创新性,填补了APP基因启动子甲基化与CHD关系的空白。此外,本研究收集了大量的样本,对其作用机制进行研究,在统计学上具有很好的可靠性,所得结果具有一定的指导价值。但也存在以下不足:病例组与对照组之间的年龄、性别等存在一定的差别,且未进行蛋白质表达水平的研究等。
综上所述,APP基因甲基化水平和年龄呈正相关。随着年龄的增长,APP基因的表达下降,从而导致血小板功能增强,进一步加重CHD的病程。此外,男性吸烟很可能是导致男性CHD患病年龄早于女性的原因。同以往的研究结果[25]一致,糖尿病和高血压都是CHD重要的风险因素。总的来讲,应及时开展干预措施,降低吸烟率,加大CHD预防措施的宣传,以减少该疾病的发生率。
