植物乳杆菌Lp-G18谷氨酰胺合成酶活力发酵工艺优化
2019-06-14蒋德意
徐 煜,蒋德意,韩 迪
(润盈生物工程(上海)有限公司,上海 200436)
乳杆菌是一类传统的、普遍被认为安全的益生菌,在酸乳、饮料、菌粉或泡菜中都有使用[1]。植物乳杆菌是常见的益生菌之一,具有良好的耐酸、耐胆盐能力,并具有许多益生功能,如调节肠道健康、抗氧化、抗真菌、预防便秘和腹泻、防治上呼吸道感染、抑制致病菌侵入和调节人体免疫等作用[2]。同时,植物乳杆菌还具有运动保健功能,具有缓解肌肉疲劳和损伤的能力[3]。植物乳杆菌缓解肌肉疲劳及损伤的能力与其谷氨酰胺的合成能力相关。
谷氨酰胺是一种重要的医药原料[4],具有治疗胃溃疡、缓解运动综合征和运动疲劳、调节机体免疫及增强脑神经机能等生理功能[5]。在原核生物体内,谷氨酰胺合成酶(glutamine synthetase,GS)催化谷氨酸和铵离子缩合,是谷氨酰胺形成的重要途径之一[6]。植物乳杆菌谷氨酰胺合成酶能催化谷氨酸与铵反应生成谷氨酰胺,现有的GS活力发酵技术主要针对工业合成菌棒状杆菌(Corynebacterium)[7],对可食用的益生菌,如植物乳杆菌GS的研究很少[8]。GS活力的植物乳杆菌在与运动保健相关的食品、保健品或医药原料方向均有广阔的应用潜力。
本研究对植物乳杆菌Lp-G18的GS活力发酵工艺进行研究,考察金属离子、L-谷氨酸添加、氮减少处理和碳源调整对发酵后的植物乳杆菌Lp-G18菌株GS活力的影响,为植物乳杆菌的深度开发应用及植物乳杆菌GS的进一步研究提供参考。
1 材料与方法
1.1 材料与试剂
植物乳杆菌Lp-G18,由某菌种保藏中心提供;冻干保护剂:含蔗糖50 g/L、脱脂乳粉150 g/L。
基础培养基(MRS):含葡萄糖20 g/L、蛋白胨10 g/L、牛肉浸粉10 g/L、酵母膏5 g/L、磷酸氢二钾2 g/L、柠檬酸氢二胺2 g/L、乙酸钠5 g/L、七水硫酸镁0.25 g/L、一水硫酸锰0.05 g/L、吐温-80 1 g/L。
1.2 仪器与设备
UV-2102C紫外-可见分光光度计 上海菁华科技仪器有限公司;FD8-6真空冷冻干燥机 上海颖汉化工科技有限公司;DL-5M冷冻离心机 上海卢湘仪离心机仪器有限公司;5424R离心机 德国Eppendorf公司;MB-102金属浴温控仪 杭州博日科技有限公司;JN-02C高压匀质仪 广州聚能生物科技有限公司;GS活性测定试剂盒 北京索莱宝科技有限公司;NanoDrop 2000微量分光光度计 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 菌种活化与接种发酵
将-80 ℃冷冻保藏的植物乳杆菌Lp-G18菌株接种于MRS培养基中,37 ℃培养12 h;将发酵后的菌液以2%的接种量接种于2 L MRS培养基或相应调整的培养基中,37 ℃发酵12 h,收菌;用紫外分光光度计于600 nm波长处检测菌体生长情况。
1.3.2 菌体收集及冻干菌粉制备
采用冷冻离心机对发酵液在温度4 ℃、转速7 000 r/min条件下离心10 min,离心结束后去除上清,并收集菌体沉淀,将菌体沉淀和冻干保护剂按照质量比1∶1进行重悬;将重悬均匀的乳化液于-80 ℃冰箱中冷冻4 h后,立即置于真空冷冻干燥机中,真空冷冻抽干12 h,将冻干的菌饼粉碎,即得冻干菌粉。
1.3.3 无细胞提取物制备
将1 g制备好的冻干菌粉重悬于10 mL去离子水中,4 ℃、4 000 r/min离心15 min后,去除冻干保护剂;将菌体沉淀用去离子水重悬,再次离心去除上清,同样步骤重复1 次;将洗涤后的菌体沉淀重悬于10 mL 0.05 mol/L磷酸二氢钾缓冲液(pH 6.5)中,调节高压匀质仪至压力160 MPa,将重悬好的菌液循环破菌20 次;收集菌体破碎液,12 000 r/min离心10 min,收集上清液,即为无细胞提取物。
1.3.4 GS活力分析
总蛋白浓度由A280nm测得。参考Bender等[9]的方法,使用GS活力测定试剂盒测定GS活力。按照试剂盒说明书中的测定步骤,测定540 nm波长处的吸光度(A)。ΔA=A测定管-A对照管。将每毫克蛋白在每毫升反应体系中,每分钟使540 nm波长处的吸光度变化0.01定义为1 个酶活力单位。GS活力按照下式计算。

式中:V为反应体系总体积/mL;V样为加入样本体积/mL;t为反应时间/min;Cpro为样本蛋白质质量浓度/(mg/mL)。
比活力定义为每批发酵培养基发酵的酶活力与同批基础培养基发酵的酶活力比值。
1.4 数据处理
采用Excel 2007软件进行数据分析,选择“无重复双因素分析”分析数据差异性。
2 结果与分析
2.1 植物乳杆菌Lp-G18的生长曲线

图1 植物乳杆菌Lp-G18的生长曲线Fig. 1 Growth curve of L. plantarum Lp-G18
测定植物乳杆菌Lp-G18在MRS培养基中37 ℃培养时的生长曲线。由图1可知,植物乳杆菌Lp-G18生长延滞期为5 h,培养10 h后进入生长稳定期,13 h开始进入凋亡期。
2.2 发酵时间对GS活力的影响
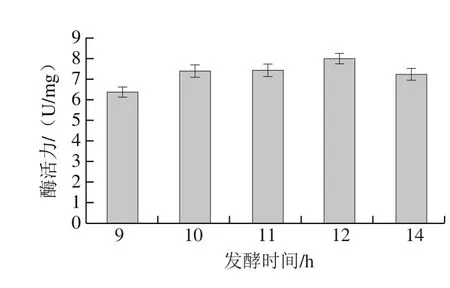
图2 植物乳杆菌Lp-G18发酵不同时间的GS活力Fig. 2 Effects of fermentation time on GS activity of L. plantarum Lp-G18 fermentation
对植物乳杆菌Lp-G18指数生长末期(9 h)、稳定期(10~12 h)及凋亡初期(14 h)的GS活力进行考察。由图2可知,稳定期GS活力可以维持较高水平,其中在稳定期末期12 h时,酶活力最高。
2.3 培养基成分对GS活力的影响
2.3.1L-谷氨酸浓度对GS活力的影响
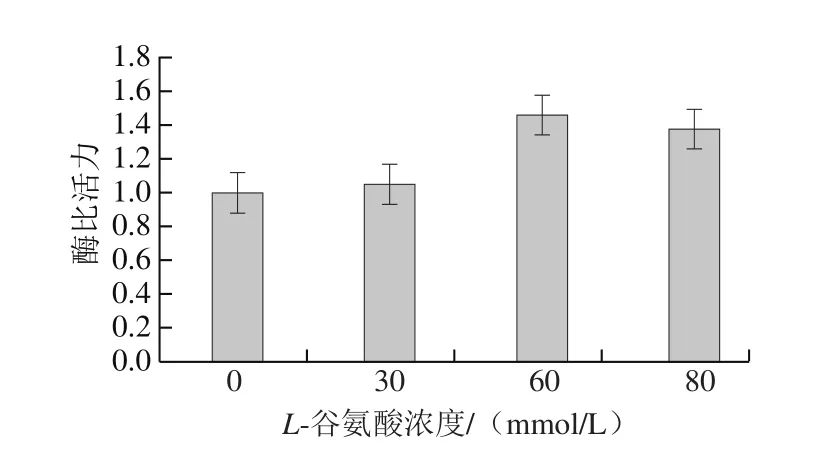
图3 L-谷氨酸浓度对植物乳杆菌Lp-G18发酵GS活力的影响Fig. 3 Effects of L-glutamic acid supplementation on GS activity of L. plantarum Lp-G18 fermentation
由图3可知,添加L-谷氨酸可以提高GS活力,当L-谷氨酸浓度为60 mmol/L时,GS活力最高,提高46%,而进一步提高培养基中L-谷氨酸的浓度,GS活力有所下降。
2.3.2 金属离子浓度对GS活力的影响
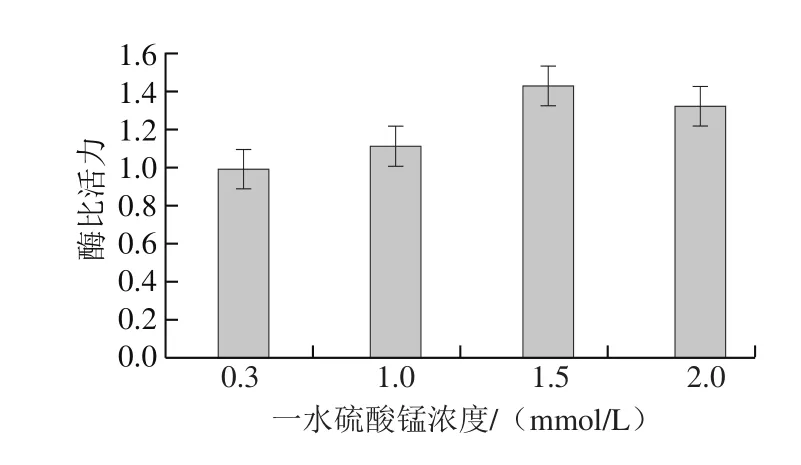
图4 一水硫酸锰浓度对植物乳杆菌Lp-G18发酵GS活力的影响Fig. 4 Effects of manganese supplementation on GS activity of L. plantarum Lp-G18 fermentation
考察基础培养基中增加Mg2+和Mn2+浓度对植物乳杆菌Lp-G18 GS活力的影响。由图4可知,发酵时增加Mn2+浓度,GS活力有所提高,当Mn2+浓度为1.5 mmol/L时,GS活力最高,提高44%。

图5 七水硫酸镁浓度对植物乳杆菌Lp-G18发酵GS活力的影响Fig. 5 Effects of magnesium supplementation on GS activity ofL. plantarum Lp-G18 fermentation
由图5可知,当Mg2+浓度为20~50 mmol/L时,GS活力有不同程度的提高,当Mg2+浓度为20 mmol/L时GS活力最高,提高43%,继续增加Mg2+浓度,GS活力开始下降。
2.3.3 碳源浓度对GS活力的影响
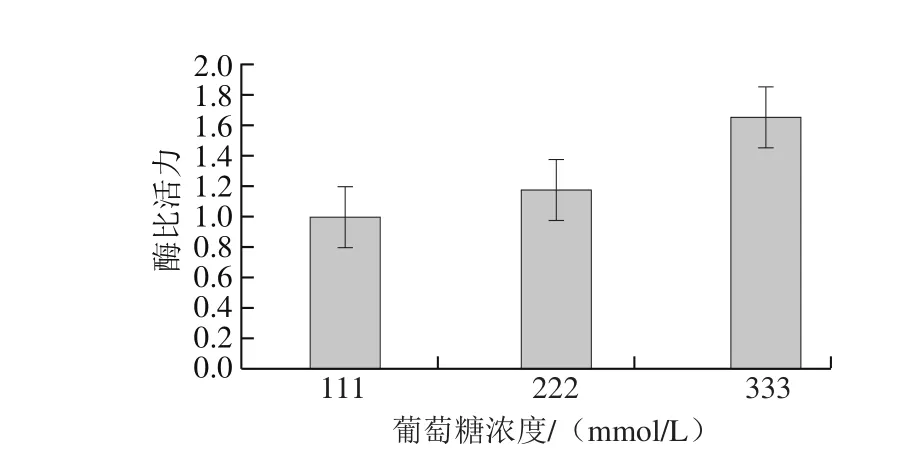
图6 葡萄糖浓度对植物乳杆菌Lp-G18发酵GS活力的影响Fig. 6 Effects of glucose supplementation on GS activity ofL. plantarum Lp-G18 fermentation
由图6可知,葡萄糖浓度提高,GS活力也提高,当葡萄萄糖浓度为333 mmol/L时,GS活力最高,提高65%。
2.3.4 柠檬酸氢二铵浓度对GS活力的影响

图7 柠檬酸氢二铵浓度对植物乳杆菌Lp-G18发酵GS活力的影响Fig. 7 Effects of diammonium citrate supplementation on GS activity of L. plantarum Lp-G18 fermentation
由图7可知,当基础培养基中的柠檬酸氢二铵浓度从9.0 mmol/L降至4.5 mmol/L时,GS活力无明显变化,而继续将柠檬酸氢二铵浓度降至1.0 mmol/L时,GS活力略有增加,提高17%左右。
2.4 正交试验结果
上述结果表明,培养基成分中的L-谷氨酸、碳源、硫酸锰及硫酸镁浓度变化对植物乳杆菌Lp-G18 GS活力影响较大,而柠檬酸氢二铵浓度变化影响较小。为进一步优化发酵条件,对L-谷氨酸浓度、葡萄糖浓度和硫酸镁浓度3 个因素进行正交试验(表1)。由于硫酸锰在食品中的添加有限量要求,因此对培养基中硫酸锰的浓度不作优化。

表1 正交试验的因素和水平Table 1 Factors and levels of orthogonal experiments
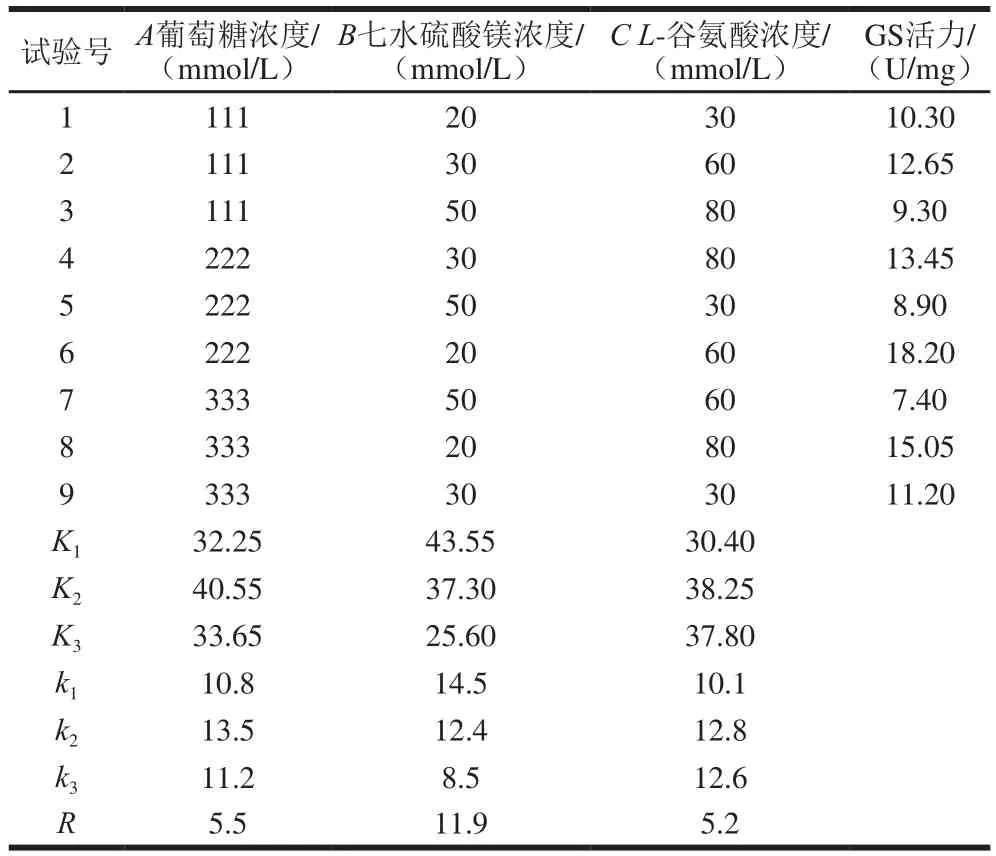
表2 正交试验结果Table 2 Results of orthogonal experiments
由表2可知,七水硫酸镁浓度的极差R最大,对GS活力的影响最大,L-谷氨酸和葡萄糖浓度的极差值相差不大,葡萄糖浓度的极差值略高,3 种因素的影响大小顺序为B>A>C。葡萄糖浓度(A)、七水硫酸镁浓度(B)和L-谷氨酸浓度(C)3 个因素水平指标测定结果的最高平均值分别为k2、k1和k2,因此最佳试验组合条件为A2B1C2。
2.5 验证实验

表3 正交试验验证结果Table 3 Veriffication of orthogonal experiments
结合正交试验结果,采用优化后的培养基:含葡萄糖40 g/L(222 mmol/L)、七水硫酸镁4.92 g/L(20 mmol/L)、一水硫酸锰0.025 g/L、L-谷氨酸8.82 g/L(60 mmol/L)、蛋白胨10 g/L、牛肉浸粉10 g/L、酵母膏5 g/L、磷酸氢二钾2 g/L、柠檬酸氢二胺2 g/L、乙酸钠5 g/L、吐温-80 1 g/L,进行验证实验,平行发酵3 次。由表3可知,优化后GS活力为(18.57±0.80) U/mg,相比于对照组的GS活力(7.61±0.36) U/mg,提高了1.4 倍左右。
3 讨 论
将培养基中的L-谷氨酸浓度继续增加至80 mmol/L时,GS活力比对照组基础培养基提高38%,但是比60 mmol/L时有所下降,表明提高L-谷氨酸浓度的确能提高GS发酵活力,但是L-谷氨酸浓度过高可能会抑制GS活力。谷氨酸棒杆菌发酵过程中,当谷氨酸浓度为50 mmol/L以下时,酶的比活力无明显提高,而谷氨酸浓度为60 mmol/L时酶活力有明显提升[9]。本研究中植物乳杆菌Lp-G18的GS活力发酵结果与之类似,当L-谷氨酸浓度为30 mmol/L时,酶活力仅提高12%。
谷氨酸促进GS活力提高的原因,推测类似于林肯链霉菌对GS活力的调节,谷氨酸对NH4+等与林肯链霉菌GS的结合有解阻遏作用,谷氨酸的添加能促使GS活力保持在较高水平[10]。谷氨酸既是GS催化的底物,也可以作为植物乳杆菌生长的碳源[7]。本研究发现,谷氨酸浓度为30~80 mmol/L时,发酵液得到的湿菌体产量比对照组培养基发酵高8%~10%左右。谷氨酸的添加同时也可以提高植物乳杆菌菌体产量。
锰离子对GS稳定性及活力的保持有重要作用。对大肠杆菌[11]和沙门氏菌[12]GS晶体结构的解析表明,GS活性中心是锰离子,同时底物和酶的复合晶体结构分析表明,Mn2+对维持酶的稳定性至关重要[13]。基础培养基中增加Mn2+浓度有利于植物乳杆菌Lp-G18 GS活力提高,推测Mn2+可能参与了植物乳杆菌GS催化反应,对酶活力及稳定起重要作用。与Mg2+浓度为2.0 mmol/L时,GS活力提高40%相比,Mn2+浓度为1.5 mmol/L时,GS活力提高44%,因此Mn2+浓度只需要添加至1.5 mmol/L,表明Mn2+除了维持GS稳定以外,还可能参与酶催化活性中心的组成,这个推测需要进一步的晶体结构解析研究支持。
Mg2+对GS稳定及活力保持也有重要作用。对头状轮生链霉菌[14]和米曲霉[15]GS活力发酵研究表明,Mg2+和Mn2+对维持酶的稳定性至关重要。推测Mg2+对植物乳杆菌GS稳定性的维持也有重要作用,进而促进GS活力的提高。对谷氨酸棒杆菌的研究表明,提高Mg2+浓度至50 mmol/L甚至更高,均有利于GS活力的提高[7],但是在植物乳杆菌Lp-G18发酵中,Mg2+浓度大于20 mmol/L时,GS活力开始下降,这表明了2 种菌GS活力的差异性。
糖源比例增加促进GS活力的提高,在耐热嗜酸古细菌[16]和谷氨酸棒杆菌[17]GS表达调控研究中均有报道。增加培养基中葡萄糖的比例能提高植物乳杆菌Lp-G18 GS活力,表明培养基中碳源和氮源比例的改变也可能调控植物乳杆菌Lp-G18 GS的表达。另一方面,增加葡萄糖的供给也可能造成植物乳杆菌Lp-G18生长中的“相对氮饥饿”状态,进而提高GS活力。
氮饥饿处理是提高GS活力的重要手段。研究表明,在初始氮源受到限制时,菌体在生长后期会出现氮饥饿状态,这种状态会使得菌体内GS活力提高[18]。由于基础培养基中原本富含氮源,降低柠檬酸氢二铵的浓度不足以造成氮饥饿状态,因此GS活力提高有限。在NH4Cl浓度较低的情况下,氯化铵对林肯链霉菌GS具有正协同作用,而NH4Cl浓度较高的情况下是负协同作用[19]。在本研究中,尝试将培养基中的柠檬酸氢二铵用1 mmol/L的氯化铵替换,结果表明,GS活力下降40%,同时湿菌体产量下降10%,表明柠檬酸氢二铵不能替换。原因可能是氯化铵替换柠檬酸氢二铵后,培养基缓冲能力及菌体代谢受到影响;此外,NH4Cl浓度为1 mmol/L仍然过高,可能对酶活力起到负调控作用。
4 结 论
添加L-谷氨酸、提高葡萄糖比例以及增加锰离子和镁离子浓度等方式均能提高植物乳杆菌Lp-G18的GS活力。通过正交试验得到发酵最优培养基组成为:葡萄糖40 g/L(222 mmol/L)、七水硫酸镁4.92 g/L(20 mmol/L)、一水硫酸锰0.025 g/L、L-谷氨酸8.82 g/L(60 mmol/L)、蛋白胨10 g/L、牛肉浸粉10 g/L、酵母膏5 g/L、磷酸氢二钾2 g/L、柠檬酸氢二胺2 g/L、乙酸钠5 g/L、吐温-80 1 g/L。采用优化培养基发酵得到的GS活力比原基础培养基培养条件下的酶活力提高了1.4 倍。本研究为高GS活力的植物乳杆菌生产发酵提供了有力支持。
