土霉素废水对斑马鱼的生物毒性效应研究
2019-06-11高问武鹏鹏王雅学沈洪艳
高问 武鹏鹏 王雅学 沈洪艳

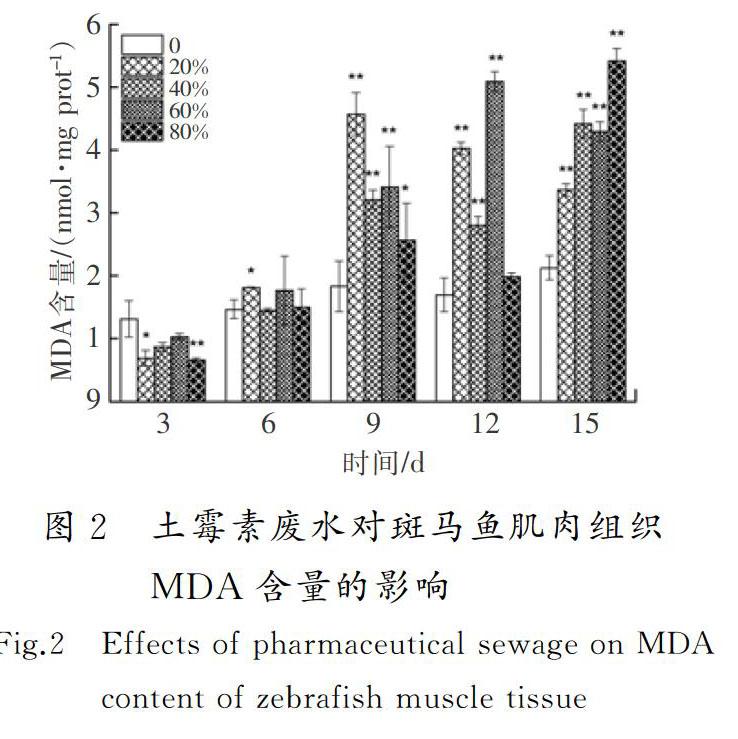
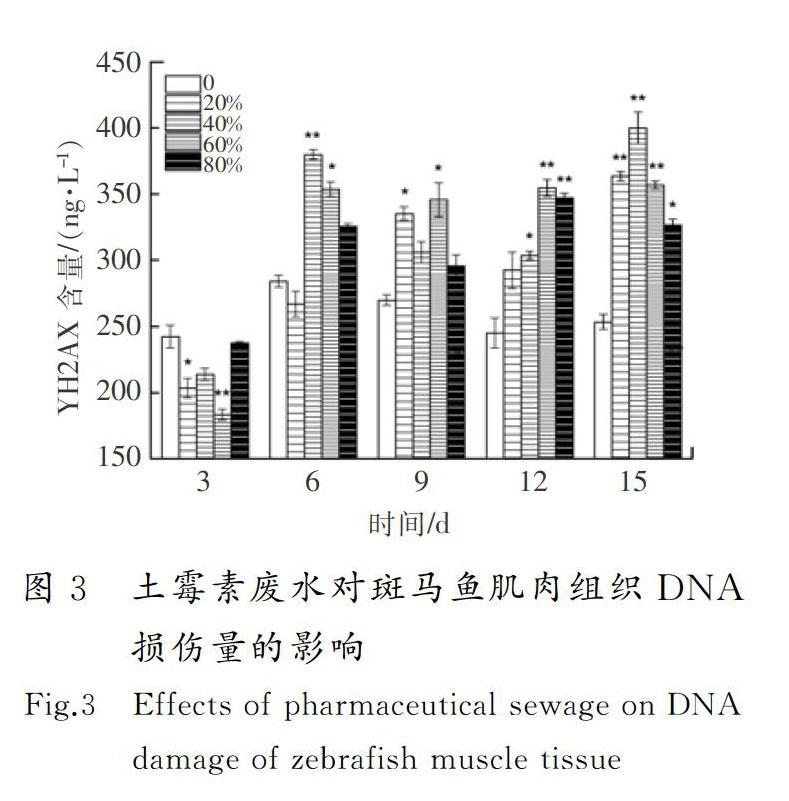
摘要:為了明确土霉素废水的生物毒性效应,采用暴露实验方法,研究了土霉素废水对斑马鱼的毒性效应。结果显示:对斑马鱼而言,土霉素废水属于低毒物质,斑马鱼暴露3~9 d时,其SOD活性和POD活性受到不同程度的抑制,12 d时受到显著诱导(0.01 关键词:环境毒理学;土霉素废水;斑马鱼;超氧化物歧化酶;丙二醛;DNA损伤 中图分类号:X503225;R994.6文献标志码:A GAO Wen,WU Pengpeng,WANG Yaxue,et al.Study of the biological toxicity of oxytetracycline wastewater on zebrafish[J].Journal of Hebei University of Science and Technology,2019,40(1):38-44.Study of the biological toxicity of oxytetracycline wastewater on zebrafish GAO Wen1,2, WU Pengpeng1,2, WANG Yaxue1,2, SHEN Hongyan1,2 (1.School of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018,China;2. Laboratory of Hebei Province for Medical Molecular Chemistry, Shijiazhuang, Hebei 050018,China) Abstract:In order to clarify the biotoxic effects of oxytetracycline wastewater, the toxicity effects of oxytetracycline wastewater on zebrafish are studied by exposure test. The results show that oxytetracycline wastewater is a low toxic substance to zebrafish. The SOD activity and POD activity of zebrafish are differently inhibited at 3~9 d. At 12 d, SOD activity and POD activity are significantly induced (0.01 Keywords:environmental toxicology; oxytetracycline wastewater; zebrafish; superoxide dismutase; malonaldehyde; DNA damage 作为一种高效药物,抗生素近年来被广泛用于治疗人和动物疾病[1]。据统计,全球抗生素的年使用量为10万~20万t,其中60%的抗生素由中国生产。中国是生产和使用抗生素的大国,土霉素产量居世界第一[2-4]。生产土霉素需经过菌种发酵和提取精制,生产过程中产生大量废水,生产1 t土霉素废水排放量平均为1.3 t[5]。根据中国环境保护方面的相关规定,抗生素类制药企业需要在厂内配备污水处理系统,生产废水经处理达标后才能排入市政管网。大部分制药厂对土霉素生产废水采用生化法处理,经此方法处理后虽然BOD,COD及氨氮等污染物可以达标排放,但其中仍有土霉素残留。据报道:美国2个污水处理厂的抗生素去除率分别为23%和72%,中国3个污水处理厂对抗生素的去除率为56%~70%[6-7],WATKINSON等[8]在澳大利亚监测的污水处理厂的抗生素质量浓度高达65 μg/L。沈洪艳等[9]采用暴露实验方法研究了不同体积比链霉素生产废水对锦鲤鱼抗氧化酶和MDA含量的影响,结果表明,处理后的链霉素废水低浓度长期暴露会对锦鲤鱼的抗氧化系统造成伤害。河北科技大学学报2019年第1期高问,等:土霉素废水对斑马鱼的生物毒性效应研究吴志刚等[10]研究了处理后的青土霉素废水对锦鲤鱼的抗氧化酶活性和MDA含量的影响,同样得到了青土霉素废水会对锦鲤鱼抗氧化系统造成伤害的结论。蔡梦婷等[11]以土霉素纯品和重金属复合为实验材料,探讨了抗生素-重金属复合暴露的水生态毒性。闻洋等[12]研究了88%盐酸土霉素纯品对斑马鱼的急性毒性及氧化应激的影响,发现该土霉素纯品为低毒物质。 目前,关于土霉素对水生生物的毒性研究主要集中在土霉素纯品,对土霉素废水的毒性效应研究相对匮乏,研究处理后的土霉素废水对斑马鱼的毒性效应具有重要的现实意义。笔者通过暴露实验,检测斑马鱼的抗氧化酶活性、MDA含量和DNA损伤,明确处理后的土霉素废水对水生生物的毒性,并为进一步研究土霉素在水环境中的生态毒性效应提供科学根据。 1材料与方法 1.1主要仪器设备 紫外可见分光光度计(UV-2550,日本岛津公司);酶标仪(SpectraMax190,美国美谷分子仪器有限公司);高速离心机(TG16-WS,湖南湘仪实验室仪器开发有限公司);水浴锅(DK-S26,上海精宏实验设备有限公司);漩涡混合器(XW-80A,上海米青科实业有限公司);高纯水蒸馏器(SYZ-A,江苏金坛市宏华仪器厂);溶解氧测定仪(JPBJ-608,上海精密科學仪器有限公司);酸度计(FE20,梅特勒-托利多仪器上海有限公司);低温冰箱(海尔BBC-226STV);分析天平(EL204,梅特勒-托利多仪器上海有限公司);水硬度计(YD300)等。 1.2水样和试剂 土霉素废水,取自某药厂污水处理厂二沉池出水。 考马斯亮兰,MDA,SOD,POD试剂盒,均从南京建成生物研究所购买;磷酸化组蛋白H2AX(γ-H2AX)试剂盒,从上海卡努生物科技有限公司购买;pH值为7.4的磷酸缓冲溶液(PBS),购买于试剂公司自行调试;0.9%生理盐水,购自河北省水利医院;冰乙酸、无水乙醇,两者均为分析纯。 1.3受试生物 选用斑马鱼(Danio rerio)为受试生物,购买于上海博舜生物科技有限公司。斑马鱼体长为(2505±040)mm,体重(0.20±0.05)g,选择同批次、规格整齐、体色光泽、鱼鳍完整舒展的斑马鱼。将斑马鱼采用5%(质量分数,下同)的食盐水进行消毒处理后送入实验室,之后放入48 h曝气的脱氯自来水中驯养1周,实验用水符合GB 11607—1989《渔业水质标准》,整个驯养过程中斑马鱼的死亡率小于5%。实验前24 h对斑马鱼停止喂食,且整个实验期间也不喂食。 1.4方法 根据《水和废水监测分析方法》中的鱼类毒性实验方法开展土霉素废水对斑马鱼的预实验[13]。在预实验中,斑马鱼暴露于100%体积浓度的土霉素废水96 h后无死亡现象。因此,预实验没有获得土霉素废水对斑马鱼的24 h绝对致死浓度(24 h LC100)和96 h的无死亡浓度(96 h LC0)。根据中国鱼类急性毒性实验的分级标准,确定土霉素废水对斑马鱼属于低毒物质,可直接进行亚急性毒性实验。 采用浸浴染毒法[14]进行亚急性毒性实验,设定20%,40%,60%,80% 4个体积浓度组和一个空白对照组,每组体积浓度设置3个平行,土霉素废水用脱氯自来水进行稀释,配成不同体积浓度的实验溶液。在5 L玻璃鱼缸中分别加入4 L实验溶液,将在实验室驯养7 d以上的斑马鱼放入各浓度组中,每组投放25尾斑马鱼,暴露15 d,每 3 d测一次生化指标。 1)实验条件 实验溶液pH值维持在7.4~7.6,水温控制在(22±1)℃,总硬度为100 mg/L;溶解氧含量不小于5 mg/L。实验期间须连续曝气,并进行遮光处理,为了保证废水的体积浓度一致,每隔24 h更换实验溶液1次;每天测定1次水温、pH值、硬度及溶解氧含量等实验溶液的基本指标。 2)样品处理 每次测试前从相应体积浓度组中取3条实验鱼,快速解剖并取肌肉组织(0.1~0.2 g),在预冷的0.86%生理盐水中进行漂洗,用滤纸拭干,准确称量待测组织质量后放入匀浆器中。用移液器按1∶9(质量体积比,g∶mL)量取预冷的0.86%的生理盐水置于匀浆器中,充分匀浆8 min,整个匀浆过程在冰水浴中进行。待组织匀浆充分研碎后,用高速冷冻离心机以3 000 r/min的转速离心10 min,取上清液待测。其中进行γ-H2AX样本处理时只需将生理盐水替换为pH值为7.4的磷酸盐缓冲溶液(PBS)。 3)测试方法 SOD采用黄嘌呤氧化酶法测定,POD采用愈创木酚比色法测定,MDA采用硫代巴比妥酸(TBA)比色法测定,γ-H2AX采用双抗体夹心法测定。 4)统计结果 统计结果采用(平均值±标准偏差)表示,用SPSS22对数据进行单因素方差分析,用最小显著差数法(LSD)对同一天内组间数据进行显著性差异分析。0.01 2结果与讨论 2.1土霉素废水对斑马鱼肌肉组织SOD活性和POD活性的影响 SOD是生物体内一种保护性酶,具有清除体内自由基、控制脂质过氧化及减轻膜氧化损伤的作用[15-16]。土霉素废水对斑马鱼肌肉组织SOD活性的影响见图1 a)。由图1 a)可以看出,第3 d时,4个体积浓度组SOD活性均受到抑制,20%和40%体积浓度组的SOD活性分别达到了实验期间的最小值(40.95 U/mg prot,37.10 U/mg prot)。这可能是由于暴露起初鱼体因外来物质的进入,斑马鱼机体用于抵抗土霉素废水胁迫而产生大量超氧阴离子自由基(O2-),过量的O2-消耗了大量的SOD,使得SOD活性降低,或者自由基抑制图1土霉素废水对斑马鱼肌肉组织SOD和POD活性的影响 Fig.1Effects of pharmaceutical sewage on SOD activity and POD activity of zebrafish muscle tissue 了机体SOD的酶活性,SOD因合成受阻导致活性降低[17]。沈洪艳等[18]在研究头孢噻肟钠对斑马鱼SOD活性、MDA含量及DNA损伤的影响中发现,实验第3 d暴露组均受到了抑制;第6 d,抑制水平有所缓解,这可能是斑马鱼机体正在适应土霉素废水的环境,并且此时斑马鱼体内其他的氧化酶(如GSH等)可能发挥着作用;第9 d,60%体积浓度组受到了显著抑制(0.01 POD是一类氧化还原酶,具有清除过氧化氢、酚类、胺类和醛类的作用。土霉素废水对斑马鱼肌肉组织的POD活性影响见图1 b)。由图1 b)可以看出,暴露第3 d,不同体积浓度组的POD活性均低于对照组,4个体积浓度组的POD活性均为极显著抑制(P<0.01),这可能是由于暴露初期土霉素废水诱导机体产生的氧自由基或在SOD酶的作用下生成过氧化氢,而POD有催化、清除过氧化氢和有机过氧化物的作用[21],从而使机体内POD及其同工酶消耗,导致POD活性降低,各组反应一致表明了鱼体POD遇到氧化胁迫就会启动反应机制。第6 d,60%体积浓度组的POD活性高于对照组,其他暴露组POD活性均低于对照组,但无显著性抑制,这可能是外源污染物随着暴露时间的延长对机体产生了轻微刺激,机体POD酶增加以清除体内的代谢产物,H2O2和O2-等分解成没有毒性的小分子物质,减轻对细胞的损伤,防止活性氧自由基启动膜脂过氧化作用来保护细胞生物膜不被破坏[22]。第9 d,4个暴露组POD活性与对照组相比均表现出轻微的抑制作用,说明机体中POD酶仍对H2O2和O2-发生着消除反应。第12 d,20%和40%体积浓度组与空白对照组相比无明显差异(P>0.05),可能是在低体积浓度暴露组中,机体能够较为正常地产生POD酶用来消除外来物质的影响;60%体积浓度组与对照组相比,受到了极显著性诱导(P<0.01),达到了实验期间的最大值(2.72 U/mg prot),这可能是由于暴露进入鱼体内的外源污染物达到了一定水平,机体需要产生更多的POD消耗底物的活性氧自由基。第15 d,各暴露组POD活性均低于空白对照组,20%,40%和80%体积浓度组出现了显著性抑制(0.01 2.2土霉素废水对斑马鱼肌肉组织MDA含量的影响(图2) MDA是生物膜中的不饱和脂肪酸在自由基作用下生成的一种脂质过氧化代谢产物[25]。由图2可以看出,第3 d,与对照组相比,暴露组的MDA含量受到不同程度的抑制作用,这可能是因为鱼体内抗氧化防御系统成分(SOD,POD,GSH,GST)的参与,较大限度地降低了机体活性氧浓度。第6 d,暴露组MDA含量与对照组相比,无显著差异(P>0.05)。第9~15 d,与相应对照组相比,暴露组MDA含量均出现极显著性诱导(P<0.01),暴露組MDA含量均有很大程度的升高。这可能是由于土霉素废水已经进入斑马鱼肌肉组织内,造成机体内产生大量的活性氧自由基,发生脂质过氧化产生脂质过氧化产物[26]。第9 d,20%体积浓度组达到最大值(4.57 nmol/mg prot)。第12 d,60%体积浓度组达到实验最大值(5.09 nmol/mg prot)。冯涛等[27]也发现苯并(a)芘对大弹涂鱼肝脏的暴露时间和浓度均对MDA浓度有显著影响。第15 d,与对照组相比,各暴露组同样受到极显著性诱导(P<0.01),并且80%体积浓度组达到实验最大值(5.41 nmol/mg prot),这说明鱼体内抗氧化系统已经遭受到较大程度的损伤,使得氧自由基增多,与不饱和脂肪酸结合引起脂质过氧化过程,MDA含量增多却得不到消解,最终导致膜系统严重受损。沈洪艳等[28]也发现高浓度的链霉素废水对斑马鱼产生了严重的氧化损伤。整体来看,各暴露组在不同时间段MDA含量整体呈“Λ”型变化趋势。 2.3土霉素废水对斑马鱼肌肉组织中DNA的损伤 人们普遍认为DNA双链断裂(double stranded breaks,DSBs)是最严重的DNA损伤,无论何种因素造成DSBs,H2AX都会被诱导磷酸化为γ-H2AX与簇集[29],因此γ-H2AX含量可以成为检测细胞DNA损伤的一个特异指标。土霉素废水对斑马鱼肌肉组织γ-H2AX含量的影响见图3。由图3可以看出,第3 d,暴露组γ-H2AX含量均低于对照组,说明在暴露初期土霉素废水就已经对斑马鱼肌肉组织(SOD活性、MDA含量)产生了一定的机体损伤,正常的H2AX磷酸化(γ-H2AX)并未及时形成,导致γ-H2AX含量降低[30]。第6 d,除了20%体积浓度组低于对照组外,其他暴露组γ-H2AX含量均大于对照组,并且40%体积浓度组受到极显著性差异(P<0.01),60%体积浓度组受到显著性差异(0.01 2.4指标关系分析 system index机体抗氧化系统指标机理见图4。当机体受到外来污染物攻击时,会发生应激反应,产生大量活性氧自由基,活性氧就有可能对DNA造成损伤或脂质过氧化产生新的氧化自由基醛基(MDA)对机体造成伤害。SOD和POD属于抗氧化酶,当机体活性氧自由基过多时,为了避免机体损伤,活性氧自由基可以被SOD催化发生歧化反应生成过氧化物。过氧化物(如H2O2)对机体同样具有一定伤害,又会被POD及其同工酶进一步分解成无伤害的小分子物质。从图1可以看出,SOD与POD各浓度组随着时间均呈“抑制—诱导—抑制”的变化趋势,因此具有一定的正相关。由于POD存在多种同工酶,所以POD的变化趋势更趋于稳定。当过量的ROS无法被SOD消除时,就会直接造成DNA损伤,DNA遭到损伤又会反过来阻碍SOD的合成。由图1 a)和图3可以看出,随着暴露时间的增加,高浓度组DNA受到了一定程度的损伤,在第12 d,80%体积浓度组的SOD活性受到极显著抑制,被认为是由于DNA损伤,阻碍了SOD合成而造成的。当SOD活性遭到抑制或由于DNA受损阻碍SOD合成时,活性氧就会脂质过氧化产生氧化自由基醛基(MDA),MDA是氧化损伤最终形成的脂质过氧化物。从图1和图2可以看出,与对照组相比,高浓度暴露组SOD与POD的活性随着暴露时间的增加主要呈现抑制作用,与此相反,暴露组MDA与其对照组相比,主要呈现出诱导作用。因此,SOD和POD与MDA具有一定的负相关,MDA含量可以间接指示机体自由基水平,并且是毒性作用和保护作用的综合反映[34]。从酶系间的变化差异而言,POD变化趋势比SOD更趋于稳定,规律性更强。但在对浓度的敏感性方面,从图1可知,SOD更优于POD,POD在浓度组间无明显变化趋势。从对机体损伤方面的指标变化差异而言,土霉素废水胁迫产生自由基水导致的DSBs修复完成后,γ-H2AX去磷酸化恢复为H2AX,MDA含量比γ-H2AX含量更为明显地指示机体自由基水平,γ-H2AX含量则能够明显反映细胞DNA的受损情况。 3结论 1) 对斑马鱼而言,处理后体积分数为20%,40%,60%和80%的土霉素废水属于低毒物质。 2) 处理后体积分数为20%,40%,60%和80%的土霉素废水对斑马鱼肌肉组织中的SOD活性、POD活性和MDA含量影响显著:前中期(3~9 d)土霉素废水对斑马鱼SOD活性和POD活性主要为抑制作用,后期(12~15 d)主要为诱导作用;土霉素废水对斑马鱼MDA含量主要表现为诱导作用,其破坏了机体的抗氧化系统,造成了一定的氧化损伤,但损伤程度在机体的防御范围之内。 3) 处理后体积分数为80%的土霉素废水,对斑马鱼肌肉组织存在较大的环境风险。 4) 处理后体积分数为20%,40%,60%和80%的土霉素废水胁迫斑马鱼产生的氧化应激反应,可能是导致DNA损伤的重要机制之一。 5) 土霉素废水成分复杂,因此需对土霉素废水的主要成分及各成分作用产生的毒性效应进行更为深入的研究。 参考文献/References: [1]郭学涛.针铁矿/腐殖酸对典型抗生素的吸附及光解机理研究[D].广州:华南理工大学,2014. GUO Xuetao.Sorption and Photolysis of Antibiotics by Geethite/Humic Acid[D]. Guangzhou: South China University of Technology, 2014. [2]XU Weihai, ZHANG Gan, ZOU Shichun, et al. Determination of selected antibiotics in the Victoria Harbour and the Pearl River, South China using high-performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Environmental Pollution, 2006, 145(3): 672-679. [3]封例忠.青霉素废水的生化处理研究[D].沈阳:东北大学,2009. FENG Lizhong. Research on the Biochemical Treatment of Penicillin Wastewater[D]. Shenyang: Northeastern University, 2009. [4]林秀军.抗生素类制药废水生物处理性研究[D].北京:中国矿业大学,1998. LIN Xiujun. Study on Biological Treatment of Antibiotic Pharmaceutical Wastewater[D]. Beijing: China University of Mining and Technology, 1998. [5]沈洪艳,吴志刚,高吉喜,等.青土霉素废水出水对斑马鱼抗氧化指标的影响[J].河南科技大学学报:自然科学版,2013,34(3):78-82. SHEN Hongyan, WU Zhigang, GAO Jixi, et al. Effect of wastewater effluent of penicillin and oxytetracycline on antioxidant index of Danio rerio[J]. Journal of Henan University of Science and Technology:Natural Science, 2013, 34(3): 78-82. [6]BROWN K D, KULIS J, THOMSON B, et al. Occurrence of antibiotics in hospital, residential, and dairy effluent, municipal wastewater, and the Rio Grande in New Mexico[J]. Science of the Total Environment, 2006, 36(2/3): 772-783. [7]LI Bing, ZHANG Tong. Mass flows and removal of antibiotics in two municipal wastewater treatment plants[J]. Chemosphere, 2011, 83(9): 1284-1289. [8]WATKINSON A J, MURBY E J, KOLPIN D W, et al. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water[J]. Science of the Total Environment, 2008, 407(8): 2711-2723. [9]沈洪艷,武晨虹,王丽新,等.链霉素废水对锦鲤鱼抗氧化酶及MDA含量的影响[J].安全与环境工程,2013,20(6):65-68. SHEN Hongyan, WU Chenhong, WANG Lixin, et al. Impacts of streptomycin wastewater on the antioxidative enzyme activities and malondialdehyde content in cyprinus carpio[J]. Safety and Environmental Engineering,2013, 20(6): 65-68. [10]吴志刚,沈洪艳,高吉喜,等.青土霉素废水出水对锦鲤肝脏抗氧化酶活性和丙二醛含量的影响[J].江西农业大学学报,2013,35(3):587-592. WU Zhigang, SHEN Hongyan, GAO Jixi, et al. Effects of wastewater effluent of penicillin and oxytetracycline on SOD, CAT activities and MDA content in liver tissue of cyprinus carpio[J]. Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(3): 587-592. [11]蔡梦婷,侯国权,奚豪,等.典型抗生素与重金属铜复合暴露对淡水绿藻和斑马鱼的联合毒性[J].浙江树人大学学报(自然科学版),2018,18(2):11-15. CAI Mengting, HOU Guoquan, XI Hao, et al. Combined toxicity of typical antibiotics and heavy metal copper exposure to freshwater green algae and zebrafish[J]. Journal of Zhejiang Shuren University,2018, 18(2): 11-15. [12]闻洋,陈寒嫣,杨炳君,等.典型兽用抗生素对斑马鱼的急性毒性及氧化应激的影响[J].吉林师范大学学报(自然科学版),2018,39(2):94-98. WEN Yang, CHEN Hanyan, YANG Bingjun, et al. Effects of typical veterinary antibiotics on acute toxicity and oxidative stress in zebrafish[J]. Journal of Jilin Normal University (Natural Science Edition), 2018, 39(2): 94-98. [13]韩杰,叶行,许人冀.阿特拉津与氯氟菊酯联合染毒对鲫器官SOD活性的影响[J].贵州农业科学,2010,38(9):136-137. HAN Jie, YE Xing, XU Renji. Effect of atrazine and cypermethrin on superoxide dismutase activity in organs of carassius auratus[J]. Guizhou Agricultural Sciences, 2010, 38(9): 136-137. [14]邱郁春.水污染鱼类毒性实验方法[M].北京:中国环境科学出版社,1992. [15]沈洪艳,王冰,赵月,等.氧氟沙星对锦鲤抗氧化系统和DNA损伤的影响[J].环境科学与技术,2015,38(12):59-66. SHEN Hongyan, WANG Bing, ZHAO Yue, et al. Effects of ofloxacin on antioxidant system and DNA damage of Cyprinus carpio[J]. Environmental Science & Technology, 2015, 38(12): 59-66. [16]FANG Yunzhong, YANG Sheng, WU Guoyao. Free radical homeostasis[J]. Progress in Physiological Sciences, 2004, 35(4): 337-343. [17]张国霞.水体中硝基芳烃诱导鱼体氧化应激生物标志物研究[D].石家庄:河北科技大学,2012. ZHANG Guoxia. Study on Oxidative Stress Biomarker of Fish Induced by Nitroaromatic in Water[D]. Shijiazhuang: Hebei University of Science and Technology, 2012. [18]沈洪艳,焦晓会,武彤.头孢噻肟钠对斑马鱼SOD活性、MDA含量及DNA损伤的影响[J].环境科学学报,2015,35(8):2626-2632. SHEN Hongyan, JIAO Xioahui, WU Tong. Effects of cefotaxime sodium on SOD activity, MDA content and DNA damage in zebrafish[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2626-2632. [19]刘嫦娥,段昌群,王旭,等.丁草胺和乙草胺对蚯蚓CAT和SOD活性的影响[J].环境化学,2008(6):756-761. LIU Change, DUAN Changqun, WANG Xu, et al. Effects of butylchlor and ethychlor on CAT and SOD activity of earthworm[J]. Environmental Chemistry, 2008(6): 756-761. [20]王荻,李紹戊,马涛,等.诺氟沙星对两种鲟体内SOD活力影响的比较研究[J].中国畜牧兽医,2011,38(7):34-37. WANG Di, LI Shaowu, MA Tao, et al. Effect of norfloxacin on SOD activity in two species of sturgeons[J]. Chinese Animal Husbandry Veterinarian, 2011, 38(7): 34-37. [21]DUNFORD H B, STILLMAN J S. On the function and mechanism of peroxidases[J]. Coordination Chemistry Reviews, 1976, 19(2): 187-251. [22]JIA Shouju, YING Xueping, CHEN Yanle, et al. A study on isozymes changes during variant development periods of eriocheir sinensis[J]. Transaction of Oceanology and Limnology, 2004, 4: 52-60. [23]李敏,赵月,曹志会,等.链霉素废水对斑马鱼POD活性和GSH含量的影响[J].安全与环境工程,2015,22(3):1-5. LI Min, ZHAO Yue, CAO Zhuihui, et al. Impact of streptomycin wastewater on activity of peroxidae (POD) and the content glutathione (GSH) in the muscle tissues of danio rerio[J]. Safety and Environmental Engineering, 2015, 22(3): 1-5. [24]宋志慧,王庆伟.Cu2+,Cd2+,Cr6+胁迫对斑马鱼抗氧化酶活性的影响[J].安徽农业科学,2011,39(8):4739-4741. SONG Zhihui, WANG Qingwei. Effect of Cu2+, Cd2+, and Cr6+ stress on the anti-oxidative enzyme activities in danio rerio[J]. Journal of Anhui Agricultural Sciences, 2011, 39(8): 4739-4741. [25]陈瑷,周玫.自由基医学[M].北京:人民军医出版社,1991. [26]王丽新.链霉素废水诱导斑马鱼氧化应激反应与生态风险评价研究[D].石家庄:河北科技大学,2014. WANG Lixin. Oxidation Stress Response and Ecological Risk Assessment for Zebra Fish Induced by Streptomycin Wastewater[D]. Shijiazhuang: Hebei University of Science and Technology, 2014. [27]冯涛,郑微云,洪万树,等.苯并(a)对大弹涂鱼肝脏抗氧化防御系统影响的初步研究[J].海洋科学,2000(5):27-30. FENG Tao, ZHENG Weiyun, HONG Wanshu, et al. The effect of benzo (a) on the antioxidant defense system of the liver of large mudskids[J]. Marine Sciences, 2000(5): 27-30. [28]沈洪艳,王丽新,杨金迪,等.链霉素生产废水对斑马鱼肌肉组织SOD活性和MDA含量的影响[J].河北科技大学学报,2014,35(3):303-308. SHEN Hongyan, WANG Lixin, YANG Jindi, et al. Effects of streptomycin wastewater on SOD activity and MDA content in muscle tissuesof zebrafish[J]. Journal of Hebei University of Science and Technology, 2014, 35(3):303-308. [29]余艷柯,陆源,余应.γH2AX:DNA 双链断裂的标志[J].中国药理学与毒理学杂志,2005,19(3):237-240. YU Yanke, LU Yuan, YU Ying. γH2AX: A biomarker for DNA of double-stranded breaks[J]. Chinese Journal of Pharmacology and Toxicology, 2005, 19(3): 237-240. [30]HUEN M S, CHEN Junjie. Assembly of checkpoint and repair machineries at DNA damage sites[J]. Trends in Biochemical Sciences, 2010, 35(2): 101-108. [31]DANIDL R, RAMCHARAN J, ROGAKOU E, et al. Histone H2AX is phosphorylated at sites of retroviral DNA integration but is dispensable for postintegration repair[J]. Journal of Biological Chemistry, 2004, 279(44): 45810-45814. [32]NAZAROV I B, SMIRNOVA A N, KRUTILINA R I, et al. Dephosphorylation of histone γ-H2AX during repair of DNA doublestrand breaks in mammalian cells and its inhibition by calyculin A[J]. Tadiation Research, 2003, 160(3): 309-317. [33]冉茂良,高环,尹杰,等.氧化应激与DNA损伤[J].动物营养学报,2013,25(10):2238-2245. RAN Maoliang, GAO Huan, YIN Jie, et al. Oxidative stress and DNA damage[J]. Chinese Journal of Animal Nutrition, 2013, 25(10): 2238-2245. [34]LAI Yanhe, HE Binyuan, FAN Hangqing, et al. Effects of cadmium stress on the activities of antioxidant enzymes,digestive enzymes and the membrane lipid peroxidation of the mangrove mud clam Geloina coaxans (Gmelin) [J]. Acta Ecologica Sinica, 2011, 31(11): 3044-3053.
