CIP2A在不同肝病组织中表达及其协同表达基因的生物信息学分析
2019-06-04韩少山刘青光
杨 雪, 张 靖, 韩少山, 陶 杰, 孙 昊, 刘青光
(1西安交通大学第一附属医院肝胆外科, 2陕西省肿瘤医院妇瘤病院, 西安 710061)
蛋白磷酸酶2A(protein phosphatase 2A, PP2A)的癌性抑制因子(cancerous inhibitor of protein phosphatase 2A, CIP2A)在多种肿瘤的细胞增殖、凋亡、侵袭、迁移、上皮间质转化、细胞周期及抗药性等方面发挥着重要的作用[1-3]。其分子机制大多与CIP2A、PP2A和c-Myc三者相互作用有关,PP2A是重要的抑癌磷酸酶,广泛参与调节细胞能量代谢、周期、DNA复制、增殖和凋亡等进程,而CIP2A作为PP2A的内源性抑制剂,抑制PP2A对c-Myc第62位丝氨酸的磷酸化作用,稳定c-Myc蛋白[4]。c-Myc蛋白参与了肝癌的发生阶段及癌性增生过程,在癌变后持续保持高表达[5]。肝炎-肝硬化-肝癌是肝病演进的“三部曲” 。本研究采用组织芯片免疫组化染色明确CIP2A在不同肝病组织中的表达,应用权重基因共表达网络分析(WGCNA)方法,探索CIP2A基因同肝细胞肝癌差异表达基因的基因模块之间的关系,并对有关基因模块进行相关功能富集分析(GO analysis)及信号转导通路富集分析(KEGG pathway analysis),为后期深入研究CIP2A在肝细胞肝癌发生、发展中的调控机制奠定理论基础。
1 材料与方法
1.1 组织芯片与试剂肝疾病谱组织芯片购于西安艾丽娜生物科技有限公司,组织微阵列中包含60例肝癌组织及20例非肿瘤肝组织(包括5例正常肝组织,8例慢性活动性肝炎组织和7例肝硬化组织)。CIP2A多克隆抗体(购于美国Santa Crus公司),生物素标记的羊抗小鼠二抗(购于北京中杉金桥生物技术有限公司),免疫组织化学试剂盒(购于福州迈新生物公司)。
1.2 免疫组化染色及结果判定采用免疫组织化学Elivision二步法,62℃烤2 h,常规脱蜡水化,柠檬酸盐缓冲液进行抗原修复,3% H2O2封闭内源性过氧化物酶,孵加一抗免疫染色(CIP2A抗体1∶100),滴加聚合物增强剂,滴加生物素标记的羊抗小鼠二抗,滴加DAB混合染液进行显色,苏木精复染。返蓝,脱水透明,中性树胶封片。干片后送至上海芯超公司Aperio Scan Scope切片扫描仪进行扫描。CIP2A蛋白阳性染色的定量分析:在密封组织芯片号的情况下,由病理科两位病理医师观察组织芯片阳性染色情况并进行评分。具体评分标准采用半定量积分法,即对芯片上每个组织标本的阳性细胞数及阳性细胞着色强度分别进行分级计分,将两项的乘积分数确定其阳性强度。阳性细胞率为阳性细胞占计数细胞的比例:无阳性细胞或<10%观察细胞着色,计为0分;阳性细胞数10%~25%,计为1分;阳性细胞数25%~50%,计为2分;阳性细胞数50%~75%,计为3分;>75%阳性细胞率,计为4分。结合染色强度,无着色细胞计为0分;浅黄色计为1分;棕黄色计为2分;棕褐色计为3分。染色强度与阳性细胞百分比的乘积确定其阳性强度:0分为阴性,1~4分为弱阳性;5~8分为阳性;9~12分为强阳性[5]。
1.3 肝癌相关公共数据集的选取分别从TCGA(TCGA-LIHC)和GEO数据库中选取肝癌数据集(GSE9842, GSE45436和GSE62232)用于数据分析。其中,GSE9842, GSE45436和GSE62232数据集通过均一化进行整合,共得到316例肝癌组织。TCGA-LIHC(RNA-Seq检测平台数据,包括371例肝癌组织和50例非肿瘤肝组织)和GSE45436数据集(Affymetrix HU133 plus 2.0平台数据,包括95例肝癌组织和39例非肿瘤肝组织)分别包含有肝癌组织和正常组织样本,因此被用于比较不同组织中CIP2A表达水平差异。
1.4 权重基因共表达网络分析(WGCNA)及通路富集分析使用R语言对TCGA数据库肝癌数据(TCGA-LIHC,https://cancergenome.nih.gov/)进行WGCNA分析,利用全基因组表达谱数据,对肝癌组织与正常组织中的2 039差异基因筛选标准:肿瘤/正常的表达差异倍数≥2.0或≤0.5,FDR<0.05构建加权基因网络,鉴定出聚类基因模块(gene modules),制定出特定模块内的基因列表。对上述筛选的特定模块内基因,在DAVID数据库中进行GO及KEGG通路富集分析。通过对富集通路的校正后P值进行排序,校正后P<0.05的信号通路认为是潜在受影响的信号通路。
1.5 基因表达相关分析对候选基因两两之间的表达相关性,使用线性相关模型,计算Pearson相关系数(r)。其中,|r|<0.4认为两者无相关或弱相关,0.4<|r|<0.6认为两者中等以上强度相关,|r|>0.6认为两者强相关。本研究中选取|r|>0.4者作为相关基因做后续分析。
2 结果
2.1 CIP2A在肝癌中的表达HE染色后,所有的组织芯能够完整的保留于载玻片上,每一组织芯上均可见具有诊断性意义的肝脏组织结构。免疫组化染色后组织芯片上各点阵列整齐排列于载玻片上,无移位、扭曲、脱片及皱褶现象。CIP2A蛋白阳性染色定位于肿瘤细胞胞质中及核周,呈棕黄色或棕褐色颗粒状,弥漫或局灶性分布。60例肝细胞癌组织标本中49例肝癌组织中CIP2A蛋白表达阳性或强阳性,总体阳性率为81.67%,7例肝硬化组织标本中有2例间质纤维明显增生的肝组织内可见CIP2A蛋白在肝细胞胞浆中存在弱阳性表达,阳性率为28.56%,而5例正常肝脏组织,8例慢性活动性肝炎组织标本中均未见CIP2A蛋白阳性表达。肝癌组织中CIP2A阳性率表达率显著高于肝硬化组织、慢性活动性肝炎组织及正常肝组织,差异有统计学意义(P<0.05),见图1。CIP2A在晚期肝癌(Ⅲ~Ⅳ级)阳性表达率为88.89%(16/18),在早中期(Ⅰ~Ⅱ级)阳性表达率为42.86%(18/42),晚期肝癌组织中CIP2A阳性率表达率明显高于早中期肝癌组织,差异有统计学意义(P=0.05),见图2。
进一步通过比较TCGA及GSE45436数据集中肝癌组织和非肿瘤组织中CIP2A的表达水平发现,肝癌组织中CIP2A的mRNA表达水平明显高于非肿瘤组织(在两个数据集中P均<0.05),见图3。上述结果进一步证实,CIP2A在肝癌中处于高表达状态。


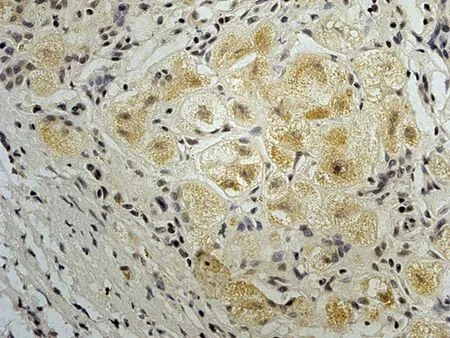
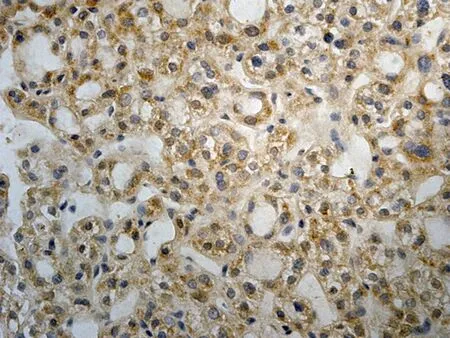
a: CIP2A蛋白在正常肝组织中呈阴性表达(76点,27岁,女性,肝组织) b: CIP2A蛋白在肝炎组织中呈阴性表达(59点,43岁,男性,慢性活动性肝炎) c: CIP2A蛋白在肝硬化组织中呈弱阳性表达(50点,56岁,男性,肝硬化) d: CIP2A蛋白在肝癌组织中呈强阳性表达(28点,62岁,男性,肝细胞癌Ⅲ级)

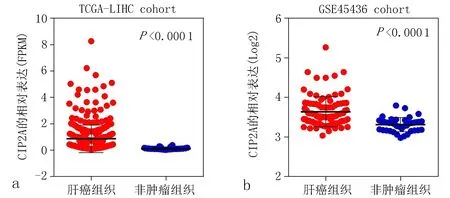
a: TCGA数据集 b: GSE45436数据集
2.2 利用WGCNA方法预测CIP2A的生物学功能为了预测CIP2A生物学功能,本研究整合了3个GSE数据集(GSE9842, GSE45436和GSE62232,共纳入316个肝癌样本)。通过对2 039个肝癌差异表达基因进行WGCNA分析,结果表明,CIP2A与MEturquoise模块中其他438个基因密切相关,见图4a。通过计算MEturquoise模块中439个基因(包括CIP2A)两两之间的Pearson相关系数,绘制出热点图。图中所示为相关性最显著的36个基因,见图4b。在MEturquoise模块中36种相关性最显著的基因中,CIP2A与其他大部分基因(31/35,88.6%)的相关系数均在0.4以上,见图4c。
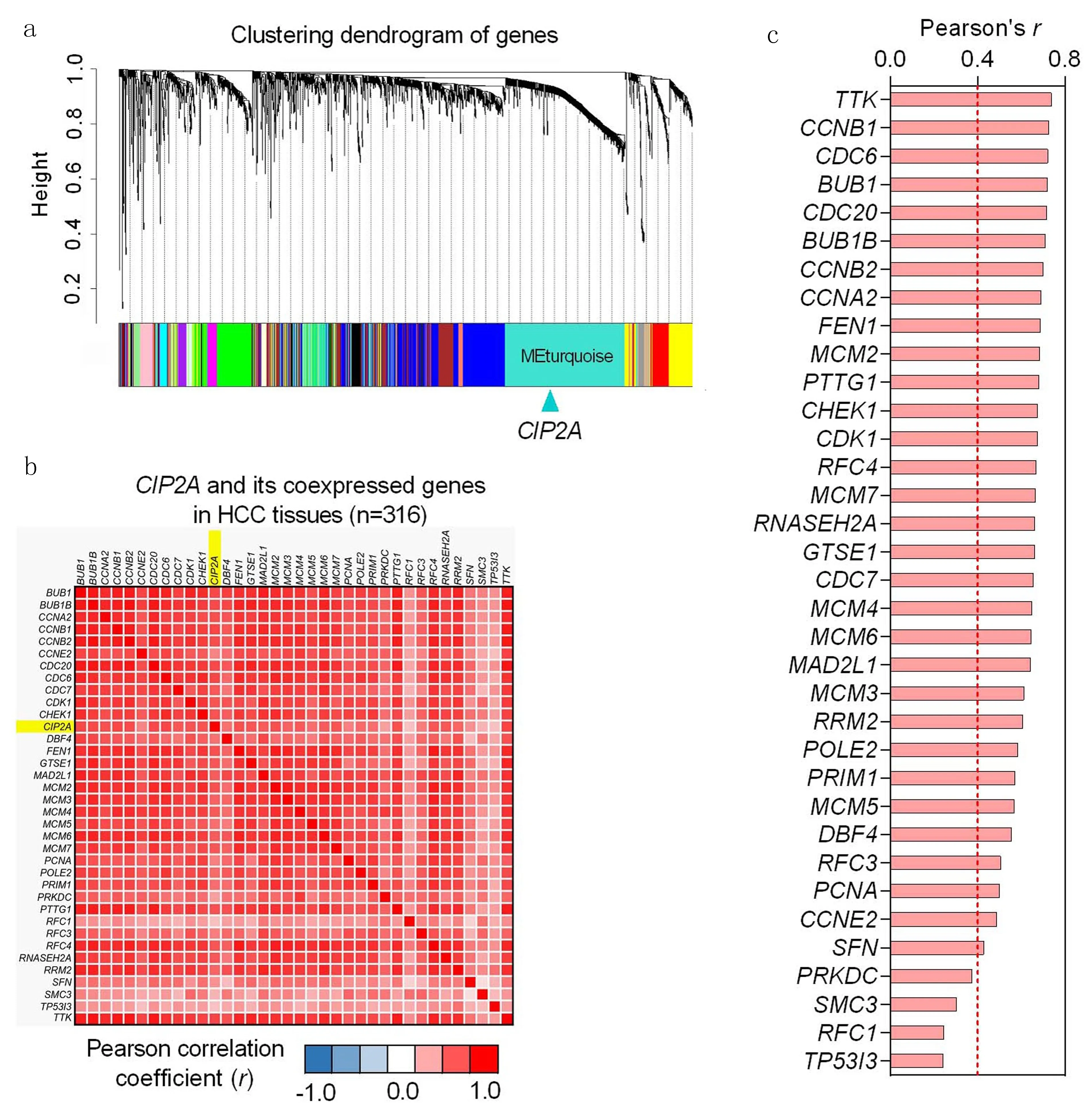
a: 2 039个肝癌差异表达基因聚类树状图; b: MEturquoise模块中439个基因(包括CIP2A)两两之间热点图; c: CIP2A与35种相关性最显著的基因之间的Pearson系数
通过对MEturquoise模块中439个基因(包括CIP2A)进行KEGG通路富集分析,结果表明,上述基因主要集中在3条信号通路,包括细胞周期(cell cycle)、DNA复制(DNA replication)以及p53信号通路(p53 signaling pathway),见图5a。GO生物学功能通路富集分析,结果表明,上述基因主要集中在15种生物学功能通路,其中大部分信号通路与细胞周期有关。包括细胞分裂(cell division)、核有丝分裂(mitotic nuclear division)、DNA复制(DNA replication)、姐妹染色单体凝聚力(sister chromatid cohesion)、G1/S有丝分裂细胞周期的转变(G1/S transition of mitotic cell cycle)、DNA复制初始调控(DNA replication initiation)、核小体组装(CENP-A containing nucleosome assembly)、姐妹染色单体分离(mitotic sister chromatid segregation)、胞质分裂(mitotic cytokinesis)、G2/M细胞周期的转变(G2/M transition of mitotic cell cycle)、有丝分裂纺锤体组装(mitotic spindle organization)、细胞周期检查点(mitotic cell cycle checkpoint)、染色体分离(chromosome segregation)、DNA解螺旋(DNA unwinding involved in DNA replication),见图5b。

a: KEGG通路富集分析; b: GO生物学功能通路富集分析
3 讨论
全球每年肝癌新发患者中50%病例在中国,而肝癌的死亡率在国内居第2位,可见针对肝癌的诊治形势十分严峻[6]。导致肝癌死亡率高的原因在于早期缺乏有效的标志物。CIP2A又被称作KIAA 1524基因或P90肿瘤相关抗原,是细胞内源性PP2A抑制因子,能够抑制PP2A对c-Myc蛋白去磷酸化作用,维持c-Myc蛋白稳定性,具有促进细胞转化及体内肿瘤生长的作用[7-8]。以往研究发现,在人类多种肿瘤组织中包括头颈部鳞状细胞癌、乳腺癌、胃肠道恶性肿瘤及白血病等均存在CIP2A高表达[9-12]。
本研究采用免疫组织化学检测了60例肝癌组织及20例非肿瘤肝组织中CIP2A蛋白的表达。结果发现,大部分病例肝癌组织中广泛表达CIP2A蛋白,总体阳性率为81.67%(49/60),且肝癌分期越晚,CIP2A蛋白阳性率越高。在5例正常肝脏组织及8例慢性活动性肝炎组织中均未见CIP2A蛋白阳性表达。7例肝硬化组织中有2例间质纤维明显增生的肝组织内可见CIP2A蛋白弱阳性表达。同时,TCGA-LIHC和GSE45436数据集也支持CIP2A在肝癌中明显高表达。在肝细胞癌发生、发展(慢性活动性肝炎—肝硬化—肝细胞癌)的过程中,CIP2A蛋白阳性表达率呈上升趋势,提示CIP2A可能在肝细胞癌发生早期存在异常激活,并在发展过程中起到促进作用。
尽管发现CIP2A在肝癌中高表达,但其如何发挥促癌作用,目前尚不清楚。因此进一步采用WGCNA方法,从2 039个肝癌组织差异表达的基因中,筛选其中与CIP2A协同表达的基因,进而预测其可能影响的信号通路。结果显示CIP2A与其中36个基因表达密切相关,其相关系数>0.4。而上述36个基因主要富集在细胞周期及有丝分裂相关信号通路。既往文献表明,在正常细胞的有丝分裂过程中,CIP2A从细胞质转移至细胞核,并在纺锤体中富集,伴随细胞的有丝分裂进程,CIP2A逐步被消耗尽。在乳腺癌中,Liu等[13]发现CIP2A可通过 PP2A/ PI3K/AKT促进细胞周期蛋白依赖性激酶抑制剂1B(cyclin- dependent kinase inhibitor 1B, CDKN1B/p27Kip1) 磷酸化,使其重定位于细胞质,同时通过 PP2A/c-Myc抑制CDKN1B转录表达,最终促进细胞周期进展。Kim等[14]发现高表达的CIP2A在有丝分裂过程中与Polo样激酶1(polo-like kinase 1, Plk1)的polo-box区域直接相互作用,通过阻断APC/C-Cdh1依赖的蛋白水解来维持Plk1的稳定性,从而增强有丝分裂期间Plk1的激酶活性,促进细胞的有丝分裂。Pallai等[15]研究发现,在前列腺癌PC-3细胞中,CIP2A的缺失会减少染色体过早分离,并降低了非整倍体的发生率;而在永生化前列腺细胞系中,CIP2A的高表达会增加染色体过早分离。上述研究均支持CIP2A在调控细胞周期及有丝分裂过程中的重要作用。结合CIP2A在肝癌中的高表达,在肝癌细胞中CIP2A可能通过调控细胞周期过程,进而发挥促癌作用。
综上所述,本研究发现CIP2A在肝癌中高表达,其促癌作用可能与细胞周期调控有关,相关信号转导通路有待进一步探索。
