PD-1/PD-L1抑制剂对比化疗一线治疗晚期非小细胞肺癌的Meta分析
2019-06-04魏瑜张莉
魏瑜,张莉
0 引言
肺癌是目前世界范围内最常见的恶性肿瘤,其中晚期非小细胞肺癌(non-smal1 cel1 lung cancer, NSCLC)约占80%~85%[1]。其中有30%~40%的晚期NSCLC患者有表皮生长因子受体(epidermal growth factor receptor, EGFR)、间变性淋巴瘤激酶(ALK)驱动基因突变,可通过小分子靶向药物治疗获益,但仍有60%~70%晚期NSCLC无EGFR/ALK驱动基因突变,只能通过化疗来控制疾病进展[2-3]。然而化疗带来的生存获益有限,有Ⅲ期临床试验表明,晚期NSCLC接受以铂类为基础的一线化疗其中位无进展生存期为4~6月,平均总生存期为10~13月[4]。因此,我们需要探索新的且有效的一线治疗方案来改善晚期NSCLC患者的生存与预后。
近年来,晚期NSCLC患者的免疫治疗成为继分子靶向治疗之后的新热点,其中以程序性死亡受体1(programmed cell death-1, PD-1)/程序性死亡配体1(programmed cell death-ligand 1,PD-L1)为靶点的免疫治疗药物如:派姆单抗(Pembrolizumab),纳武单抗(nivolumab)及阿特朱单抗(atezolizumab)已自2015年起经FDA批准用于晚期NSCLC的二线治疗,及PD-1/PD-L1表达阳性(TPS≥50%)且无EGFR、ALK等驱动基因突变的晚期NSCLC的一线治疗,并获得了良好的治疗效果[5]。但是PD-1/PD-L1抑制剂是否优于化疗一线治疗晚期NSCLC,目前国内外未见相关系统评价。本研究旨在系统评价PD-1/PD-L1抑制剂对比化疗一线治疗晚期NSCLC 的有效性及安全性,以期为临床决策提供最佳循证医学证据。
1 资料与方法
1.1 检索
联机检索Web of science、PubMed、The Cochrane Library、EMbase、CNKI和万方数据库,以及ASCO会议摘要内容、The New England Oncology、The Lancet Oncology、Journal of Clinical Oncology等杂志,从建库至2018年6月,以“Non-small cell lung cancer、Anti-PD-1、Anti-PD-L1、immunotherapy、Nivolumab、Pembrolizumab、Atezolizumab、PD-1/PD-L1抑制剂、非小细胞肺癌、免疫治疗”为检索词,以不同组合进行文献检索及手工检索,并追踪纳入文献的参考文献,收集国内外发表的关于PD-1/PD-L1抑制剂对比化疗一线治疗晚期NSCLC的临床随机对照试验(randomized controlled trials, RCTs)。语种不限,当多篇报道相同时,只评估最新文献。
1.2 纳入和排除标准
1.2.1 研究对象 (1)病理诊断为非小细胞肺癌;(2)TNM分期为ⅢB~Ⅳ期;(3)既往未接受过治疗的非小细胞肺癌患者。
1.2.2 研究类型Ⅱ~Ⅲ期随机对照试验,无论是否采用盲法。
1.2.3 干预方法(1)试验组采用PD-1/PD-L1抑制剂联合化疗,对照组为化疗;(2)试验组采用单药PD-1/PD-L1抑制剂,对照组为化疗。要求对给药的途径、剂量、周期予详细描述。
1.2.4 结局指标 (1)无进展生存期(progressionfree survival, PFS);(2)总生存期(overall survival,OS);(3)高客观有效率(overal1 response rate,ORR);(4)3~4级不良反应:按照1988年WHO抗癌药物毒副作用标准或常见不良反应事件评价标准CTCEA4.0版。
1.2.5 排除标准 (1)非临床试验及RCT研究;(2)原始文献未给出Kaplan-Meier生存曲线或数据不全,无法获得风险比(hazard ratio, HR)数据的文献;(3)研究对象及干预措施不符合纳入标准;(4)结局指标不明确的研究。
1.3 文献筛选和资料提取
2人独立筛选文献资料及结局指标包括:研究名称、发表年份、样本量、干预措施、PFS、OS及其HR与95%CI、ORR、3~4级不良反应发生例数。如有三臂研究,只提取符合纳入标准与和研究相关指标。
1.4 文献质量评价标准
采用Cochrane系统评价手册5.3对纳入研究进行质量评估,从随机对照研究、分配隐藏、参与者和研究人员的盲法、结局评价的盲法、不全性结局指标、选择性报告及其他偏倚7个方面进行评价。依据评价结果,将纳入文献分为“高风险”、“低风险”和“情况不明”[6]。
1.5 统计学方法
采用RevMan 5.3软件进行Meta分析。PFS及OS采用HR及其95%可信区间(confidence interval,CI)为效应分析统计量,二分类变量如ORR及不良反应发生率采用相对危险度(relative risk,RR)及其95%CI为效应分析统计量。文献无HR及95%CI者,按Prmar等研究者[7]推荐,K-M生存曲线或Log rank检验P值计算HR,用方差倒数法估计及合并HR及95%CI[8]。每个分析均进行异质性检验,如I2≤50%或P≥0.05,各研究间具有较好同质性,采用固定效应模型进行合并及分析;如I2>50%或P<0.05,各研究间存在异质性,采用随机效应模型分析,并对可能导致异质性的因素进行敏感度分析。定义双侧界值P<0.05为差异有统计学意义。对纳入文献的偏倚风险评价应用Stata12作Begg’s test或Egger’s test分析。
2 结果
2.1 文献检索和筛选结果
初检获356篇,剔除重复文献后余268篇,阅读题目摘要排除非随机对照试验、个案报道及综述等选出20篇,通过阅读全文,最终余7篇[9-15],见图1。
2.2 数据提取和质量评价
本研究共纳入7项RCT,7篇英文。共有晚期非小细胞肺癌4 101例,实验组,即免疫治疗组为接受PD-1/PD-L1抑制剂+化疗或单药PD-1/PD-L1抑制剂方案治疗,共2 153例;对照组,即为接受化疗或安慰剂+化疗治疗方案,共1 948例。其中4篇文献报道PD-1/PD-L1抑制剂+化疗 vs. 化疗[10,12-13,15],3篇文献报道PD-1/PD-L1抑制剂 vs. 化疗[9,11,14]。纳入文献基本特征见表1,质量评价见图2。
2.3 Meta分析结果
2.3.1 无进展生存期(PFS) 7项RCT的PFS之间存在一定异质性(P<0.00001, I2=92%),故采用随机效应模型进行荟萃分析并绘制森林图。结果显示PD-1/PD-L1抑制剂+化疗对比化疗可显著延长晚期NSCLC患者的PFS(HR=0.59, 95%CI: 0.50~0.70,P<0.00001);而单药PD-1/PD-L1抑制剂对比化疗在延长PFS方面无明显优势,两组差异无统计学意义(HR=0.87, 95%CI: 0.57~1.31, P=0.50),见图3。亚组分析显示,与化疗相比,无论PD-L1表达程度如何,PD-1/PD-L1抑制剂+化疗一线治疗晚期NSCLC患者均可显著延长PFS,见表2。且PD-L1表达程度越高,疗效获益更显著。单药PD-1/PD-L1抑制剂一线治疗PD-L1高表达(TPS≥50%)的晚期NSCLC对延长PFS未见明显优势(HR=0.77, 95%CI:0.52~1.12, P=0.17)。
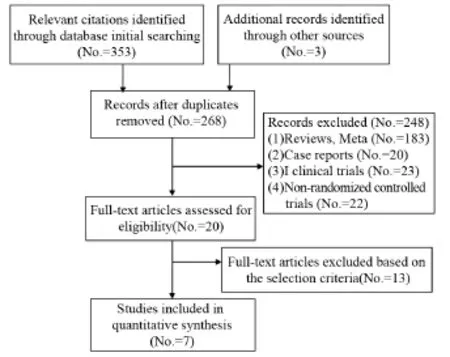
图1 文献检索及筛选流程图Figure1 Flow diagram of literature retrieval and screening
2.3.2 总生存期(OS) 7项RCT OS之间存在一定异质性(P=0.0002, I2=77%),故采用随机效应模型进行荟萃分析并绘制森林图。结果显示PD-1/PD-L1抑制剂+化疗对比化疗可显著延长晚期NSCLC患者的OS(HR=0.65, 95%CI: 0.46~0.92,P=0.02);单药PD-1/PD-L1抑制剂对比化疗在延长OS方面无明显优势,两组差异无统计学意义(HR=0.82, 95%CI: 0.65~1.03, P=0.09),见图4。亚组分析显示与化疗相比,无论PD-L1表达程度如何,PD-1/PD-L1抑制剂+化疗一线治疗晚期NSCLC患者均可显著延长OS,且PD-L1表达程度越高,疗效获益更显著,见表3。单药PD-1/PD-L1抑制剂一线治疗PD-L1高表达的(TPS≥50%)晚期NSCLC可显著延长OS(HR=0.71, 95%CI: 0.60~0.84,P<0.0001),差异有统计学意义,见表3。

图2 文献质量评价Figure2 Quality assessment of literatures

图3 试验组与对照组相比对无进展生存期(PFS)的Meta分析Figure3 Meta-analysis Results of PFS between experimental and control group
2.3.3 客观有效率(ORR) 本项研究纳入分析的7项RCT有6项研究[9-13,15]报道了ORR,各研究间存在一定异质性(P<0.00001, I2=88%),故采用随机效应模型进行荟萃分析并绘制森林图。结果显示PD-1/PD-L1抑制剂+化疗ORR是化疗的1.72倍,两组差异有统计学意义(RR=1.72, 95%CI: 1.13~2.62,P=0.01);单药PD-1/PD-L1抑制剂ORR是化疗的1.12倍,两组差异无统计学意义(RR=1.12, 95%CI:0.55~2.28, P=0.76),见图5。
2.3.4 3~4级不良反应 本文纳入的7项RCT,其中有6项报道了3~4级的不良反应事件,各研究间存在一定异质性(P<0.00001,I2=97%),故采用随机效应模型分析。结果显示PD-1/PD-L1抑制剂+化疗3~4级不良反应发生率是化疗的1.09倍,两组差异无统计学意义(HR=1.09, 95%CI: 0.99~1.20,P=0.09);单药PD-1/PD-L1抑制剂3~4级不良反应发生率是化疗的0.43倍,两组差异有统计学意义(RR=0.43, 95%CI: 0.36~0.52, P<0.00001),见图6。

表2 PD-1/PD-L1抑制剂联合化疗组和单药PD-1/PD-L1抑制剂组在不同PD-L1表达程度PFS的亚组分析Table2 Subgroup analysis of PFS of advanced NSCLC patients with different PD-L1 expression in PD-1/PD-L1 inhibitor combined with chemotherapy group and singleagent PD-1/PD-L1 inhibitor group
2.4 发表偏倚风险评估

图4 试验组与对照组相比对总生存期(OS)的Meta分析Figure4 Meta-analysis Results of OS between experimental and control groups

表3 PD-1/PD-L1抑制剂联合化疗组和单药PD-1/PD-L1抑制剂组在不同PD-L1表达程度总生存期(OS)的亚组分析Table3 Subgroup analysis of OS of advanced NSCLC patients with different PD-L1 expression in PD-1/PD-L1 inhibitor combined chemotherapy group and single-agent PD-1/PD-L1 inhibitor group
本文采用Egger回归法和Begg秩相关法评价,结果显示无明显发表偏倚(Begg’s test: P=0.764;Egger’s test: P=0.292),见图7。
3 讨论

图5 试验组与对照组相比对客观有效率(ORR)的Meta分析Figure5 Meta-analysis Results of ORR between experimental and control groups
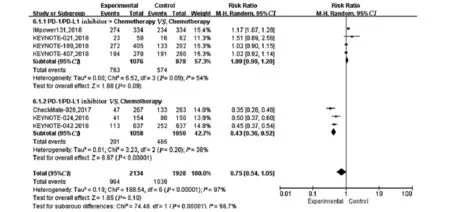
图6 试验组与对照组相比对3~4级不良反应的Meta分析Figure6 Meta-analysis Results of grade 3-4 toxicities between experimental and control groups

图7 试验组对比对照组总生存期的漏斗图Figure7 Begg's funnel plot of OS between experimental and control groups
目前晚期NSCLC一线治疗仍以化疗为主,对于EGFR敏感基因18-21位点突变的NSCLC,可以选择如表皮生长因子受体酪氨酸激酶抑制剂吉非替尼、厄洛替尼、阿法替尼等靶向药物;对于ALK融合基因阳性的NSCLC可以选择克唑替尼等。近年来,随着对信号转导通路及基因的进一步研究,免疫检查点特异性阻滞剂在晚期NSCLC的一线治疗中展现出了巨大的潜力,NSCLC的免疫治疗进入了一个新阶段[16]。PD-1和PD-L1是一对免疫抑制性因子,PD-L1是PD-1的主要配体,在很多恶性肿瘤细胞中过表达,其中包括NSCLC。PD-1和PD-L1为抑制性共刺激分子,可抑制CD4+T/CD8+T细胞的增殖和活化,负性调控机体免疫应答过程,从而促进肿瘤的逃逸、生长及转移。因此,阻断PD-Ll与PD-l的相互作用,提高免疫系统的活性,为肿瘤患者的抗癌治疗提供了一项突破性措施[17-18]。Pembrolizumab和Nivolumab是针对PD-1的完全人源化免疫球蛋白G(IgG4)拮抗剂单克隆抗体。多项研究[10-11,13-14]表明Pembrolizumab单药或联合化疗一线治疗晚期NSCLC可以改善患者的OS和ORR,FDA于2015年批准其用于治疗NSCLC。Nivolumab对比多西他赛二线治疗晚期NSCLC,展现出较高的中位生存期[19-20],而CheckMate-026[9]研究显示Nivolumab单药对比化疗一线治疗晚期NSCLC在PFS、OS方面未显示出明显优势。Atezolizumab是一种人源化抗PD-L1的免疫球蛋白G1单克隆抗体,IMpower131[15]研究结果表明Atezolizumab联合化疗对比化疗一线治疗晚期NSCLC展现出更长的PFS。为了进一步验证PD-1/PD-L1抑制剂在晚期NSCLC患者一线治疗中的作用和安全性,本研究进行了系统的荟萃分析。
本项研究共纳入7项RCT研究进行荟萃分析,与化疗相比,PD-1/PD-L1抑制剂联合化疗相对单药PD-1/PD-L1抑制剂一线治疗晚期NSCLC在延长PFS(P<0.00001)、OS(P=0.02)及提高ORR(P=0.02)方面更有优势。亚组分析显示无论PD-L1表达如何,PD-1/PD-L1抑制剂联合化疗一线治疗晚期NSCLC均可临床获益,PD-L1表达程度越高,疗效获益越显著。且为PD-L1低表达、鳞状NSCLC的患者一线治疗带来更多选择。这与KEYNOTE-407[10]、IMpower131[15]及KEYNOTE-189[13]等临床研究相一致。单药PD-1/PD-L1抑制剂对比化疗一线治疗PD-L1高表达(TPS≥50%)的晚期NSCLC可显著延长患者OS,但对延长PFS未见明显优势。这与KEYNOTE-042[14]临床研究结果相一致。由于单药PD-1/PD-L1抑制剂一线治疗晚期NSCLC研究尚少,其中仅有KEYNOTE-042一项研究针对PD-L1的不同表达程度(TPS≥1%、TPS≥50%、1%≤TPS≤49%)进行亚组分析,故而未能进行数据合并。且该研究结果显示单药PD-1/PD-L1抑制剂(Pembrolizumab)治疗可显著延长PD-L1 TPS≥1%晚期NSCLC患者OS,潜在扩大了单药PD-1/PD-L1抑制剂(Pembrolizumab)在PD-L1表达阳性晚期NSCLC患者的一线治疗地位。但由于目前样本量少,是否在大样本中仍具有生存优势,暂时还不得而知,仍需要进一步研究。
安全性方面,本研究对PD-l/PD-L1抑制剂和化疗在晚期NSCLC患者中的不良反应进行了比较。文献中提到的治疗相关不良反应主要包括皮疹、脱发、腹泻、贫血、恶心、肌痛、食欲下降、肺炎、中性粒细胞减少症。与化疗相比,PD-l/PD-L1抑制剂联合化疗对比化疗无新发不良反应,未显著增加3~4级不良反应。单药PD-1/PD-L1抑制剂对比化疗在晚期NSCLC患者的一线治疗中,就安全性方面存在优势。然而,本项研究纳入的各研究间存在一定异质性,考虑原因有以下几点:(1)肿瘤是多因素疾病,影响预后的因素较多,需长期随访,增加了临床试验的难度,影响数据的真实性。(2)各研究提供的样本含量大小不一,所得数据本身有偏差,经过荟萃分析后偏差积累更大。
综上所述,本研究肯定了PD-1/PD-L1抑制剂在一线治疗晚期NSCLC治疗中的临床获益。相对化疗,PD-1/PD-L1抑制剂联合化疗为PD-L1低表达、鳞状NSCLC患者带来的总体生存意义更大。PD-L1表达阳性的患者,不愿意接受化疗或不适合化疗及靶向治疗,可以优先选择单纯PD-1/PD-L1抑制剂作为一线治疗,且PD-L1表达越高,疗效受益越大。与化疗相比,PD-1/PD-L1抑制剂联合化疗及单纯PD-1/PD-L1抑制剂均具有良好的安全性。当然目前PD-1/PD-L1抑制剂的研究尚少,对于其有效性、安全性及适用人群,仍有待于在更长时间临床实践中继续观察监测。
