草地早熟禾NADH-GOGAT基因的克隆及表达分析
2019-05-31孙华山王玉书张学通熊良兵金一锋
陈 阳,孙华山,王玉书, 张学通,师 冉,熊良兵,金一锋*
(1. 齐齐哈尔大学生命科学与农林学院,抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006; 2. 东北农业大学园艺园林学院,黑龙江 哈尔滨 150030)
草地早熟禾(Poapratensis)作为优质的冷季型草坪草,凭借良好的坪用性状及耐寒性广泛应用于我国北方的园林绿化[1]。植物氮素利用效率与水分利用效率密切相关,两者也是节水农业的热点与难点。草地早熟禾喜肥喜水,缺氮、缺水易造成植物萎蔫,叶色发黄,病害加重。我国北方城市水资源匮乏,而且氮肥的利用率较低,氮肥的过度施加易造成经济和资源的浪费,不利于资源节约型生态社会的建设,水分及氮素营养制约着草坪业的健康发展。如何进一步实现草地早熟禾在节水条件下对氮素的高效利用,已经成为草业领域不可忽视的问题。
GS/GOGAT(Glutamine synthetase/Glutamate synthase,谷氨酰胺合成酶/谷氨酸合成酶)循环是植物氮同化的主要途径[2],植物通过对硝态氮的还原、植物衰老氮素再利用、根瘤菌固氮和氨基酸代谢等途径获得氨,将谷氨酸和氨态氮通过GS酶的催化反应生成谷氨酰胺,然后谷氨酰胺和酮戊二酸经过GOGAT酶的催化形成谷氨酸和其他氨基酸供植物利用。GS/GOGAT的同工酶活性相关研究较为深入。针对油菜(Brassicanapus)[3]研究发现,缺氮时GOGAT对子粒氮素积累、作物产量形成及作物体内氮素再利用影响很大,GS影响较小。甜菜(Betavulgaris)[4]叶片铵态氮的同化以GS2/GOGAT为主。不同基因型大豆叶片NADH-GOGAT的活性变化存在差异。目前拟南芥(Arabidopsisthaliana)[5]、水稻(Oryzasativa)[6]、大麦(Hordeumvulgare)[7]、玉米(Zeamays)[8]等多种植物的GS基因被成功克隆,且功能研究较深入。大部分GS/GOGAT循环的研究更多的关注GS在氮同化过程中的作用,而忽视了GOGAT的作用。GOGAT是连接氮无机和有机同化的纽带,在作物氮代谢中具有重要作用。GOGAT主要以2种形式作用于植物中,一种形式为Fd-GOGAT,其功能与光合作用和呼吸作用有关,主要位于质体和叶绿体中;另一类为NADH-GOGAT,参与氮类化合物的转移运输,主要位于根瘤菌、根、茎和细胞质中。水稻[9]中NADH-GOGAT有利于生长器官中转运来的谷氨酰胺的再利用。紫花苜蓿(Medicagosativa)[10]NADH-GOGAT基因在根瘤中共生固定氮同化成氨基酸过程中起主要作用。拟南芥[11]NADH-GOGAT在非光致呼吸性氨同化和谷氨酸合成中对植物发育的起重要作用,Fd-GOGAT参与氮的初级吸收与光呼吸释放氨的再吸收。目前,针对草坪草GOGAT的基因研究未有报道。本研究拟克隆得到草地早熟禾NADH-GOGAT基因,并进行生物信息学分析,包括蛋白质结构预测,同源进化分析,功能结构域分析等。通过实时荧光定量PCR分析NADH-GOGAT基因在不同组织部位,氮素调控、干旱胁迫及水氮互作中表达情况。本研究为探究草地早熟禾NADH-GOGAT基因的功能,进一步研究草地早熟禾GS/GOGAT循环的调控过程奠定基础。
1 材料与方法
1.1 植物材料
选取草地早熟禾‘午夜2号’为供试材料,购于北京克劳沃草业公司。植物总RNA提取试剂盒(DP432)购自于北京天根生化科技有限公司,PrimeScriptTMII 1st Strand cDNA Synthesis Kit、PrimeSTAR®Max DNA Polymerase、TB GreenTMPremix Ex TaqTMII均购自于TaKaRa公司,引物合成和常规测序由上海生工公司完成。
1.2 试验方法
1.2.1草地早熟禾幼苗的培养及相应胁迫的处理 研究挑选饱满的草地早熟禾种子,将其播种于盆中(营养土∶沙子=2∶1),培养4周后将健康的幼苗转移到试验田中。待幼苗高约10~12 cm时,将幼苗转移至1/2Hoagland营养液中培养,每2 d换1次营养液,培养4周后,选取长势一致的幼苗,进行胁迫处理。不同氮素浓度的处理:将1/2Hoagland营养液原有的氮源NH4NO3、Ca(NO3)2、KNO3都更换为NaNO3,设置不同氮素浓度的1/2Hoagland营养液,NN:0 mM NaNO3、LN:1.5 mM NaNO3、MN:7.5 mM NaNO3、HN:15 mM NaNO3,将幼苗根部放入营养液中,培养1周后取样。不同氮源的处理:将1/2Hoagland营养液的氮源NH4NO3、Ca(NO3)2、KNO3进行更换,配置成3种相同氮素浓度但是氮源不同的培养液:(1)单一硝态氮:NaNO3;(2)单一铵态氮:(NH4)2SO4;(3)硝态氮与铵态氮的混合:NH4NO3;氮浓度均为1.5 mM。将幼苗根部放入营养液中1周后取样。干旱胁迫:向1/2Hoagland营养液中加入不同浓度(5%,10%,15%,20%)的聚乙二醇(polyethylene glycol,PEG6000),将幼苗根部放入其中处理0 h,2 h,6 h,16 h后取样。水氮互作处理:配置10% PEG 6000 加入到含有1.5 mM NaNO3的1/2Hoagland营养液,将幼苗根部放入其中处理0h,2 h,6 h和16 h后取样,-80℃贮存。
1.2.2草地早熟禾RNA提取及cDNA的制备 草地早熟禾总RNA的提取选用植物总RNA提取试剂盒(天根)进行,用Nanodrop 2000C和2%琼脂糖凝胶电泳分别检测RNA的浓度与完整性,cDNA的合成选用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)进行。反应结束后,将cDNA,并放于-80℃长期保存备用。
1.2.3NADH-GOGAT基因克隆 草地早熟禾cDNA为模板,采用RT-PCR方法克隆获得GOGAT基因的完整ORF序列。PCR反应总体系50 μL,在PCR管依次加入25 μL PrimeSTAR Max Premix,4 μL cDNA,4 μLNADH-GOGAT-F/R,13 μL dd H2O。PCR反应程序为98℃预变性5 min,98℃变性30 s,56℃复性30 s,72℃延伸3 min,共35个循环,最后72℃再延伸10 min。PCR产物经切胶回收、转化、酶切鉴定后进行双向测序。
1.2.4NADH-GOGAT基因的生物信息学分析 利用Open Reading Frame Finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找与识别开放阅读框并翻译出氨基酸序列;利用DNAMAN软件分析蛋白的理论分子量和等电点;利用SOPMA和SWISS-MODEL软件预测蛋白二、三级结构;蛋白序列对比用Clustal W软件执行;系统进化树用MEGA 5.0 软件,邻接法绘制系统进化树;通过Pro Param进行理化性质分析。

表1 引物序列Table 1 Primer sequence
1.2.5NADH-GOGAT基因的表达模式分析 本研究的qPCR采用相对定量方法[12],EF1α为内参基因,引物见表1。反应体系为50 μL,包含25 μL TB Green Premix Ex Taq II,2 μL Q-NADH-GADPH -F/R,4 μL cDNA,17μL dd H2O。PCR反应程序为95℃预变性30 s,95℃变性5 s,60℃复性30 s,40个循环。qPCR共3次生物学重复,3次试验重复。用2-ΔΔCt法处理数据,分析NADH-GOGAT基因在组织部分及逆境胁迫下的表达水平。
1.3 数据处理
利用SPSS 13.0和Excel 2007软件进行数据处理,用GraphPad Prism 7.0软件绘图。
2 结果与分析
2.1 植物总RNA电泳及浓度检测
提取获得草地早熟禾总RNA,结果显示18S和28S有两条明显的核糖体带,说明所提RNA质量良好(图1)。用Nanodrop 2000C测定的A260/A280比值在1.8~2.0之间,提取的草地早熟禾RNA基本无酶和蛋白污染,可用于后续试验。
图1 草地早熟禾RNA琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of total RNA of Kentucky bluegrass
2.2 草地早熟禾NADH-GOGAT基因编码区克隆
本研究以反转录获得的cDNA为模板,NADH-GOGAT-F和NADH-GOGAT-R为引物进行PCR扩增,获得大约3236bp的目的基因序列(图2)。将目的序列回收,连接克隆载体,挑选阳性克隆测序。
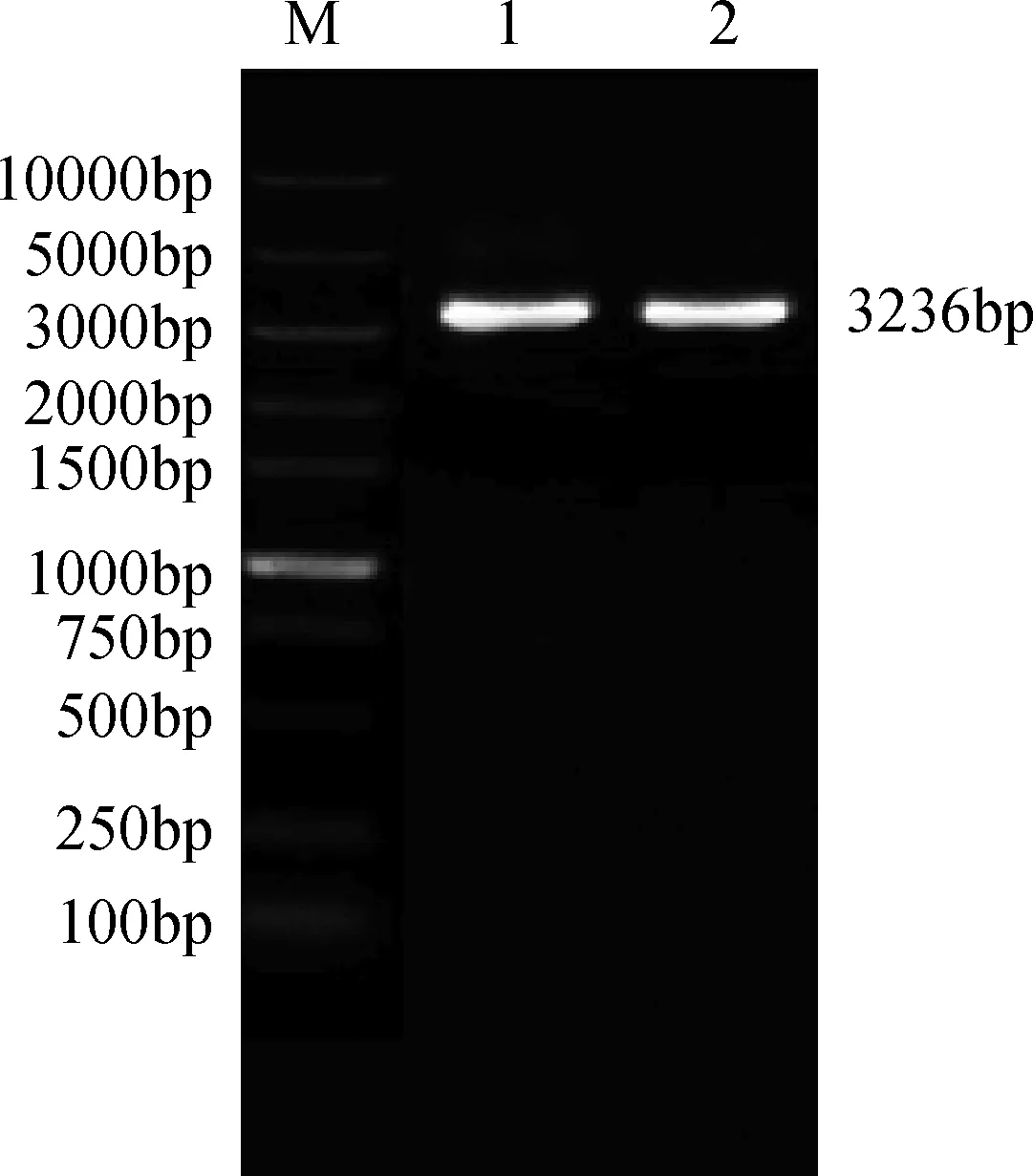
图2 NADH-GOGAT基因电泳扩增图(M为Marker 10000,1和2均为NADH-GOGAT基因)Fig.2 PCR product of NADH-GOGAT gene in Kentucky bluegrass(M:DL 10,000 DNA Marker,1 and 2:Amplification products)
2.3 NADH-GOGAT基因的生物信息学分析
2.3.1NADH-GOGAT基因编码氨基酸序列分析 利用ExPASy ProtParam软件对NADH-GOGAT基因编码的氨基酸序列进行理化性质分析。NADH-GOGAT的分子量为49.89KD,等电点(pI)为6.11,蛋白质分子式为C2223H3531N603O651S24,理论半衰期为30 h,不稳定指数27.08,脂肪指数是89.82,为稳定蛋白。NADH-GOGAT蛋白的氨基酸组成中含量较高的是亮氨酸(Leu),占11.0%。其中,表面带负电荷氨基酸残基:天冬氨酸(Asp)+谷氨酸(Glu),有62个,带正电荷的氨基酸残基:精氨酸(Arg)+赖氨酸(Lys),有56个,平均亲水系数为-0.233。
利用Signal P 4.1 Server进行信号肽预测分析,结果表明,NADH-GOGAT的平均信号肽最大值为0.179,未超过其阈值0.5,推断出该蛋白没有信号肽,属于非分泌性蛋白。预测NADH-GOGAT编码蛋白为非跨膜蛋白。亚细胞定位研究表明,NADH-GOGAT可能位于细胞质。利用Expasy-protscale软件在线分析草地早熟禾NADH-GOGAT蛋白亲水性。从整条多肽链的氨基酸预测值来看,疏水性氨基酸为178个,亲水性氨基酸为259个。由此可以推断,草地早熟禾NADH-GOGAT蛋白是一种亲水性蛋白。
2.3.3蛋白结构的预测分析 SOPMA在线预测NADH-GOGAT蛋白的二级结构,结果表明,该蛋白含有43.60%的α-螺旋、34.16%的不规则卷曲、8.54%的β-转角和13.71%的延伸链。进一步利用SWISS-MODEL在线软件对NADH-GOGAT基因编码蛋白三级结构进行建模,发现其与二级结构的预测结果一致(图3,图4)。
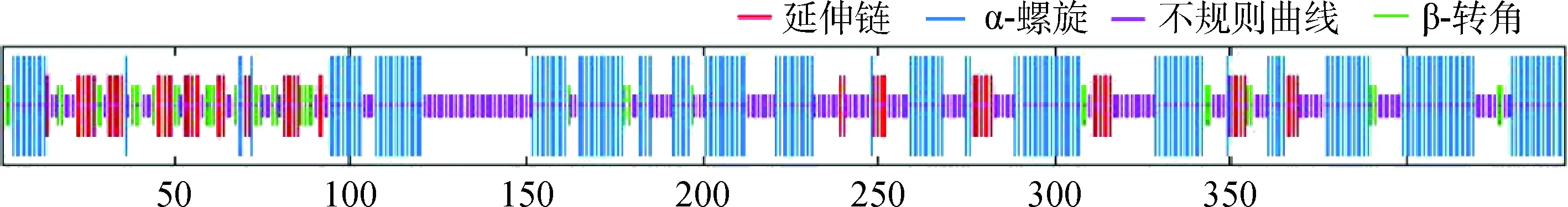
图3 NADH-GOGAT蛋白的二级结构Fig.3 Secondary structure of NADH-GOGAT protein
图4 NADH-GOGAT蛋白的三级结构Fig.4 Predicted tertiary structure of NADH-GOGAT protein
2.3.5NADH-GOGAT的同源性分析 利用NCBI
网站分析测序结果表明,该基因含有1条1338bp的完整编码区,编码1条446个氨基酸的多肽链。再通过NCBI网站进行Blast分析,表明NADH-GOGAT含有1个Glu-syn-central结构域,属于Glu-syn-central超级家族,同时还存在另一个Gn-AT-Ⅱ超级家族(图5)。利用MEGA 5软件对多个物种中NADH-GOGAT氨基酸同源比对,绘制系统发育进化树(图6)。结果发现,草地早熟禾NADH-GOGAT编码氨基酸与硬粒黑小麦(Secalecereale×Triticumturgidumsubsp.Durum)同源性最高,为97%,其次是硬质小麦(Triticumturgidum)和山羊草(Aegilopstauschiisubsp.),均为96%。

图5 NADH-GOGAT功能结构域CDD预测Fig.5 Prediction of NADH-GOGAT conserved domains
2.3 表达分析
2.3.1不同组织结构中NADH-GOGAT基因的表达分析 结果表明,NADH-GOGAT基因在草地早熟禾不同组织部位中其表达差异显著。NADH-GOGAT基因在草地早熟禾叶中的相对表达量最高,是根部的14.01倍,是茎的8.52倍(图7)。
2.3.2氮素调控中NADH-GOGAT基因的表达分析 为了更好地观察氮素调控对NADH-GOGAT基因表达水平的影响,本研究从相同氮源不同浓度和相同浓度不同氮源的角度,测定NADH-GOGAT基因的表达调控情况。图8可以看到,NADH-GOGAT基因随着氮素浓度不同,其相对表达量显著变化。NADH-GOGAT在LN组(1.5 mMNaNO3)中相对表达量最高,随着氮素浓度增加,该基因相对表达量下降,HN组(15 mM NaNO3)为最低值。
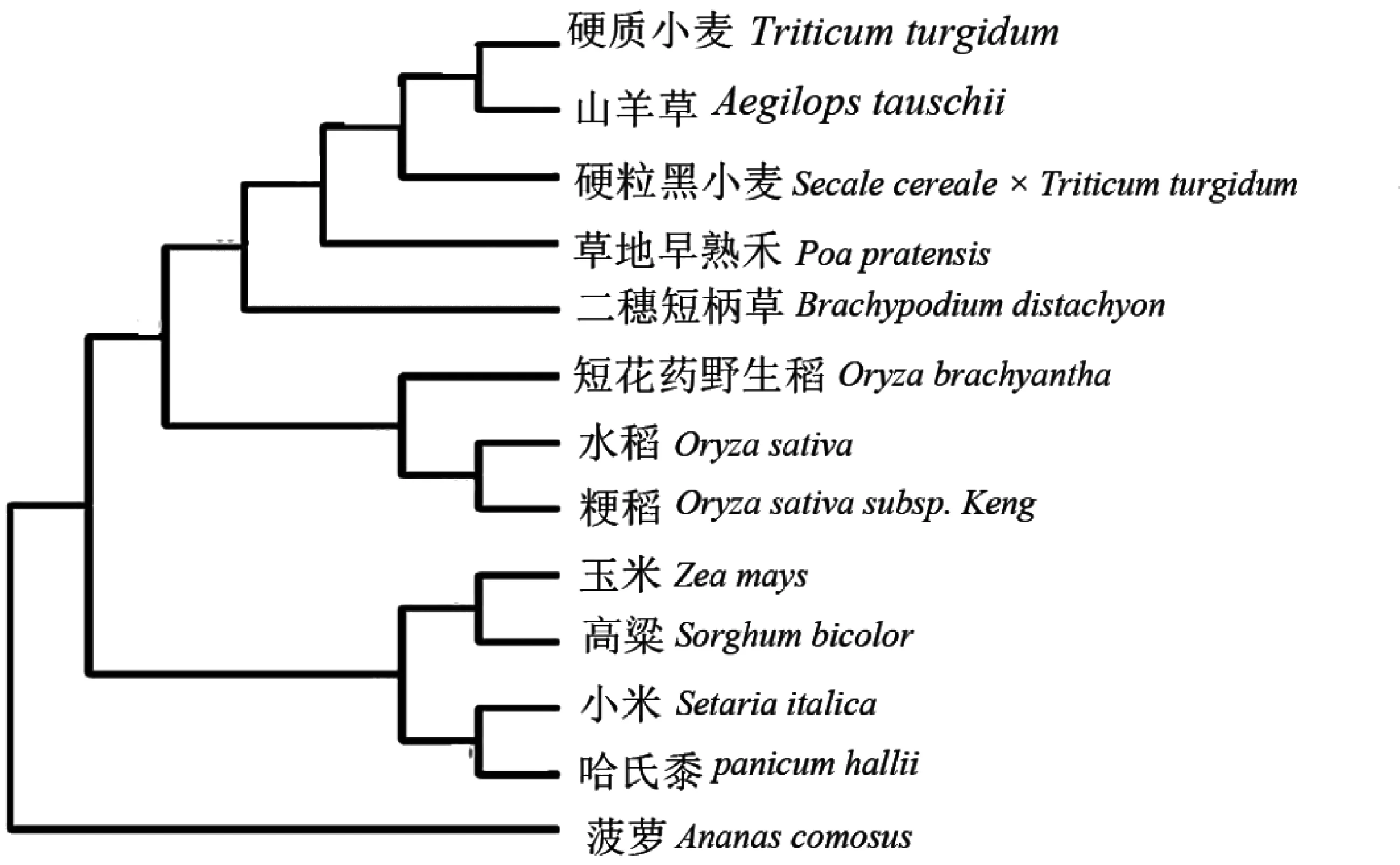
图6 NADH-GOGAT系统进化树分析Fig.6 Phylogenetic tree analysis of NADH-GOGAT
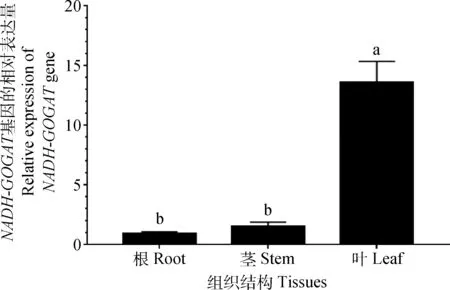
图7 不同组织部位的NADH-GOGAT基因的表达情况(P <0.05)Fig.7 Relative expression levels of NADH-GOGATgene in different tissues(P<0.05)
本研究发现,同为1.5 mM氮素浓度的不同氮源处理下,NADH-GOGAT基因表达差异显著(图8)。氮源仅为NaNO3处理时NADH-GOGAT基因相对表达量最高,其次是(NH4)2SO4处理,NH4NO3处理后的相对表达量最少。NH4NO3与(NH4)2SO4处理后的NADH-GOGAT基因差异不显著。NaNO3与NH4NO3处理后的NADH-GOGAT基因差异不显著。综合结果,低氮浓度时,硝态氮更有利于NADH-GOGAT基因的表达。
2.3.3干旱胁迫下NADH-GOGAT基因的表达分析 从图9可见,干旱胁迫影响草地早熟禾NADH-GOGAT基因的表达水平。10%PEG6000模拟干旱处理2 h时,NADH-GOGAT基因的相对表达量最高,随着干旱胁迫时间的增加,表达量迅速降低,16 h的相对表达量仅为2 h的0.25倍。5%,15%,20% PEG6000处理的样品,NADH-GOGAT基因在不同时间内的表达量均无显著差异。
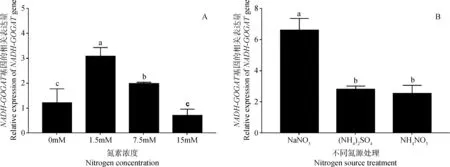
图8 氮素调控中NADH-GOGAT基因的表达水平(A:不同氮素浓度,B:不同氮源,P<0.05)Fig.8 Relative expression levels of NADH-GOGAT gene in N management(A:nitrogen content,B:nitrogen source,P<0.05)
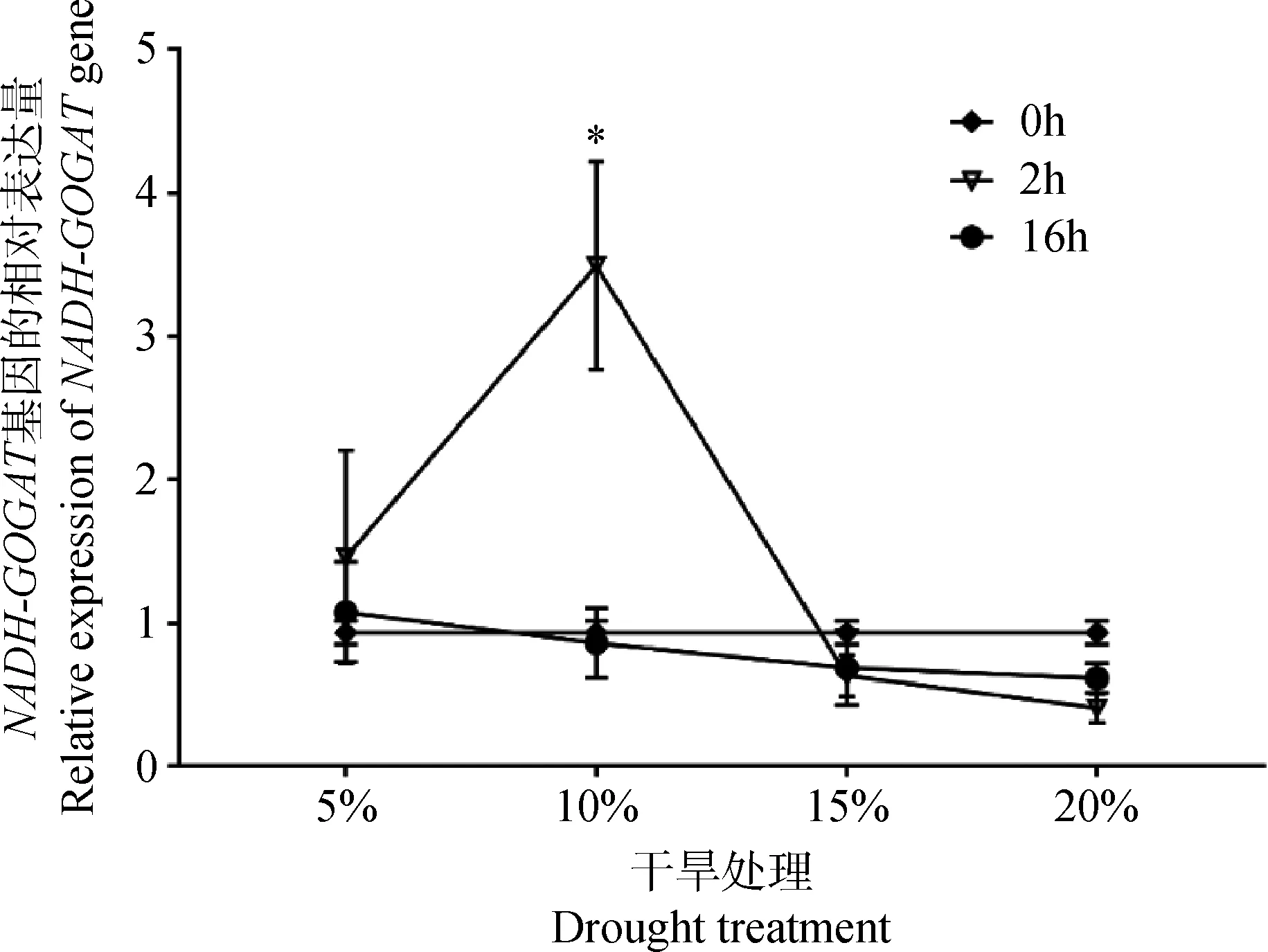
图9 干旱处理NADH-GOGAT基因的表达变化(P<0.05)Fig.9 Relative expression levels of NADH-GOGAT gene under drought treatment(P<0.05)
2.3.4水氮互作调控中NADH-GOGAT基因的表达分析 图10可见,水氮互作影响草地早熟禾NADH-GOGAT基因的表达水平。单一干旱胁迫(10% PEG6000)2 h时,NADH-GOGAT基因的表达量最高,但是水氮互作下,该基因的表达急速下降。在6 h与16 h时,均呈现水氮互作组(10%PEG6000+LN)的表达量显著低于单一干旱处理组。可见,水氮互作一定程度上抑制了NADH-GOGAT基因的表达。
3 讨论
氮素同化是植物生长发育的一个极其重要的生理过程。无机氮可以通过GS/GOGAT循环转化为L-谷氨酰胺和L-谷氨酸。植物中,谷氨酸合成酶的两种分子形式,它们在催化电子供体上不同,NADH-GOGAT (EC 1.4.1.1)和铁氧化还原蛋白(Fd)-GOGAT (EC1.4.7.1.)。这2种亚型在分子质量、动力学、组织分布和植物氮代谢功能等方面普遍存在差异[13]。GOGAT以Fd-GOGAT和NADH-GOGAT存在于高等植物中,都位于叶绿体或质体中。NADH-GOGAT主要参与氮类化合物的转移运输。Fd-GOGAT[14][在光合组织的叶绿体中表现出较高的活性。本研究首次克隆获得草地早熟禾NADH-GOGAT基因,并对其进行生物信息学分析,为后续研究其功能奠定基础。
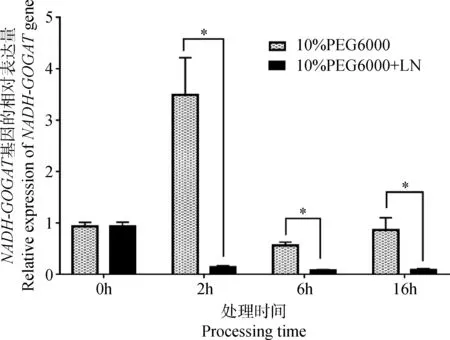
图10 水氮互作时NADH-GOGAT基因的表达变化(P<0.05)Fig.10 Relative expression levels of NADH-GOGATgene in water and nitrogen interactions (P<0.05)
苜蓿[15]NADH-GOGAT蛋白质含量的变化与从衰老器官到发育器官的氮循环率的变化有关。有研究表明水稻NADH-GOGAT基因在水稻氮利用和籽粒灌浆起到重要作用[16]。NADH-GOGAT在发育器官中起到利用与运输谷氨酰胺的作用[17]。有研究者利用QTLs方法发现水稻的NADH-GOGAT基因在叶片中作用显著[18]。大豆(Glycinemax)的叶片中NADH-GOGAT活性最高,根部最低,这些结论与本研究结果一致。但是,海岸松(PinuspinasterAit.)[19]幼苗不同组织部位的表达分析显示,NADH-GOGAT基因主要在非光合组织如根和茎中表达,叶中表达量较低。这可能是由于松树为木本植物,草地早熟禾属于草本植物,草地早熟禾的叶片占整体的部分较多,其在氮同化的作用与松树有一定差异。
甜菜叶片中GOGAT基因的表达量随施用氮素水平的增加而增加,但施氮过量反而限制该基因的表达,这与本研究结果相似,过高的氮浓度会抑制草地早熟禾NADH-GOGAT基因的表达。当15 mM NaNO3时,NADH-GOGAT基因的表达量比1.5 mM NaNO3处理时降低了77.27%。不同氮素形态处理的茶树(Camelliasinensis)GOGAT活性的年动态差异不大[20]。相同氮浓度下与铵态氮相比,硝态氮更有利于甜菜GOGAT基因的表达[4]。这与本研究结果相似,与铵态氮相比,硝态氮的处理更利于草地早熟禾NADH-GOGAT的表达。药用植物半夏(Pinelliaternata)的[21]NR、GS、GOGAT在轻度干旱和中度干旱条件下的活性高于水分充足时的活性。本研究结果与其相似,轻度干旱有利于草地早熟禾NADH-GOGAT基因的表达。葡萄(Vitisvinifera)[22]的GS和GOGAT活性随着水分胁迫的加深其活性逐渐降低。草地早熟禾是喜水喜肥的草坪草种,水分与氮素营养对于其生长发育有一定程度的影响[23-24]。本研究发现水氮互作在一定程度上抑制草地早熟禾NADH-GOGAT基因的表达。
4 结论
本研究成功克隆得到草地早熟禾NADH-GOGAT基因,序列为3236bp,完整的ORF区为1338bp,编码446个氨基酸。含有1个Glu-syn-central结构域,属于Glu-syn-central超级家族。与硬粒黑小麦氨基酸序列相似度最高。亚细胞预测表明,NADH-GOGAT定位于细胞质中。草地早熟禾NADH-GOGAT基因在叶片中表达量最高。低氮且氮源为硝态氮的处理更有利于NADH-GOGAT基因的表达。NADH-GOGAT在干旱胁迫和水氮互作中表达差异显著(P<0.05)。草地早熟禾NADH-GOGAT基因的克隆与表达分析对进一步研究该基因的功能、GS-GOGAT循环及氮代谢途径具有重要意义。
