藏北嵩草种子休眠与发芽特性研究
2019-05-31邓晨玥徐慧齐呼天明何学青
邓晨玥, 徐慧齐, 呼天明, 何学青
(西北农林科技大学草业与草原学院,陕西 杨凌,712100)
种子休眠是指具有生活力的种子在适宜的环境条件(即水分与空气充足、温度适宜)下经过一定时间仍然不能发芽的现象[1],而种子发芽是植物生命周期中的关键发育步骤,并且对农业生产也很重要[2],因此破除种子休眠、寻找种子发芽最适条件的研究变得尤为重要。
藏北嵩草(KobresialittledaleiC. B. Clarke)是莎草科,嵩草属的多年生草本植物,主要分布于中国青藏高原,具有耐寒、耐旱、耐瘠薄、耐辐射、耐强风的特点,并且草质柔软、营养价值高,富含蛋白质,是家畜喜爱的原生优良牧草,除此之外,还具有控制水土流失、维持生态平衡的重要作用[3]。嵩草属种子在自然条件下发芽率极低,未经处理的嵩草种子室内和室外发芽率分别只有4%和2%[4],休眠率明显,所以,打破嵩草种子休眠、提高嵩草属植物种子发芽率及其特性的研究具有重要意义。有关打破嵩草属植物的休眠并提高其发芽率的研究已有相关报道[5-8],但主要集中利用层积和温度处理等物理方法,处理效果不显著。鱼小军等[7]研究表明冬季层积对完整和破皮线叶嵩草(Carexcapillifolia(Decne.) S. R. Zhang)种子的发芽无显著影响。康建军等[8]研究发现粗壮嵩草(KobresiarobustaMaxim.)在25/5℃,25/15℃和 25/20℃变温的条件下,不同处理后发芽率最高仅能达到30%,未能满足栽培利用之需。
种子的休眠与发芽特性因种而异,因此不同种子应选择适宜其本身的方法来破除休眠,提高发芽率。打破种子休眠的方法可分为物理方法和化学方法两大类。其中物理处理方法主要包括温度、光照、温水浸种和电磁场处理等[9]。张国云等[5]对嵩草(Kobresiamyosuroides(Villars) Fiori)种子的研究中发现在相同质量浓度氢氧化钠(NaOH)溶液处理下,结合低温层积处理比单独使用NaOH溶液处理,种子萌发率均有提高,但未达到显著性差异。周之琴等[6]用浓硫酸处理藨草(ScirpustriqueterL.)和苔草(Carexspp.)的种子,但对发芽无显著促进作用。化学处理法包括渗透调剂类、无机盐类、激素等处理[9]。其中,激素在种子休眠和发芽过程中扮演着重要的作用。如刘文瑜等[10]以0.1 mmol·L-1GA3将蒺藜苜蓿(Medicagotruncatula)浸种后低温层积处理对于种子发芽效果最好。郭春秀等[11]使用80 mg·L-1赤霉素(GA3)水溶液浸泡沙生针茅(Stipaglareosa)种子24 h,对于提高种子的发芽率和发芽势的效果最好。有关植物生长调节物质对降低藏北嵩草种子休眠率,提高发芽率的研究报道甚少,结合前人研究,本试验采用赤霉素3(Gibberellin,GA3,GA4+7),脱落酸(Abscisic acid,ABA)等3种外源激素和赤霉素的生物合成抑制剂多效唑(Paclobutrazol,PA),脱落酸的生物合成抑制剂氟啶酮(Fluridone,FL)以及NaOH处理藏北嵩草种子,探究藏北嵩草种子休眠机理并寻求快速有效提高藏北嵩草植物种子发芽率的方法,为嵩草属植物有效利用提供理论参考依据。
1 材料与方法
1.1 试验材料
供试材料为藏北嵩草成熟种子。于2014 年采集于西藏那曲地区,经风干清选后置于4℃冰箱中保存备用。
1.2 试验方法
将藏北嵩草装于烧杯中,用75%的酒精处理种子30 s后取出,使用蒸馏水冲洗3~5次,再用质量分数为1.0%的次氯酸钠溶液消毒1 min,用蒸馏水冲洗干净备用。
1.2.1种子生活力测定预处理 初始生活力[12]:将完整饱满的种子浸泡在蒸馏水中在25℃下过夜(12 h),将种子取出用解剖刀沿腹缝线纵切、横切以及刺破种皮处理,进行生活力测定。
新鲜未发芽种子生活力:发芽试验结束后,将未发芽的种子采用横切方法进行切割,进行生活力测定。
1.2.2NaOH溶液处理 每处理选取25 粒饱满的藏北嵩草种子,放入20,30,40 g·L-1的NaOH溶液中,分别浸泡处理1,2,3 h,将种子洗净后放入置有双层滤纸的直径为9 cm培养皿中,贴上标签,用于发芽试验,每处理3次重复。
1.2.3外源植物生长物质单一溶液处理 每处理选取25 粒饱满的藏北嵩草种子,放入置有双层滤纸的培养皿中,分别加入6 mL浓度为0,50,100,200,400 μmol·L-1的GA3,GA4+7,FL,PA,ABA溶液浸湿滤纸,以蒸馏水为对照,每处理3次重复,随后进行发芽试验。
1.2.4外源植物生长物质混合溶液处理 将浓度均为400 μmol·L-1的4种外源激素ABA,FL,GA3和PA两两之间进行等体积混合,混合后试剂最终浓度为200 μmol·L-1,每处理选取25 粒饱满的藏北嵩草种子,放入放置双层滤纸的直径为9 cm培养皿中,分别加入6 mL混合后的溶液,以蒸馏水为对照进行发芽试验,每处理3次重复。
1.3 试验指标测定
1.3.1种子千粒重测定 从净种子中随机选取8组种子,每组100粒,用千分之一天平准确称重,取平均值计算种子千粒重。
1.3.2种子吸水率测定 选取刺破种皮与完整的藏北嵩草种子各25粒,每处理3次重复,在25℃条件下,将种子浸泡在蒸馏水中,分别在0.5 h,1 h,2 h时将种子取出快速用滤纸吸干种子表面水分,准确称重,随后每隔 2 h取出种子,按照同样的方法进行称量,并按下列公式计算吸水率。

1.3.3种子生活力测定 将不同处理的种子置于点滴板上,滴加0.5% TTC溶液,将点滴板置于黑暗条件下30℃的恒温箱中12 h,其中每处理25粒种子,重复3次,取出浸泡于TTC溶液中的种子用清水洗净后,进行观测,记录胚正常染色的种子数量,并按下列公式计算生活力。

新鲜未发芽的种子数(粒)=
供试种子数(粒)-发芽种子数(粒)

1.3.4发芽试验相关指标测定 将所有处理的培养皿置于恒温光照培养箱内进行发芽试验,培养条件为:温度(25±2)℃[13],光照16 h,黑暗8 h。以胚根突破种皮作为发芽标准[14],观察发芽总时长为28 d,种子发芽期间每天观察并记录发芽种子数,用于计算种子发芽率、发芽势和发芽指数,计算公式如下:


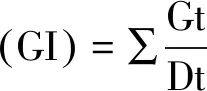
1.4 数据处理
所有数据均用Excel 2013录入,数值均以平均值±标准误表示,采用SPSS Statistics 17.0软件对数据使用Duncan’s法检验各处理之间的差异显著性。
2 结果与分析
2.1 藏北嵩草种子形态结构及千粒重测定
通过观察发现,藏北嵩草种子形状为长圆形或椭圆形,先端尖,外种皮为黑褐色,光滑,不易剥离。种子长为2.3 ~ 2.9 mm,宽为1 ~ 2 mm,果实具有较长的果柄和果喙,其中,果柄长0.2 ~ 0.3 mm,果喙长0.2 ~ 0.3 mm,种子千粒重为0.7520±0.091 g,说明种子饱满。
2.2 种皮透性对藏北嵩草种子吸水率的影响
藏北嵩草种子吸水曲线如图1所示。刺破种皮与完整种皮的藏北嵩草种子吸水变化趋势相似,都呈现先快速增加后平缓直至稳定饱和的状态,且在整个吸水阶段,刺破种皮种子的吸水率始终大于完整种子。浸种0.5 h后,刺破的种子与完整种子的吸水率增幅最大,吸水率分别达到20%与13%,随即进入相对较缓的增长阶段,浸种4 h后吸水率基本持平,进入吸水的饱和期,两者吸水率最大分别达到25%与22%。两种处理的种子在吸水过程中吸水率始终存在差异,但均可在4 h内快速吸水,表明藏北嵩草种皮并不影响水分进入种子内部。
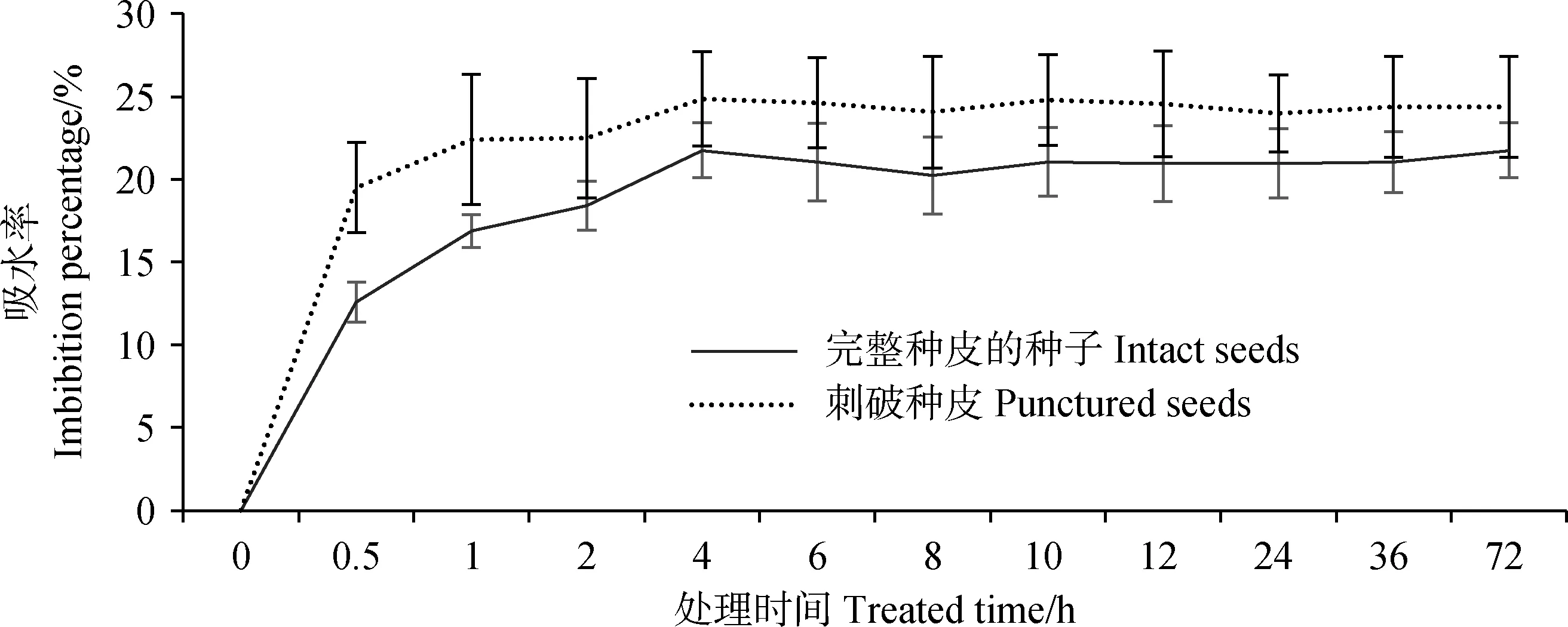
图1 种皮透性对藏北嵩草种子吸水率的影响Fig.1 Effect of seed coat permeability on dynamics of Kobresia littledalei seed imbibition rate
2.3 种皮透性对藏北嵩草种子生活力测定的影响
种皮透性对藏北嵩草种子生活力测定的影响结果如图2所示,采用纵切、横切和刺破种皮处理后,染色率分别为90%,90%和64%,而完整种子在任何染色时长下都无法进行染色,说明藏北嵩草种皮通透性影响了TTC进入种子内部。
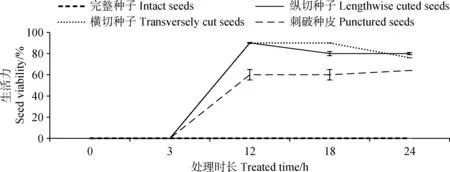
图2 不同处理对藏北嵩草种子生活力测定的影响Fig.2 Effects of different treatments on seed viability of Kobresia littledalei
2.4 不同浓度NaOH处理对藏北嵩草种子发芽与霉变的影响
图3显示,20 g·L-1NaOH处理藏北嵩草种子时,随处理时长的增加,种子发芽率与发芽势呈先增加后降低趋势,处理2 h可达到最高发芽率(84%),发芽势达到83%。30 g·L-1与40 g·L-1NaOH处理1 h对藏北嵩草种子发芽率与发芽指数促进效果最显著(P<0.05),发芽率由对照的42%提高到96%与98%,发芽指数由对照的2.20提高到3.90与3.72,,但随着处理时长的增加,发芽率与发芽指数持续降低。
由图4可知,各浓度处理下,处理时长为1 h时,霉变率都为0,而40 g·L-1NaOH处理3 h时,霉变率达到最高,为35%。随NaOH浓度的升高与浸种时间的增加藏北嵩草种子的霉变率增加。
2.5 不同外源植物生长物质单独作用对藏北嵩草种子发芽的影响
不同浓度、不同种类外源植物生长物质处理对藏北嵩草种子发芽情况影响不同(图5)。除400 μmol·L-1处理外,在50 ~ 200 μmol·L-1的GA4+7显著提升藏北嵩草种子的发芽(P<0.05),发芽率分别为56%,55%,56%(对照组为32%)。50 μmol·L-1处理后,种子发芽指数为1.45,与对照(0.96)相比呈现显著差异(P<0.05)。经过不同浓度GA3处理后,200 μmol·L-1处理有最高发芽率(55%)且与对照组有显著差异(P<0.05),但对照组与其它各浓度处理间无显著性差异。PA是GA3的合成抑制剂,各个浓度的PA处理后,种子发芽率、发芽指数均随着浓度的升高而降低,发芽势与对照组相比显著降低(P<0.05)。各浓度的ABA均显著抑制了种子的发芽率与发芽势(P<0.05),ABA的合成抑制剂FL在高浓度(≥200 μmol·L-1)时显著促进了种子的发芽并且400 μmol·L-1的FL还能够显著增加种子发芽指数(P<0.05)。各浓度的GA4+7、GA3、FL处理后,种子发芽势无显著变化。在藏北嵩草种子发芽的整个过程中,无霉变现象且处理后未发芽的种子生活力之间没有显著差异(图6)。
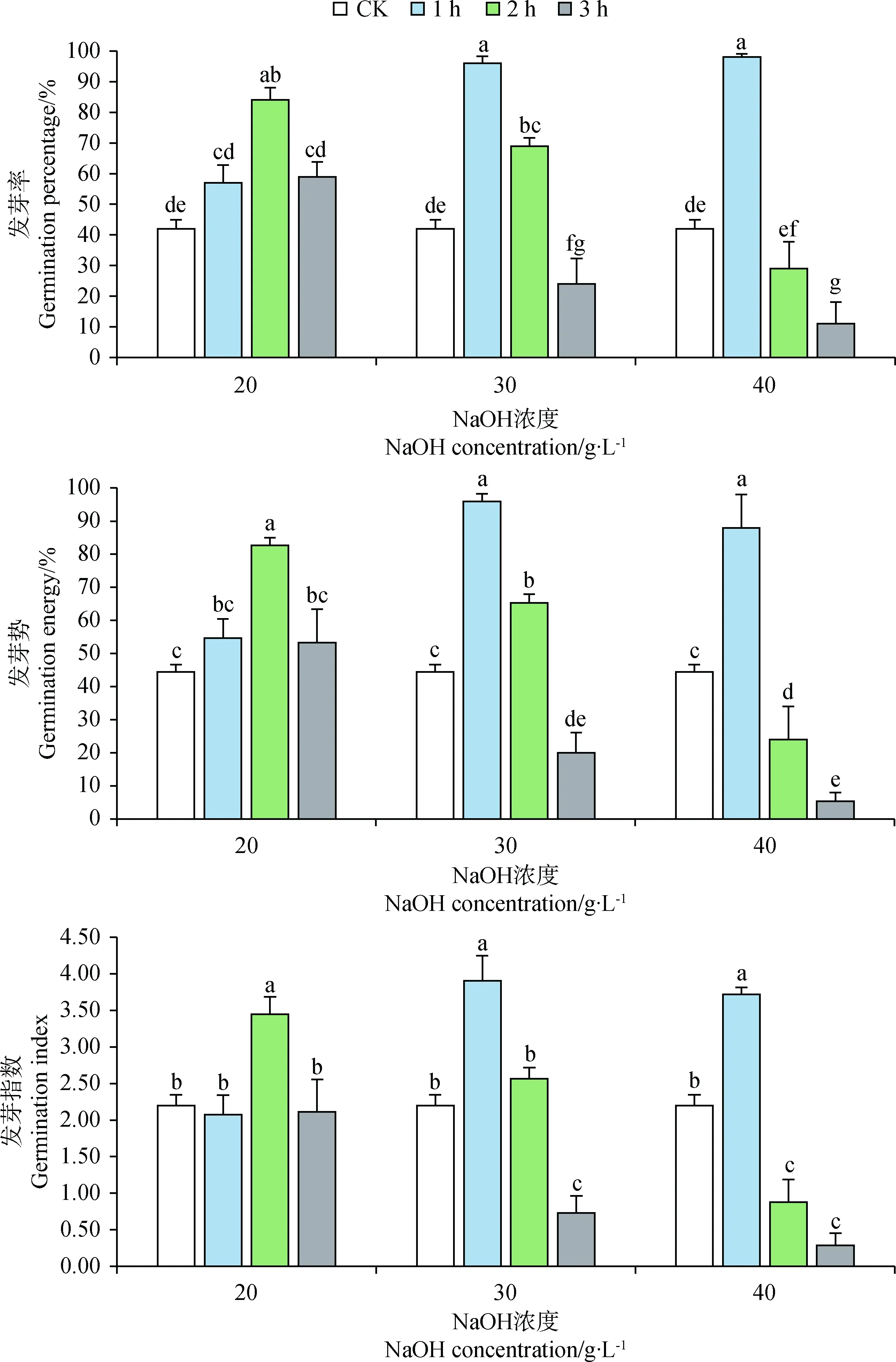
图3 氢氧化钠处理对藏北嵩草种子发芽的影响Fig.3 Effects of NaOH with different treatments on seed germination of Kobresia littledalei注:图中标不同字母表示差异显著(P<0.05)。下同Note:Different letters in the legends indicate significant difference at the 0.05 level. The same as below
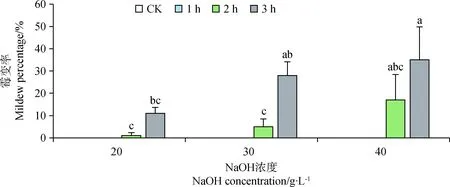
图4 氢氧化钠处理对藏北嵩草种子霉变率的影响Fig.4 Effects of NaOH with different treatments on seed mildew percentage of Kobresia littledalei
对发芽试验后新鲜未发芽种子进行生活力测定后发现,高浓度(≥200 μmol·L-1)GA4+7、100 μmol·L-1与2 00 μmol·L-1GA3,100 μmol·L-1FL,50 μmol·L-1PA处理后种子生活力分别为59%,33%,18%,14%,9%,18%,与对照组(1%)呈显著差异(P<0.05)。除此之外,所有浓度梯度的ABA处理后种子生活力都与对照组都呈显著差异(P<0.05)。
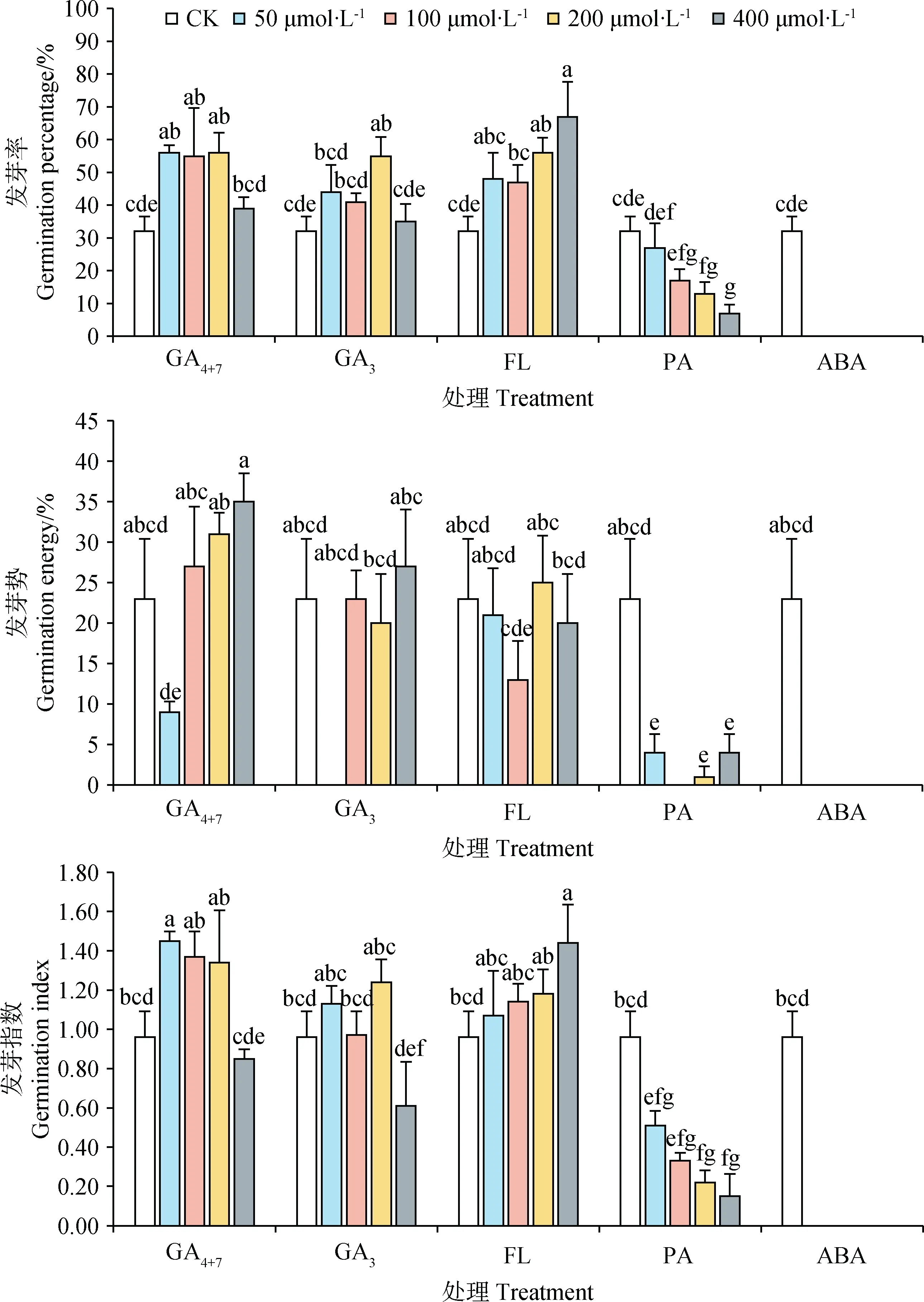
图5 不同浓度外源植物生长物质单独处理对藏北嵩草种子发芽的影响Fig.5 Effects of different plant exogenous growth substances at different concentrations on seed germination of Kobresia littledalei
2.6 不同浓度外源植物生长物质相互作用对藏北嵩草种子发芽的影响
由图7可知,GA3+ABA与ABA+FL处理后藏北嵩草种子发芽率与发芽势接近于0,显著低于对照组(P<0.05),与ABA单独作用于藏北嵩草种子的结果相似,而GA3,FL单独作用时,藏北嵩草种子发芽率显著提升(P<0.05),但发芽势与对照组相比无显著变化,且GA3+FL显著提升种子发芽率(P<0.05)。GA3+FL处理的发芽率、发芽指数与对照组无显著差异,而GA3+PA、FL+PA处理的发芽率与对照组无显著差异,发芽指数却显著降低(P<0.05)。PA单独处理后发芽率为13%,与对照(33%)有显著差异(P<0.05),而GA3+PA处理后发芽率为36%,与对照无显著差异。由图8可知,ABA单独处理后种子生活力为36%,GA3+ABA处理的种子生活力为25%,两者都与对照组(1%)相比有显著差异(P<0.05)。
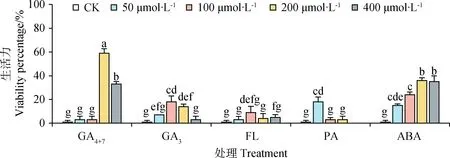
图6 不同浓度外源植物生长物质单独处理对藏北嵩草新鲜未发芽种子生活力的影响Fig.6 Effects of different plant exogenous growth substances at different concentrations on ungerminated seed viability of Kobresia littledalei
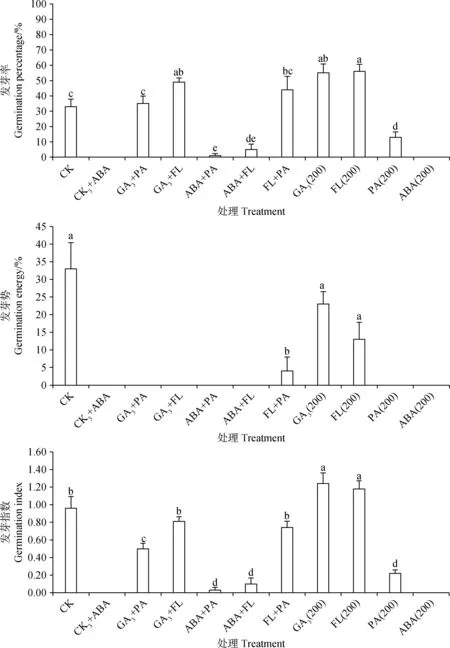
图7 不同外源植物生长物质互作处理对藏北嵩草种子发芽的影响Fig.7 Effects of different plant exogenous growth substance combinations on seed germination of Kobresia littledalei
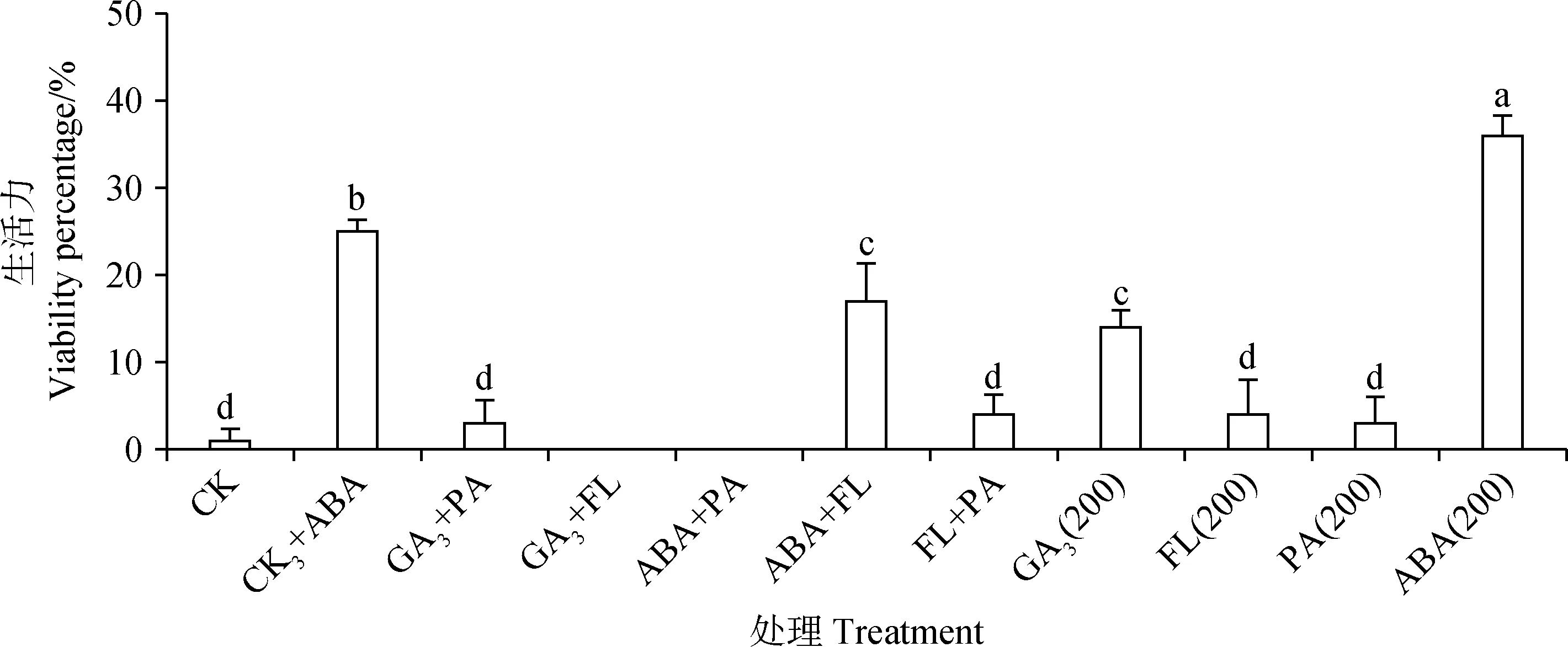
图8 不同外源植物生长物质互作处理对藏北嵩草新鲜未发芽种子生活力的影响Fig.8 Effects of different plant exogenous growth substance combinations on ungerminated seed viability ofKobresia littledalei
3 讨论
根据Baskin和Baskin对种子休眠体系的划分[15],种子休眠可划分为物理休眠、生理休眠、形态休眠、形态生理休眠和复合休眠5种类型。本研究发现刺破种皮处理比完整种子吸水率更高且前期吸水速率也更快,但都可以吸水,表明种皮透水并不是影响藏北嵩草休眠的因素,即藏北嵩草种子不属于物理休眠。生活力测定结果表明藏北嵩草种子具有高生活力,存在较大的发芽潜力。使用NaOH处理藏北嵩草种子后,能够使种子发芽率高达98%,说明种胚已经发育完全,表明种子不具有形态休眠,属于生理性休眠。
藏北嵩草种子采自青藏高原,因为自然环境的原因,种子有坚硬致密的果皮,有利于其适应当地恶劣环境,同时也阻碍了胚根突破种皮,限制了种子的发芽[16]。NaOH处理能够增加种子的发芽率,可能是由于强碱自身的腐蚀性作用使种皮的透性改变,减轻或消除种皮阻力,使胚根更容易的突破种皮,同时能够将种子本身抑制发芽的物质外漏,使种子加快发芽。汤前等[17]在稗草(Echinochloacrusgalli)种子发芽的研究中发现,用20%NaOH处理种子,发芽率从2.22%提高到58.33%。王薇[18]研究发现结缕草(ZoysiajaponicaSteud.)种子经NaOH处理后可缩短发芽时间,提高发芽率。本研究40 g·L-1NaOH处理藏北嵩草种子1 h发芽率可达98%,可见NaOH能有效破除藏北嵩草种子休眠。低浓度(20 g·L-1)时,随着处理时间的增加,发芽率随之增加,但未产生霉变率;但高浓度(30 g·L-1,40 g·L-1)处理后,随着处理时长的增加发芽率降低,霉变率升高。不难看出,NaOH对于藏北嵩草种子的发芽虽有显著促进作用但高浓度与长时间的处理也会增加其霉变率,这可能是由于浸种过程中种子自身含有的如酚类、黄酮类等化合物被淋洗出,而使得对微生物的抵抗能力减弱,进而表现出较高霉变率,这些化合物可能也是种子的内源发芽抑制物[19]。因此,选择合适的NaOH浓度与处理时长是非常必要的。
在维持种子休眠进而抑制种子发芽的过程中,ABA的作用至关重要[20]。田迅等[21]研究得出20 ~ 60 mg·L-1浓度的ABA对少花蒺藜草(CenchruspauciflorusBenth.)种子发芽有最大抑制作用的结论。黄晓辉等[22]在研究中发现低浓度(<200 μmol·L-1)外源ABA对羊草(Leymuschinensis(Trin.) Tzvel.)种子休眠和发芽无影响,高浓度(>200 μmol·L-1)显著抑制其发芽。本试验发现外源ABA对种子发芽及外源FL、GA3有抑制作用,这可能是由于ABA对种子休眠的诱导作用可通过赤霉素逆转[23]。
赤霉素能解除种子休眠,使已经结束休眠的种胚生长,能激活植物基因,控制酶蛋白的合成和酶的分泌,从而促进代谢反应可对受到破坏的细胞膜进行修复[24]。邹竣竹[25]通过1 500 mg·L-1GA3浸种处理野牛草(Buchloedactyloides)种子可显著促进种子发芽率与发芽速度,并且激素浸种对野牛草幼苗可溶性蛋白的含量有一定的抑制作用。罗富成等[26]用400 mg·L-1GA3溶液将纳罗克非洲狗尾草(Setariasphacelatacv. Narok) 浸种24 h,种子各项活力指标均显著高于对照。Ma等[27]研究发现浓度小于50 μmol·L-1GA3显著提高羊草种子发芽,浓度大于50 μmol·L-1GA3会降低对羊草种子发芽的促进作用。本研究发现200 μmol·L-1GA3能显著提升种子发芽率,但GA4+7在50 ~200 μmol·L-1的浓度范围内都可提升种子发芽率,显而易见的是GA4+7显著作用的浓度范围比GA3的更广,这可能是因为GA4+7的分子极性更好。这一点与何学青等[28]研究发现GA4+7的分子极性更好,更容易进入柳枝稷(PanicumvirgatumL.)内部,促进柳枝稷发芽的研究结果相似。同时,GA3+FL处理的发芽率、发芽指数与对照组无显著差异,而GA3+PA处理的发芽率与对照组无显著差异,发芽指数却显著降低,说明此处理不影响种子发芽率但会使种子活力降低。
本研究发现当PA浓度大于等于200 μmol·L-1时显著抑制藏北嵩草发芽,GA3+PA处理后发芽率与对照无显著差异,表明了PA的抑制作用可被外源GA3逆转[29-31],种子休眠与否不仅与内源激素的绝对含量多少有关,还与种子中各激素之间的含量比值有关,休眠的关键是平衡关系。就如ABA促进休眠,GA3解除休眠,两者存在拮抗作用,近来研究表明两者相互抑制对方的代谢和信号基因,并且两个植物激素还抑制的其他生物合成[32-33]。张韵等[34]研究发现,外源ABA和GA3浸种处理均能显著缓解不同浓度NaCl对黄瓜(CucumissativusL.)种子发芽的抑制作用。本研究使用GA3与ABA互作处理发现种子发芽率为零,这可能是GA3与ABA的之间的平衡关系未能打破种子的休眠,它们之间适宜的相对含量还有待进一步研究。
本试验对于不同处理后测定新鲜未发芽种子的生活力结果显示,ABA单独处理后,新鲜未发芽种子休眠率为36%,GA3+ABA处理的种子休眠率为25%,ABA+FL处理后种子的休眠率为17%,以及高浓度(≥200 μmol·L-1)GA4+7,100 μmol·L-1与200 μmol·L-1GA3、100 μmol·L-1FL,50 μmol·L-1PA、所有浓度梯度的ABA处理后种子休眠率均较对照(1%)显著增加。我们通过初始生活力测定结果显示种子具有高生活力且种子具有良好的透水性,但由于未测定其透氧性,因此可能是因为藏北嵩草种子种皮有良好的透水性但透氧性较弱,在高湿环境下由于种子的呼吸作用消耗氧气导致种子失活,加入外源生长物质能够调节种子生理功能,使藏北嵩草种子较对照组保持胚的活性。
4 结论
藏北嵩草种子属于生理休眠,40 g·L-1的NaOH处理种子1 h能有效打破种子休眠,种子发芽率可达98%;400 μmol·L-1FL是藏北嵩草发芽较为适宜的外源生长物质浓度;单独施加适宜浓度的赤霉素(GA3、GA4+7),氟啶酮(FL),脱落酸(ABA),多效唑(PA)及GA3+ABA、ABA+FL等外源植物生长物质均有利于保持藏北嵩草种胚的活性。
