JAK/STAT3信号通路参与白细胞介素-17诱导的支气管平滑肌细胞增殖与迁移
2019-05-30蓝引乐王建华凌元亮
蓝引乐,朱 妤,王建华,凌元亮
(浙江大学医学院附属儿童医院1.呼吸科,2.中医科,浙江杭州310012;3.杭州市拱墅区祥符社区卫生服务中心,浙江杭州310023)
哮喘是儿童高发的慢性呼吸系统疾病,其主要特征是气道重塑、炎症和支气管高反应性[1]。气道重塑是哮喘发生的重要环节,与疾病严重程度与预后密切相关[2]。支气管平滑肌细胞(bronchial smooth muscle cells,BSMC)的异常增殖在气道重塑中具有重要作用[3],由于其支气管平滑肌细胞增殖与迁移增强,其病理特征表现为支气管平滑肌肿块增加。哮喘是由多种细胞参与的慢性气道炎症[4],支气管平滑肌细胞的异常增殖已成为哮喘防治中人们关注的焦点,减少过度增殖的气道平滑肌组织的可以通过改善哮喘的症状,支气管平滑肌细胞的异常增殖与迁移被认为是抗哮喘治疗的主要靶点[5]。现有的研究已经证实,促激活和促纤维化的细胞因子与支气管平滑肌细胞密切相关[6]。细胞因子主要包括白细胞介素(interleukin,IL)家族、转化生长因子beta(TGF-β)等[6]。白细胞介素家族是哮喘中支气管平滑肌细胞的结构和功能异常的主要参与者之一。细胞介素-17(interleukin-17,IL-17)是T 细胞诱导的炎症反应的早期启动因子,研究发现IL-17在哮喘患者血液中表达显著增高[7-8],但是IL-17对支气管平滑肌细胞的效应尚不清楚。JAK/STAT通路可被促炎细胞因子激活,导致STAT转录因子磷酸化[9],且在哮喘患者显示支气管组织内JAK/STAT通路被激活[10]。对此本研究对IL-17对BSMC的增殖刺激作用进行探索,验证是否JAK/STAT3信号通路参与其中。
1 材料与方法
1.1 细胞培养与药物处理
人BSMC来源于自上海斯信生物科技有限公司。采用含有100 mL/L胎牛血清(ThermoFisher Science公司,美国)、0.5 g/L表皮生长因子和2 g/L成纤维细胞生长因子的M199培养基在37℃体积分数5%CO2培养箱中进行细胞培养。细胞生长达到70%~80%汇合时,使用10 mL/L ITS预混物(BD Bio公司,美国)增强的F12/DMEM(50∶50混合比例)的无血清培养基中培养12 h。然后用不同浓度(0.1、1、10 ng/mL)的IL-17(Sigma Aldrich公司,美国)分别处理细胞不同时间(24、48、72 h)。为研究IL-17对JAK-STAT3信号通路的影响,采用JAK-STAT3信号通路的特异性抑制剂50 μmol/L AG490(Selleck公司,美国)预处理细胞30 min,然后与10 ng/mL IL-17共同孵育48 h。
1.2 MTT法检测细胞活力
使用MTT法检测IL-17对人支气管平滑肌细胞活力的影响。细胞密度以5×103个/孔接种于96孔板中,贴壁12 h后,无血清培养基同步化12 h,再使用(0、0.1、1、10 ng/mL)IL-17分别刺激细胞不同时间(24、48、72 h)后,加入20 mg/L的MTT试剂,培养4 h,终止培养后吸去孔内培养液。每孔加入150 μL的二甲基亚砜,震荡溶解晶体,用分光光度法测定在570 nm处的吸光度,实验测试重复3次。
1.3 BrdU免疫荧光染色
使用BrdU标记方法测定BSMC增殖。5×103个/孔BSMC接种于96孔板中,贴壁12 h后,无血清培养基同步化12 h,按照实验要求,进行细胞处理。处理的细胞按照按照BrdU试剂盒(艾美捷公司,中国武汉)操作说明书,孵育10 μmol/L BrdU试剂24 h,然后用PBS洗涤细胞,用40 g/L的多聚甲醛包封10 min,随后用0.3%Triton X-100孵育20 min,使细胞膜通透。使用含5%BSA、0.1%Triton X-100的0.1 mol/L PBS封闭1 h。加入BrdU一抗封闭过夜。次日使用PBS洗涤后加入二抗孵育30 min。洗净后使用DAPI(碧云天公司,中国海门)染色5 min,封片剂封片。使用荧光显微镜观察BrdU阳性细胞。实验测试重复3次。
1.4 细胞周期分析
5×106个/孔BSMC接种于6孔板中,贴壁12 h后,无血清培养基同步化12 h,按照实验要求进行处理细胞。达到实验要求的时间终点时,用不含EDTA的2 g/L胰酶消化,1 000×g离心5 min收集细胞。-20℃在70%乙醇中固定一夜,4℃下1 000×g离心5 min。PBS洗涤后4℃下1 000×g离心5 min。随后将细胞重悬在300 μL碘化丙啶染色缓冲液(碧云天公司,中国海门)中,在室温下孵育30 min。使用流式细胞仪(BD Bio公司,美国)进行DNA含量分析。实验测试重复3次。
1.5 体外细胞迁移实验
使用24孔迁移室板(Chemicon公司,美国)来检测细胞迁移。收集按照实验要求处理后的BSMC,用无血清培养基调整细胞浓度为5×106个/mL,取100 μL细胞悬液接种到上腔室中,下腔室加入600 μL含10%FBS培养基。在37℃在体积分数5%CO2条件下孵育24 h后,取小室并擦除上室上膜细胞。在室温下用龙胆紫(Sigma-Aldrich公司,美国)染色10 min,随后用水冲洗10 min,室温下空气干燥20 min,在光学显微镜明场下计数5个随机视野(200×,Nikon公司,日本)膜表面的细胞数量进行计数,每个试验组重复3次。
1.6 蛋白质免疫印迹分析
收集按照实验要求处理后的BSMC,用预冷的PBS洗涤细胞3次,然后用250 μL的RIPA缓冲液和2.5 μL PMSF在冰上孵育30 min。收集细胞后,在13 000×g下离心10 min,在4℃下测定细胞裂解物的蛋白浓度。将蛋白裂解物(每样品50 μg)和缓冲液按比例混合,然后在100°C煮沸5 min。在SDS-聚丙烯酰胺凝胶电泳后转膜至PVDF膜。PVDF膜在室温下在含5%脱脂奶粉的TBST中封闭2 h。然后在4℃下与一抗体孵育过夜,稀释后的抗体包括单克隆小鼠抗人GAPDH(1∶5 000)和山羊抗人p-STAT3(1∶1 000)(Santa Cruz公司,美国),单克隆小鼠抗人JAK(1∶1 000),单克隆小鼠抗人STAT3(1∶1 000)(Santa Cruz公司,美国)。用TBST进行洗涤后,将膜与二抗孵育。使用化学发光免疫印迹免疫检测试剂盒(Invitrogen公司,美国)曝光显影。然后,使用IPP软件扫描蛋白灰度值,然后以GAPDH灰度值为内部参照,对胶片进行半定量分析。实验测试重复3次。
1.7 统计分析
使用Graphpad Prism 7.0软件对数据进行分析。经检测各组数据符合正态分布和方差齐,符合正态分布的数据表示为。对于不同时间点和不同浓度的IL-17对细胞活性的影响,采用有交互作用的两因素方差分析,检验水平α=0.05。两组数据的比较采用成组t检验。其余多组间数据两两比较采用单因素方差分析后Bonferoni检验。P<0.05认为有统计学意义。
2 结果
2.1 IL-17促进支气管平滑肌细胞增殖和迁移
为确定IL-17对BSMC增殖作用的影响,本研究首先使用浓度梯度为0、0.1、1和10 ng/mL的IL-17分别处理BSMC 24、48、72 h,随后使用MTT检测。如图1A显示,时间效应对BSMC增殖的影响差异有统计学意义(Ftime=23.352>F(2,24)=3.400,P=0.011);浓度效应对BSMC增殖的影响差异有统计学意义(Fconcentration=33.412> F(3,24)=3.010,P=0.009);时间与浓度交互作用对BSMC增殖的影响差异有统计学意义(Finteraction=11.635>F(6,24)=2.510,P=0.018);其中1 ng/mL IL-17作用BSMC 72 h和10 ng/mL IL-17作用BSMC 24、48、72 h均能升高细胞活力(P均<0.05);其中10 ng/mL IL-17作用BSMC 48、72 h细胞活力最高,而10 ng/mL IL-17作用48 h与作用72 h相比,无统计学差异。基于MTT实验结果,后面的实验条件采用10 ng/mL IL-17处理48 h。随后本研究对细胞进行了BrdU染色和细胞周期进行了检测。BrdU染色的结果显示,10 ng/mL IL-17处理后,BrdU阳性细胞数显著增加,差异具有统计学意义(t=24.438,P < 0.001;图1B)。细胞周期结果显示,10 ng/mL组G1期BSMC百分比明显低于对照组,差异具有统计学意义(t=29.146,P <0.001);而S期(t=19.741,P <0.001)与G2/M期(t=38.352,P<0.001)均高于对照组(图1C、D)。这些结果提示IL-17能够促进细胞增殖和细胞周期运行。随后我们对细胞的迁移进行评估,结果显示10 ng/mL组BSMC的迁移显著上调,差异具有统计学意义(t=26.254,P < 0.001;图1E、F)。这些结果表明,IL-17可促进支气管平滑肌细胞的增殖和迁移。

图1 IL-17促进对支气平滑肌细胞增殖与迁移Fig.1 IL-17 promotes the proliferation and migration in BSMC
2.2 IL-17上调支气管平滑肌细胞JAK/STAT3信号通路活性
为了探索IL-17对BSMC增殖作用的机制,本研究对BSMC的JAK/STAT3信号通路进行了检测。Western bolt实验检测发现IL-17处理BSMC后p-JAK(t=5.235,P=0.012)、p-STAT3(t=9.438,P=0.003)均表达上调(图2),差异有统计学意义;而 JAK(t=0.665,P=0.643)和 STAT3(t=0.431,P=0.725)变化差异无统计学意义。提示IL-17促进支气管平滑肌细胞的增殖和迁移可能是通过促进激活JAK/STAT3信号通路。
2.3 AG490抑制IL-17激活的支气管平滑肌细胞JAK/STAT3信号通路活性
为探索AG490是否对IL-17引起支气管平滑肌细胞JAK/STAT3信号通路的增强起到了抑制作用,本研究对AG490处理BSMC后JAK/STAT3信号通路进行了检测。Western blot检测发现AG490有效抑制了JAK/STAT3信号通路,p-JAK(P=0.015)、p-STAT3(P=0.026)表达下调(图3),差异有统计学意义。结果提示,AG490对IL-17引起支气管平滑肌细胞JAK/STAT3信号通路的增强起到抑制作用。

图2 IL-17激活支气管平滑肌细胞JAK/STAT3信号通路Fig2 IL-17 activates the JAK/STAT3 signaling pathway in BSMC

图3 AG490抑制IL-17激活的支气管平滑肌细胞JAK/STAT3信号通路Fig.3 AG490 inhibits the activation of JAK/STAT3 signaling pathway induced by IL-17 in BSMC
2.4 抑制JAK/STAT3信号通路活性缓解IL-17诱导的支气管平滑肌细胞的增殖与迁移
为证明JAK/STAT3信号通路参与了IL-17诱导的支气平滑肌细胞的增殖激活与迁移,本研究使用AG490来特异性阻断JAK/STAT3信号通路,进一步观察细胞活性、细胞增殖、细胞周期与细胞周期的变化。MTT检测结果显示AG490可阻止IL-17引起的BSMC的细胞活力增加(图4A),差异具有统计学意义(P=0.022);BrdU染色结果显示AG490降低了IL-17处理引起的BrdU阳性细胞数增多的现象(图4B、C),差异具有统计学意义(P=0.017);细胞周期(图4D和4E)结果显示,AG490+IL-17处理组G1期BSMC百分比明显高于IL-17单纯处理组(P <0.001);而S期(P=0.003)与G2/M期(P<0.001)均低于IL-17单纯处理组,差异具有统计学意义。提示用AG490处理能够减少IL-17导致的支气管平滑肌细胞增殖。随后本研究对细胞的迁移进行评估,结果显示AG490抑制了IL-17处理引起的BSMC的迁移上调(图4F、G),差异具有统计学意义(P=0.005)。这些结果表明,抑制JAK/STAT3信号通路缓解了IL-17诱导的支气管平滑肌细胞的增殖与迁移作用。
3 讨论
气道重塑是哮喘患者的突出病理特征[2],局部气道炎性细胞持续浸润可刺激支气管平滑肌增生,诱发气道重塑的发生[11],气道重塑的程度与病情及预后直接有关[2]。对人和哮喘小鼠模型支气管平滑肌细胞增殖活性和迁移变化的分析表明,患病组气道平滑肌细胞增殖活性和迁移均明显高于对照组[12-13]。提示哮喘过程中气道平滑肌细胞增殖过度和发生迁移运动,因此,抑制支气管平滑肌细胞增殖和迁移是治疗支气管哮喘的重要策略。哮喘的发病过程中免疫系统的功能异常参与其中。与免疫反应相关的炎症细胞因子可促进支气管免疫反应的发生。以前的研究中发现支气管哮喘大鼠模型中的细胞因子显著增高的现象,这些细胞因子诱导肥大细胞与支气管平滑肌细胞结合,促进肥大细胞的存活和增殖,促进炎性物质的积累,使支气管平滑肌细胞增殖与迁移,支气管平滑肌的增殖与迁移增强可导致气道高反应性[14]。但这些细胞因子对支气管平滑肌细胞的刺激作用的机制和作用并未明确。
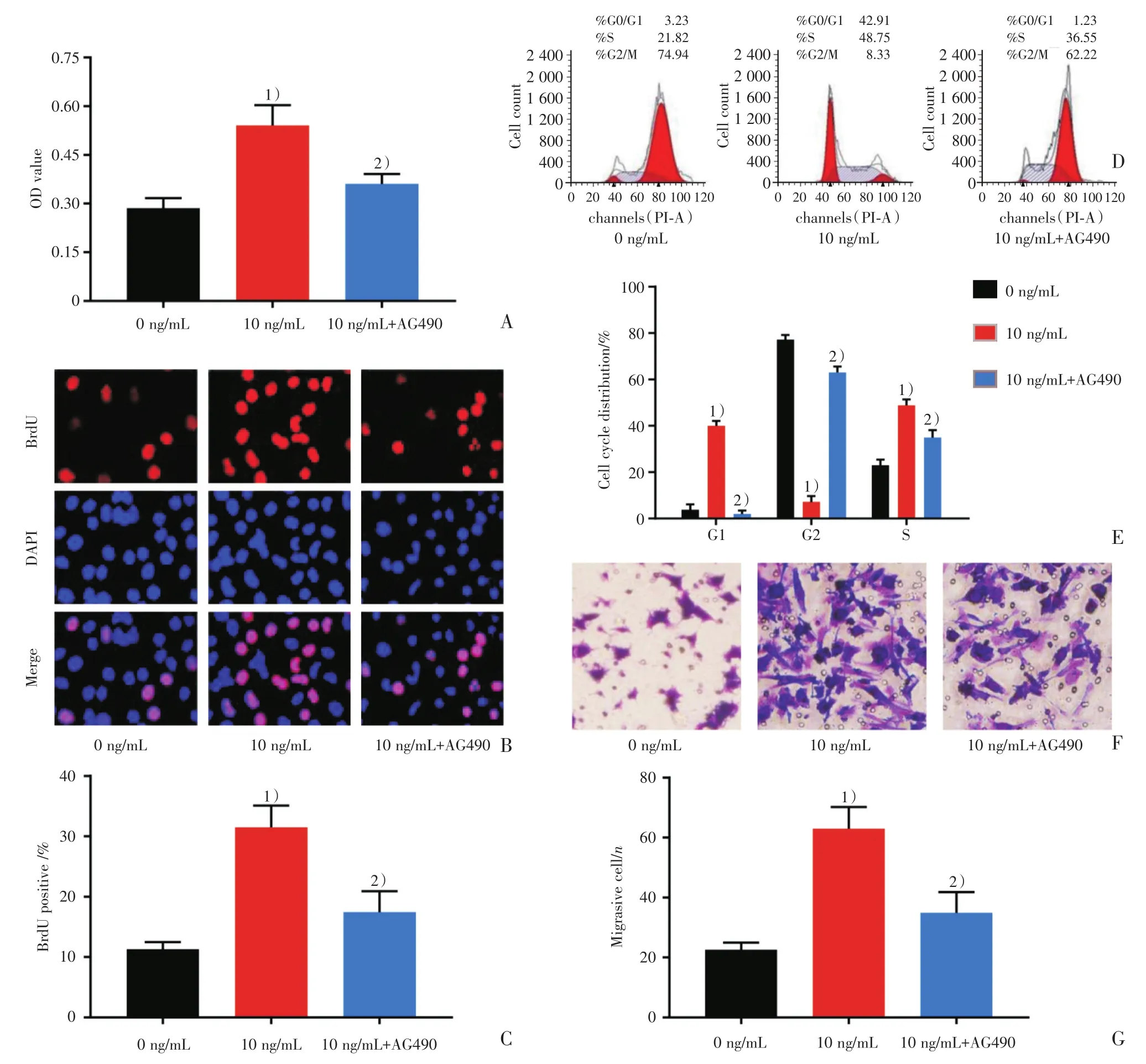
图4 AG490抑制IL-17诱导的支气平滑肌细胞的增殖与迁移Fig.4 AG490 inhibits the proliferation and migration in BSMC induced by IL-17
IL-17由CD4+T细胞分泌,能够诱导上皮细胞、内皮细胞、成纤维细胞合成分泌其他细胞因子,参与调节细胞增殖和分化[15]。哮喘患者气道中IL-17表达上调,炎症因子刺激后IL-17的表达水平在在气道平滑肌中增加[16]。这些研究表明,IL-17水平升高可能与BSMC增殖有关。IL-17通过与IL17RA形成的受体复合物触发信号[17],IL17RA在BSMC上表达分布[18],表明IL-17能够直接作用于气道平滑肌细胞。哮喘患者体内IL-17的增加可能直接作用于气道平滑肌细胞以诱导其增殖增生。在这里,我们证明了IL-17对支气管平滑肌细胞增殖和迁移的促进作用,这与之前在哮喘小鼠模型中,用抗IL-17A抗体中和IL-17A可减少炎性细胞气道浸润的结果吻合[19]。使用人抗IL17RA单克隆抗体,阻断IL-17的生物活性,可控制患者中度至重度哮喘[20],这些药物的潜在机制可能与对BSMC增殖和迁移的抑制作用相关。
STAT3是一种转录因子,在哮喘中具有高活性[21]。IL-17表达与STAT3磷酸化显著相关,STAT3可由IL-17激活促进细胞的生长和炎症等反应[22]。STAT3在细胞的生存、增殖和迁移中起着重要作用,因此被认为是抗细胞增殖相关的治疗靶点。STAT3活性增强可以促进气道平滑肌细胞的细胞增殖[23]。而JAK/STAT抑制剂可以用于包含哮喘在内的过敏性疾病的治疗[24]。在本研究中,我们发现,IL-17能促进STAT3的磷酸化,促进STAT3的活化从而诱导支气管平滑肌细胞增殖。JAK/STAT3通路阻断剂阻断IL-17诱导的支气管平滑肌细胞增殖活化过程。这些结果说明IL-17通过促进支气管平滑肌细胞中JAK/STAT3通路的表达而激活增殖迁移过程。
本研究利用细胞培养技术探索了支气管平滑肌细胞增殖与迁移的分子机理,探寻调控支气管平滑肌细胞细胞生长的关键细胞周期事件,从而为治疗哮喘提供了理论依据和新靶点。本研究表明IL-17调节支气管平滑肌细胞的增殖和迁移过程,且这一过程由JAK/STAT3信号转导通路介导,该机制可能参与了哮喘患者的气管重塑,哮喘患者有望应用针对JAK/STAT3信号转导通路的药物缓解气管重塑。
