经典型巴特综合征1例家系的临床及基因检测分析
2019-05-24黄有烨胡红琳王长江夏同佳张娜娜孙蓉
黄有烨,胡红琳,王长江,夏同佳,张娜娜,孙蓉
巴特综合征是一种由遗传基因突变引起的电解质及激素紊乱的代谢性疾病。目前国内外已有不少关于巴特综合征的研究报道,本文结合临床确诊的1例巴特综合征的诊断(尤其是基因诊断)和治疗进行文献复习,以期为同行提供参考。
1 临床资料
1.1 一般资料男,24岁,因“反复肢体乏力23年”于2017年6月29日就诊于安徽医科大学第一附属医院内分泌科。
1.2 现病史病人1岁时,家人发现其颈部抬起无力,于当地医院查血清钾水平减低(具体不详),后就诊于安徽医科大学第一附属医院儿科诊断为“低钾血症巴特综合征”,予以补钾处理,症状缓解。病人13岁时再次出现肢体无力症状,以双下肢为主,且病人及家属诉近年病人生长发育较迟缓,遂复于我院儿科治疗,出院后遵医嘱予以长期口服氯化钾缓释片,2014年5月病人再次出现上述症状,当时查血钾2.11 mmol/L,予以长期口服氯化钾缓释片。近两年病人肢体无力症状发作频繁,每2~3周发作一次,多于剧烈运动后及进食甜食后出现,部位从双足逐渐向上延伸,无软瘫及呼吸困难病史,予以口服氯化钾后肢体无力症状可缓解。
1.3 体格检查身高165 cm,体质量74 kg;体质量指数(body mass index,BMI)27.18 kg/m2;血压114/74 mmHg。智力发育正常,高中学历。心肺腹部查体均未见异常,四肢肌力四级,肌张力正常,生理反射存在,未引出病理反射;在院期间血压监测(住院8 d,血压监测34次):最高127/70 mmHg,最低95/52 mmHg,平均血压(114.38±8.16)/(72.20±8.33) mmHg。
1.4 实验室检查数据2017年7月1日进行血电解质检查:钾 1.91 mmol/L,钠 134.2 mmol/L,氯 87.2 mmol/L,钙 2.64 mmol/L,镁 0.84 mmol/L。碳酸氢根 40.0 mmol/L,肌酐 77.7 μmol/L,肾小球滤过率 127 mL·min-1·(1.73 m2)-1。肝功能、血糖、血脂等均正常。尿常规:比重 1.010,pH值 7.0,未见红细胞、白细胞、蛋白质、酮体等。尿酸化功能测定:pH值 6.67,碳酸氢根 8.00 mmol/L,可滴定酸 12.00 mmol/L,铵离子:10.00 mmol/L。2017年7月1日查24 h尿钾为46.24 mmol/L(同日测得血钾为1.91 mmol/L),24 h尿氯:152 mmol/L,24 h尿量:2 L;卧位醛固酮:670.00 pmol/L(正常参考值124~483 pmol/L)。2017年7月3日,促肾上腺皮质激素:24.80 pg/mL,皮质醇:360.03 nmol/L(正常参考值 138~690 nmol/L)。2017年7月4日,肾素:2.1 ng·mL-1·h-1,卧位血管紧张素卧位Ⅰ:3.10 pg/mL (正常参考值 0.05~0.79 pg/mL),卧位血管紧张素Ⅱ:110.40 pg/mL (正常参考值 28.3~52.2 pg/mL);所有血液标本采集时间为2017年7月1日。辅助检查:12导联心电图提示窦性心律,U波变化; 肾上腺CT:两侧肾上腺未见占位;肾脏B超:双肾多发囊肿。
1.5 家族史父母身体健康,近亲结婚;有1个妹妹,检测血钾均未见异常;无四肢软瘫、肌无力等临床表现。
1.6 基因检测及诊断结果与病人及家属充分沟通并签订知情同意书后,留取病人及病人父母、妹妹外周静脉血各3.0 mL。提取DNA,运用高通量测序技术进行突变筛查、运用生物信息学及临床信息分析技术进行基因数据分析及运用Sanger测序技术疑似致病突变验证。结果显示病人CLCNKB 基因存在一个纯合突变:c.228A>C (外显子3)(见图1)。变异同巴特综合征Ⅲ型(经典型)(OMIM:607364)相符合。其父母经检测均为该基因杂合突变的携带者(见图1)。而其妹妹为该基因的野生型,未见突变基因;符合常染色体隐性遗传(AR)疾病发病机制,先证者及其家系成员表型及符合基因型的共分离(见图2)。同时先证者及其母亲SLC12A1 (chr15)基因有c.445G>A (外显子3)氨基酸改变,但均为杂合,经文献检索分析尚未有确切证据表明该杂合突变有生物学危害性。

图1 先证者及其父母CLCNKB基因突变序列
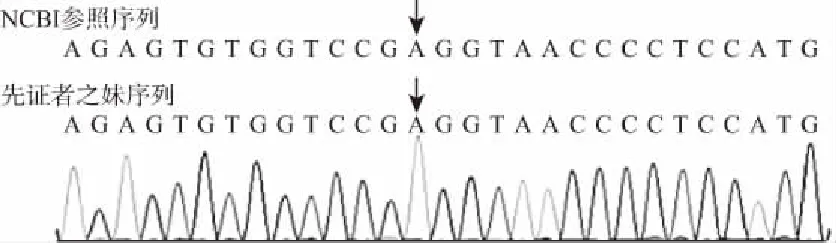
图2 巴特综合征先证者之妹CLCNKB基因序列
1.7 诊治经过病人既往频发肢体乏力,严重时伴有肢体软瘫,多次测血电解质显示存在低钾低氯,补钾治疗后症状缓解,入我院后行实验室检查,提示有低钾(血钾 1.91 mmol/L)、低氯(血氯84.7 mmol/L),低钾血症诊断明确,在血钾低于3.0 mmol/L时测尿钾大于20 mmol/L,提示为肾性低钾。且该病人于我院检测血浆醛固酮及血管紧张素超出正常值上限,提示病人为继发性醛固酮增多症,但血压监测均处于正常范围内,提示巴特综合征可能。给予对症治疗,静脉滴注0.3%KCl溶液及口服氯化钾片联合保钾利尿剂螺内酯等治疗后病人肢体无力症状较入院有明显好转,复测血钾较前明显升高,复查心电图恢复正常。同病人及家属沟通后予以抽取血标本进行基因检测,并最终检出CLCNKB:c.228A>C突变,确诊为经典型巴特综合征。其父母为该基因型的杂合子,而其表型正常的妹妹检测该基因型未见突变。
2 讨论并文献复习
1962 年 Bartter 等[1]首先报道 2 例低钾性代谢性碱中毒、高醛固酮血症,不伴有血压升高,进一步进行肾组织病理检查显示肾小球旁器增生的病人,而将其命名巴特综合征。其病理生理学基础[2]为远端小管中涉及钾、钠和氯的转运蛋白出现的缺陷,这种缺陷引起了机体钾、水、钠、氯的丢失,出现轻微的循环容量减少,并激活了肾素-血管紧张素-醛固酮系统(RAAS)从而导致高醛固酮的产生,最终引起并加重氢钾离子的丢失(临床表现为低钾血症、代谢性碱中毒)。尽管巴特综合征病人RAAS系统有着高活性,但监测病人血压正常或偏低。低钾、低容量可刺激生成前列腺素E2、激肽等物质[3],而这些物质可降低血管对内外源性血管紧张素的敏感性,从而避免了血压的升高。
2.1 巴特综合征的分型及临床表现导致了巴特综合征的这种蛋白缺陷是由一组多个不同基因位点的突变所引起的。根据这些基因突变的位点不同可将巴特综合征分为Ⅰ~Ⅴ型和特异性巴特综合征,而根据其临床表现表现不同又可将其分为新生儿型巴特综合征、经典型巴特综合征、新生儿型巴特综合征伴感音性聋、巴特综合征合并常染色体显性遗传性低血钙和特异性巴特综合征[4]。
2.1.1Ⅰ型巴特综合征 此型病人的基因突变位于染色体15q15-21的SLC12A1基因,为常染色体隐性遗传,该基因编码Na-K-2C转运体蛋白NKCC2。此型临床上属于新生儿型巴特综合征,多数在妊娠中期至末期时即可因胎儿多尿引起羊水过多甚至引起早产。
2.1.2Ⅱ型巴特综合征 Ⅱ型巴特综合征是由11q24上的KCNJ1基因突变所致,为常染色体隐性遗传。该基因编码电压依赖的K+通道蛋白ROMK;其临床表现与Ⅰ型巴特综合征相似,但其症状较轻。临床上也归于新生儿型巴特综合征。
2.1.3Ⅲ型巴特综合征 Ⅲ型巴特综合征(经典型巴特综合征)致病原因为1p36的CLCNKB基因突变,为常染色体隐性遗传[5]。本文所报道的病人即为该型。ClCNKB基因主要编码的是氯离子通道蛋白CLC-Kb,CLC-Kb主要分布于髓袢升支粗段、远端小管、皮质集合管上皮细胞的基底外侧膜,主要介导氯离子在基底膜侧的转运[6]。该蛋白并非为肾远端小管上唯一的氯离子通道,并且其本身在哺乳类动物中有较低表达[7],故而Ⅲ型巴特综合征的症状同Ⅰ型及Ⅱ型相比一般较轻,且多发病年龄一般较晚。一般症状表现为多尿、烦渴、嗜盐、手足搐搦等,临床检验中以低血钾及代谢性碱中毒为常见症状,本文报道的该例病人同其表现相符。
2.1.4Ⅳ型巴特综合征 Ⅳ型巴特综合征由于1p31染色体上的BSND基因突变引起,为常染色体隐性遗传,临床上属于新生儿型巴特综合征伴感音性聋,一般临床症状较重。此外,该基因还表达于前庭系统壶腹嵴的暗细胞及耳蜗的血管纹边缘细胞上,从而导致感音性聋,该表现亦为巴特Ⅳ型的特征表现。
2.1.5Ⅴ型巴特综合征 Ⅴ型巴特综合征是由于3q13染色体上的CASR基因激活突变引起,该类型为常染色体显性遗传。由该基因编码的CaSR蛋白于肾脏表达可抑制ROMK的功能,故而该类型病人的症状同Ⅱ型巴特综合征较为类似,但CaSR蛋白也可表达于甲状旁腺抑制甲状旁腺激素(PTH)的分泌,引起低血钙、高尿钙、低PTH等症状;为该型特征性表现。
2.1.6特异性巴特综合征 特异性巴特综合征是由于16q13上的SLC12A3基因突变引起,该类型为常染色体隐性遗传。该基因编码的NCCT为远曲小管上的Na-Cl同向转运体,同 NaCl在远曲小管处的重吸收相关。因NaCL的主要吸收位置并非位于远曲小管,故而水电解质丢失同前述类型相比较少,临床症状也较轻。特异性巴特综合征发病年龄一般较晚,多于青春期后或成年期发病,最多见症状为肌无力等低钾表现,且伴有低镁血症、高尿镁、高尿钙等表现;亦可无明显症状,于体检时发现。
2.2 巴特综合征的诊断及治疗巴特综合征的确诊依赖于基因检测。但目前基因检测尚未成为临床常规检查手段,故而多以临床诊断多依靠生化检测、肾脏病理及临床表现。巴特综合征诊断[4,8]的首要条件为血尿电解质的异常(难以纠正的低钠、低钾、低氯血症和代谢性碱中毒(血浆碳酸氢根>30 mmol/L)以及24 h尿钠、钾、氯排泄的显著增多,其中尤其以低血钾(1.5~2.5 mmol/L)同时伴有高尿钾(>20 mmol/L),为最突出的表现);其次为体内高RAAS系统活性其伴血压正常或偏低(巴特综合征病人RAAS系统被激活,血浆内肾素、醛固酮增高,但因大量水、钠、氯、钾的丢失而造成血压正常或稍降低)。符合上述两项者可临床确诊。而伴有低血镁、高尿镁及低尿钙的病人,需要考虑为Gitelman综合征的可能;肾活检及肾功能的检测也可以辅助巴特综合征的诊断,但尚不能作为诊断巴特综合征的必要条件;
由于巴特综合征是一种由基因突变引起的遗传性疾病,目前尚无有效的根治方案。对于巴特综合征的治疗的主要目标是纠正持续性的顽固性低钾、低氯血症、代谢性碱中毒等来提升病人的生活质量。经静脉补充容量和电解质可快速缓解重症病人的症状。病情缓解后或病情较轻的病人也需长期口服补钾药物,联合保钾利尿剂对于巴特综合征的治疗也是必要的[9],该类药物可减少钾的丢失且对水、钠影响较小[10]。前列腺素合成酶抑制剂如吲哚美辛(消炎痛)等,可减少前列腺素合成,降低肾素、血管紧张素及醛固酮的活性,升高血钾,改善症状,其可单用也可联合保钾利尿剂使用。
综上所述,在临床拟诊为巴特综合征时,有条件者应积极进行基因检查以明确诊断。此外,对该病高危风险家系进行产前诊断是预防疾病再发的重要措施[11],本病例中,该病人虽然尚无子女出生,但因该病人为CLCNKB突变基因的纯合子,对其未来子女相关的产前诊断是有必要的。
