Wnt/β-catenin信号通路调控Sp5机制的研究进展
2019-05-23刘涛宋庆高
刘涛,宋庆高
特异性蛋白-5(Specificity protein-5,Sp5)的C-末端为81 个氨基酸组成的3 个Cys2His2 锌指结构,与许多基因启动子中富含GC/GT的区域结合以介导转录的发生[1]。在转录因子特异性蛋白(Specificity protein,Sp)家族中,其成员Sp1~Sp9 主要以锌离子结合的形式发挥作用,体现在基因调控、细胞分化和胚胎发育等方面。Sp5作为Sp家族成员之一,含有5个T 细胞因子/淋巴增强因子复合物(T cell factor/lymph enhancement factor complex,TCF/LEF)结合位点,以介导 Wnt/β-catenin 信号通路对 Sp5 的直接调控[2]。通常,在正常成熟细胞中,Wnt 信号通路处于关闭状态。而当Wnt 信号通路被激活时,胞质中的β-catenin将以核易位的形式进入细胞核与TCF/LEF结合,结合后启动Wnt信号途径,进而激活靶基因的转录。Wnt/β-catenin 信号通路在调节细胞增殖、胚胎发育和干细胞自我更新等多种过程中起着至关重要的作用[3]。Sp5 作为经典 Wnt/β-catenin 信号通路的下游位点,不仅在细胞增殖、分化等方面有着重要的调控作用,还可能成为肿瘤治疗过程中潜在的生物学靶点[4]。现就Wnt/β-catenin-Sp5通路在组织胚胎发育、腭裂形成、肿瘤发生和不孕症中的调控作用进行综述,以期为疾病的防治及进一步的研究提供一定的思路。
1 Wnt/β-catenin通路调控Sp5在胚胎发育中的作用
1.1 在胚胎干细胞中的作用 胚胎干细胞(embryonic stem cell,ESCs)是从早期胚胎或原始性腺中分离出的细胞,在体外培养时具有无限增殖和多向分化的特性。研究发现,Sp5 维持小鼠ESCs 自我更新的机制与白血病抑制因子(leukemia inhibitory factor,LIF)和转录激活子3(STAT3)的调控有关[5]。Sp5 作为 LIF 和 STAT3 的下游靶基因,与其下游Nanog 启动子结合,从而促进小鼠ESCs 的自我更新。Sp5促进ESCs自我更新的作用在很大程度上依赖于锌指结构域,完整的锌指结构域是Sp5 介导Nanog表达和维持小鼠胚胎干细胞多能性必不可少的结构[6]。关于Sp5 的上游信号通路,Ye 等[7-8]发现 LIF-STAT3 和 Wnt/β-catenin 信号通路都可以在Sp5上聚合,激活LIF-STAT3-Sp5或Wnt/β-catenin-Sp5 信号通路可促进小鼠胚胎干细胞的自我更新。可见,Wnt/β-catenin-Sp5-Nanog信号通路对ESCs的增殖可能有一定的促进作用。因此,了解ESCs自我更新的机制有助于研发培养ESCs的新条件,从而衍生出真正的ESCs。
此外,Sp5 的表达在文昌鱼胚胎发育过程中也有所体现,Dailey 等[9]研究发现,Sp5 在从受精卵至神经胚的发育过程中对Wnt/β-catenin 信号有动态反应,胚胎早期β-catenin信号的激活可引起原肠胚后期Sp5 的普遍表达。糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)作为Wnt 信号通路中的负调控因子,与肠腺瘤息肉蛋白(adenomatous polyposis coli,APC)和轴蛋白(Axin)等构成蛋白降解复合物,促进了β-catenin磷酸化而降解,使Wnt 信号通路处于沉默状态。 1 -Azakenpaullone(Azk)是GSK3β 的抑制剂,当Azk 发挥功能时,其通过影响蛋白降解复合物的形成而进一步抑制胞质中β-catenin 的磷酸化,使β-catenin进入胞核内积聚,从而激活了Wnt/β-catenin信号通路。Wnt/β-catenin 通路激活后,理论上表达量应增加的Sp5 却在原肠胚后期发生了下降,原因可能是Wnt/β-catenin-Sp5信号通路中存在负反馈环,也可能是胚胎发育过程中Sp5 发生了异位表达,从而使原肠胚后期Sp5表达量下降。
1.2 在多能干细胞中的作用 多能干细胞(pluripotent stem cell,PSC)具有分化出多种细胞组织的潜能,在器官再生、修复和疾病治疗方面极具应用价值。研究发现,Sp5对人PSC的正确分化至关重要。Huggins 等[10]通过染色质免疫沉淀和测序等方法,检测出 Sp5 是 Wnt/β-catenin 信号通路调控人PSC发育过程中的重要靶点,而且Sp5对人PSC中的Wnt转录程序具有负性调控作用,原因可能是Sp5通过抑制由Wnt/β-catenin 信号通路激活的其他基因的表达而发挥作用,如Sp1。此外,Weidinger等[11]在对斑马鱼的研究中发现,Sp5是Wnt8/β-catenin信号通路在中胚层和神经外胚层形成过程中的直接靶点,而且Sp5 对神经中胚层干细胞的自我更新和分化也有着重要的调节作用[12]。因此,了解 Wnt/βcatenin-Sp5在胚胎发育过程中的调控作用有助于为细胞形态发生的机制提供一定的理论依据。
2 Wnt/β-catenin通路调控Sp5在组织发育中的作用
2.2 在脑组织发育中的作用 Sp5在小鼠脑的发育中也有所表达,主要体现在胚胎7.25(Embryonic Day 7.25,ED7.25)至ED10.5这个时期[17]。ED8.0时,Sp5在中脑和间脑中以微弱的原位杂交信号为特点出现表达;ED8.5 时,Sp5 表达水平在中脑和间脑背外侧区域变得非常强,在间脑中,Sp5表达同时出现在前顶盖和上皮组织的区域;ED9.5时,中脑背侧区仍有Sp5表达,但在ED10.0—ED10.5之间逐渐消失;ED10.0 时,Sp5 开始在中脑被盖区表达;与中脑不同,间脑前顶盖的外侧和腹侧区域也表达Sp5,至少在 ED10.5 之前表达。关于 Sp5 与 Wnt/β-catenin 信号通路,Fujimura等[13]研究发现,小鼠端脑中激活经典 Wnt/β-catenin 信号通路可促使 Sp5 表达上调,表明Wnt/β-catenin-Sp5 通路也可能在脑的发育过程中有着重要的作用,然而其具体机制尚不清楚。
3 Wnt/β-catenin通路调控Sp5在疾病发生中的作用
3.1 在腭裂形成中的作用 小鼠腭突在ED11.5 时开始发育,至ED17.0 前完成,这个阶段中任何环节的错误均可能导致腭裂的发生[18]。近年来,本课题组在研究锌与小鼠腭突发育关系时发现,缺锌喂养者子代小鼠双侧腭板垂直向生长且不能正常融合,从而导致腭裂发生[19];通过差异基因的筛选发现,在ED14.5 时,缺锌组中Sp5-mRNA 表达量比常锌组(30 mg/kg)高约2.23 倍,比富锌组(100 mg/kg)高约6.78倍(图1),其中常锌组和富锌组子代小鼠双侧腭板融合较好[20]。可见Sp5与腭发育可能存在一定的关联,推测Sp5 在腭的发育中起负性调节作用[21]。关于腭突发育的信号通路,有研究发现,Wnt/βcatenin 通路相关基因发生异常可导致腭裂的发生。为研究腭裂相关 Wnt 基因,Menezes 等[22]和 Vijayan等[23]通过采集临床病例对照(腭裂病人和正常者),对其相关的11 个Wnt 基因和33 个单核苷酸多态性(single-nucleotide polymorphisms,SNPs)进行检测,结果发现 Wnt3 rs142167、GSK3B rs1331459、APC rs448475 等基因多态性与唇腭裂显著相关,表明Wnt/β-catenin 通路可直接调控腭的发育过程。然而,母体缺锌时是否通过Wnt/β-catenin信号通路的异常激活引起Sp5 发生高表达,从而导致腭裂的形成,其机制尚不清楚。
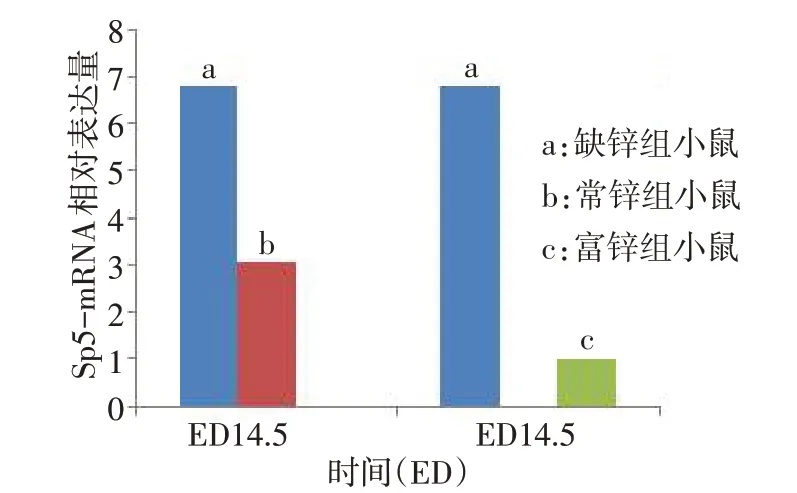
Fig.1 Comparison of Sp5-mRNA expression between zinc deficiency group,normal zinc group and zinc-rich group at ED14.5图1 ED14.5时缺锌组与常锌组及富锌组Sp5-mRNA表达对比
3.2 在肿瘤形成中的作用
3.2.1 在消化系统肿瘤中的作用 结直肠癌是常见的消化道恶性肿瘤。Takahashi 等[24]先采用半定量RT-PCR的方法对结直肠癌组织和其相应的非癌性黏膜中的Sp5 进行检测,结果发现6例癌组织中均检测到Sp5高表达;随后,通过免疫组织化学染色技术检测结直肠癌肿瘤细胞和基质细胞中Sp5 的表达,结果显示10 个结直肠癌组织中9 个癌细胞的细胞核有高水平的显色,而在基质细胞和非癌性上皮细胞中染色较弱。Herbst 等[25]也发现 Sp5 在几个结直肠癌细胞系中的表达普遍上调。然而,Miyamoto等[26]发现,在结直肠癌细胞株HCT116 中,Sp5 的表达未被上调,原因可能是Sp5 具有上调细胞周期抑制因子P27,从而抑制HCT116细胞增殖的潜力。尽管如此,大多数学者仍认为在这种病理状态(如癌症)下,Sp5表达通常会被上调[27]。Takahashi等[24]利用cDNA 微阵列技术证实了Sp5 是与Wnt/β-catenin信号通路相关的基因。为进一步检测β-catenin 是否在结直肠癌中积累,Mologni等[28]利用病毒shRNA介导沉默了β-catenin、免疫球蛋白转录因子2(ITF2)和鼠类肉瘤病毒癌基因(KRAS),发现结肠肿瘤细胞的增殖率分别减少了88%、72%和45%;联合阻断β-catenin 和ITF2 或 KRAS,对肿瘤细胞的增殖产生了更明显的抑制作用,说明Wnt/β-catenin信号表达与肿瘤细胞的增殖呈正相关。 关于FLYWCH1,它是一种新型的核β-catenin 抑制剂。Muhammad等[29]发现,过表达的FLYWCH1通过结合胞核内未被磷酸化的β-catenin,有效抑制了Wnt/βcatenin 传导的转录活性,选择性阻断了与结直肠癌细胞形态和迁移有关的下游基因表达,增加了钙黏素介导的细胞附着,抑制了结直肠癌细胞的转移。除结直肠癌外,Wnt信号异常激活也可能导致胃癌、食道癌和肝细胞癌的发生[30-32]。Evason等[33]通过转基因技术和微阵列分析也发现,转基因组通过特异性激活β-catenin促进了斑马鱼肝癌的发生。
3.2.2 在乳腺癌中的作用 为了更好地了解乳腺癌发生的机制,Chen 等[34]将 Sp5 转入未检测到内源性Sp5 表达的乳腺癌细胞系MCF-7 中,结果促进其显著生长,表明Sp5 对乳腺癌细胞的生长具有明显的促进作用。Hoverter 等[35]研究发现,Sp5通过抑制细胞周期抑制因子p21的表达,促进了人乳腺癌MCF-7 细胞的生长。关于信号通路,Khramtsov 等[36]研究发现,Wnt 信号通路的激活是基底样乳腺癌的主要特征之一,也是乳腺癌较低生存率的表征。Lamb等[37]也发现,与正常细胞相比,乳腺癌干细胞中的Wnt 信号通路被异常激活,进一步抑制Wnt 信号通路,结果显示乳腺癌干细胞的活性降低。因此,调控Wnt/β-catenin-Sp5 通路在乳腺癌靶向治疗中有着一定的潜力。
3.3 在不孕症中的作用 人的生殖发育主要体现于优质胚胎是否能在良好的子宫内膜上顺利着床,在这个过程中,药物干预可以促进胚胎细胞与子宫内膜细胞的黏附。黄芩苷是从中药黄芩中提取的一种黄酮类单体,具有改善哺乳动物生殖的功能。张玉梅等[38]研究发现,黄芩苷通过活化 Wnt/βcatenin-Sp5信号通路,使Sp5表达水平显著升高,高表达的Sp5 通过解除Sp1 对人子宫内膜细胞岩藻糖基转移酶Ⅳ(FUT4)的抑制作用,提高了人子宫内膜细胞FUT4的蛋白表达水平,从而促进子宫内膜细胞与胚胎细胞的黏附。这一研究理论促进了辅助生殖技术的发展,并为不孕症的诊断和治疗提供了理论基础和新的思路。
4 总结与展望
综上所述,Wnt/β-catenin-Sp5 信号通路仅是复杂调控网络中的一个分支,在干细胞的维护、细胞增殖、凋亡及肿瘤的形成过程中发挥了重要的作用。然而,Wnt/β-catenin-Sp5 信号通路在调节机体的发育过程中可能具有双面性:一方面在细胞诱导和细胞黏附中表现出积极的促进作用,另一方面却在腭突发育及肿瘤细胞形成中发挥了负性调控作用。目前,关于Sp5的报道仍然较少,其具体分子机制仍需要大量实验去研究。总之,Sp5 可能是多种疾病预防和诊断的生物学标志物,对Wnt/β-catenin-Sp5通路的及时调控可能为防治肿瘤的转移、腭裂及其他先天性疾病的发生提供新的思路和治疗方法。
