慢病毒介导CK18基因沉默对人乳腺癌BT549细胞增殖、凋亡和侵袭能力的影响
2019-05-23张青黄钱张春燕刘晓燕曾凡才甘淋
张青,黄钱,张春燕,刘晓燕,曾凡才,甘淋△
乳腺癌(breast cancer,BC)是女性最常见的恶性肿瘤,是全球女性癌症死亡的第二大病因[1]。研究显示,2018年美国BC 患者发病率和死亡率较以往仍持续升高[2]。目前,临床乳腺癌诊疗标志物有雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、癌胚抗原(CEA)、糖类抗原153(CA153)、细胞角蛋白19片段(CYFRA-21)和药物作用靶点人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)等,这些生物标志物对于指导乳腺癌的临床诊疗过程能起到一定的作用,联合多项检测的诊断性能优于单项标志物检测,但其敏感性和特异性均不高,所以寻找和筛查乳腺癌早期的分子诊断标志物和药物作用靶点对提高BC早期筛查率和治疗效果尤为重要。CK18是细胞角蛋白的一种亚型,参与细胞的形成、增殖、凋亡、运动等过程[3]。研究显示,CK18 在肺癌、膀胱癌、肝癌等多种肿瘤中表达异常,提示CK18 可能参与了肿瘤细胞的发生、发展过程[4]。本研究旨在探讨CK18基因表达降低对人乳腺癌BT549细胞增殖、细胞凋亡、细胞周期以及肿瘤细胞侵袭运动等功能的影响,分析其潜在的分子作用机制,以期为乳腺癌个体化治疗提供参考。
1 材料与方法
1.1 细胞株和主要试剂 人乳腺癌BT549 细胞由西南医科大学基础医学院生物化学与分子生物学教研室提供,胎牛血清(FBS)购自Bovogen公司,RPMI-1640购自赛默飞世尔仪器有限公司,胰酶、细胞周期检测试剂盒购自碧云天生物技术有限公司,无内毒素质粒提取试剂盒购自北京天根生化科技有限公司,CK18 一抗购自Bioworld 生物科技有限公司,山羊抗兔二抗购自CST 公司,BD 细胞凋亡试剂盒[Phycoerythrin(PE)和7-Amino-Actinomycin(7-AAD)]、CCK-8试剂盒购自东仁化学科技(上海)有限公司,Transwell 小室购自Costar 公司,聚凝胺(Polybrene)购自北京索莱宝科技有限公司。
1.2 细胞培养 人乳腺癌BT549 在含10% FBS 的RPMI-1640培养基,于37 ℃、5%CO2条件下培养至对数生长期。
1.3 慢病毒载体构建及鉴定 使用GeneCopoeraTM公司合成的人CK18基因的重组慢病毒质粒进行实验。其干扰靶点序列:CK18shRNA-21:5'-GACCATGCAAAGCCTGAACGA-3';CK18shRNA-22:5'-GCAAAATCCGGGAGCACTTGG-3';CK18shRNA-23:5'-GCTCCGCAAGGTCATTGATGA -3';CK18shRNA-24:5'-CCAAGATCATGGCAGACATCC -3';CK18shRNA-con:5'-GCTTCGCGCCGTAGTCTTA-3'。
1.4 质粒提取和病毒包装 将成熟质粒转化200µL新鲜制备的DH5α 感受态细胞,37 ℃振荡培养过夜,按照无内毒素质粒提取试剂盒说明书(北京天根生化科技有限公司)提取质粒。根据Lenti-PacTMHIV 表达包装试剂盒说明书进行慢病毒包装及病毒滴度测定。
1.5 BT549感染及分组 胰酶消化对数生长期BT549细胞,按3×105个/孔接种于6 孔板中,待细胞融合度为30%~50%时,分别加入CK18shRNA-con、CK18shRNA-21、CK18shRNA-22、CK18shRNA-23、CK18shRNA-24 的病毒进行感染,24 h后更换全培养基。感染48 h后,使用终浓度为5 mg/L的嘌呤霉素进行筛选。以未转染人乳腺癌细胞BT549 为空白对照(Wt)组,以转染空载体为阴性对照(sh-Con)组,以转染CK-18慢病毒载体为CK18-shRNA组,分别记为CK18-sh21、CK18-sh22、CK18-sh23 及CK18-sh24组,以CK18靶向优化shRNA干扰序列最优者为后续实验组。
1.6 Western blot 检测CK18、E-cadherin、vimentin 和 GAPDH的表达 收集对数生长期细胞,抽提蛋白。按40µg 蛋白含量进行上样,10%SDS-PAGE 蛋白分离后,PVDF 膜 100 V 转膜1 h,5%脱脂奶粉封闭2 h,CK18 抗体(1∶500)、E-cadherin(1∶500)、vimentin(1∶500)和 GAPDH(1∶10 000)4 ℃摇床过夜;洗膜3次后加入二抗孵育1 h;荧光显影,采集蛋白条带图像后采用IPP 6.0软件进行计算分析。
1.7 CCK-8 实验检测细胞增殖情况 按试剂盒操作说明书,将细胞按5×103个/孔均匀接种于96 孔板,分别设3 个复孔,培养24 h、48 h、72 h 时,每孔加入10 µL CCK-8,37 ℃孵育1 h,测定450 nm波长处光密度(OD)值。
1.8 平板克隆形成实验检测细胞增殖情况和独立生存能力 取对数生长期细胞,制备单细胞悬液,细胞按200 个/孔接种于6孔板中,14 d后去除培养基,4%多聚甲醛固定,0.1%结晶紫染色后用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤,显微镜观察(×40)、计数。
1.9 流式细胞仪检测细胞凋亡 按试剂盒说明书,待Wt组、sh-Con组和CK18-shRNA组细胞均生长至对数生长期,进行消化,1 200 r/min 离心10 min 收集细胞,用流式缓冲液重悬后,分别加入5µL PE Annexin V和5µL 7-AAD混匀,室温避光孵育15 min,流式细胞仪双染检测细胞凋亡率变化。
1.10 流式细胞仪检测细胞周期 按试剂盒操作说明书,将处于对数生长期的Wt组、sh-Con组和CK18-shRNA组细胞消化并收集,-20 ℃预冷12 h,70%乙醇-20 ℃固定4 h,洗涤后加入500µL碘化丙啶染色液,重悬细胞,避光孵育30 min,流式细胞仪上机检测。
1.11 划痕实验 将BT549 细胞接种于6 孔板中,当细胞贴壁面积达到80%时,用枪尖在孔板中央进行划痕处理,确保划痕处无多余细胞,加入培养基继续培养。光镜拍照记录划痕0 h、24 h和48 h的图像,应用Image-Pro Plus 6.0软件分别测量 0 h、48 h 划痕宽度 D0h和 D48h,计算 Wt组、shCon组和CK18-shRNA组细胞的迁移率。迁移率=(D0h-D48h)/D0h×100%。
1.12 Transwell细胞运动和侵袭实验 Transwell细胞运动实验按文献[5]进行,取2×104个细胞/孔加入Transwell上室,下室中加600µL的含20%FBS的培养液,37 ℃培养。12 h后去除上室细胞,4%多聚甲醛固定,0.1%的结晶紫染色,晾干后拍照并计数。细胞侵袭实验:除Transwell 上室需预先用Matrigel 基质胶进行包被后方可加入细胞,余步骤同运动实验。
1.13 统计学方法 采用SPSS 20.0 统计学软件进行数据分析。符合正态分布的计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1CK18干扰人乳腺癌BT-549细胞株的建立和鉴定 Wt组、sh-Con组、CK18-sh21组、CK18-sh22组、CK18-sh23组、CK18-sh24组的 CK18/GADPH 相对表达水平分别为(0.149±0.020)、(0.157±0.013)、(0.056±0.007)、(0.157±0.013)、(0.040±0.009)和(0.046±0.010),其中CK18-sh21组、CK18-sh23组、CK18-sh24组与 Wt组、shCon组比较差异有统计学意义(n=6,F=66.186,P<0.05),CK18-sh23组干扰效果最佳,相对于shCon组抑制率可达73%,而Wt组、shCon组和CK18-sh22组差异无统计学意义(P>0.05),见图1。后续实验均选择CK18-sh23 实验组细胞进行操作。

Fig.1 Western blot results of CK18 expressions in six groups图1 Western blot检测各组细胞中CK18蛋白的表达
2.2CK18沉默对BT549 细胞增殖的影响 CCK-8法检测结果:CK18-sh23组在24、48、72 h时OD值均小于Wt组和sh-Con组(P<0.05),而Wt 和sh-Con组差异无统计学意义(P>0.05),见表1。平板克隆形成实验结果:Wt组、sh-Con组和CK18-sh23组的细胞克隆形成数量分别为(115.000±5.000)个、(107.000±7.550)个和(78.333±7.638)个(n=3,F=23.838,P<0.05),其中,CK18-sh23组细胞克隆形成数量较Wt组、sh-Con组明显减少(P<0.05),而Wt组和sh-Con组差异无统计学意义(P>0.05)。
2.3 稳定干扰CK18基因后对BT549 细胞凋亡和周期的影响CK18-sh23组细胞凋亡率及G2/M 期比例均高于 Wt组和 sh-Con组(P<0.05),而 Wt组与sh-Con组比较差异无统计学意义,见表2。
Tab.1 Effects of lentivirus infection on proliferation of BT549 cells by CCK-8 assay表1 CCK-8法检测感染慢病毒后BT549细胞增殖能力影响(n=3,OD值,±s)
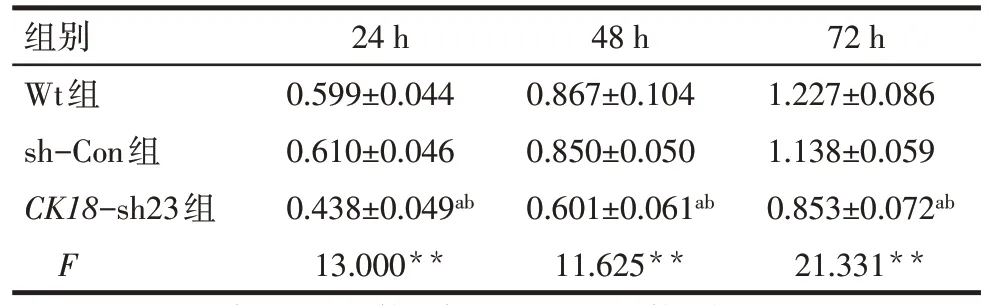
Tab.1 Effects of lentivirus infection on proliferation of BT549 cells by CCK-8 assay表1 CCK-8法检测感染慢病毒后BT549细胞增殖能力影响(n=3,OD值,±s)
**P<0.01;a与Wt组比较,b与sh-Con组比较,均P<0.05
组别Wt组sh-Con组CK18-sh23组F 24 h 0.599±0.044 0.610±0.046 0.438±0.049ab 13.000**48 h 0.867±0.104 0.850±0.050 0.601±0.061ab 11.625**72 h 1.227±0.086 1.138±0.059 0.853±0.072ab 21.331**
Tab.2 Effects of CK18 silencing on cell apoptosis and cell cycle in BT549 cells表2 CK18沉默对BT549细胞凋亡和细胞周期的影响(n=3,±s)

Tab.2 Effects of CK18 silencing on cell apoptosis and cell cycle in BT549 cells表2 CK18沉默对BT549细胞凋亡和细胞周期的影响(n=3,±s)
**P<0.01;a与Wt组比较,b与sh-Con组比较,均P<0.05
组别Wt组sh-Con组CK18-sh23组F凋亡率(%)6.500±0.500 7.300±0.819 14.767±1.168ab 81.939**G2/M期(%)14.333±2.843 15.833±1.012 23.233±4.908ab 6.155*
2.4 稳定干扰CK18后BT549 细胞迁移能力的变化 与Wt组和sh-Con组细胞比较,CK18-sh23组细胞的迁移率显著下降(P<0.05),而Wt组和sh-Con组细胞迁移率无明显差异;Transwell 实验亦显示,CK18-sh23组细胞运动和侵袭能力显著低于Wt组和sh-Con组(P<0.05),见图2、3和表3。
Tab.3 Changes of migration and invasion ability of BT549 cells after transfection表3 感染后BT549细胞运动和侵袭能力的变化(n=3,±s)
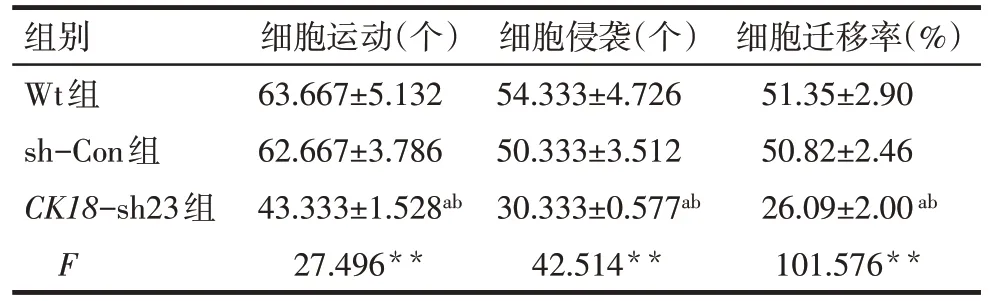
Tab.3 Changes of migration and invasion ability of BT549 cells after transfection表3 感染后BT549细胞运动和侵袭能力的变化(n=3,±s)
**P<0.01;a与Wt组比较,b与sh-Con组比较,均P<0.05
组别Wt组sh-Con组CK18-sh23组F细胞运动(个)63.667±5.132 62.667±3.786 43.333±1.528ab 27.496**细胞侵袭(个)54.333±4.726 50.333±3.512 30.333±0.577ab 42.514**细胞迁移率(%)51.35±2.90 50.82±2.46 26.09±2.00ab 101.576**
2.5 Western blot检测各组E-cadherin和vimentin结果 与 sh-Con组和 Wt组比较,CK18-sh23组 E-cadherin 蛋白相对表达水平升高、vimentin 蛋白相对表达水平明显降低(P<0.05);sh-Con组和Wt组间2种蛋白相对表达水平差异均无统计学意义,见图4、表4。
3 讨论
CK18 在食管癌、肝癌和胃癌等中表达上调,提示其参与多种肿瘤的发生、发展过程,且与这些肿瘤的预后有关[6-8]。在胃癌中,CK18 的高表达与肿瘤的淋巴结转移密切有关,并且预示着更低的总体生存率[8]。然而,另有研究发现,在前列腺癌中CK18表达显著下调,可促进肿瘤的侵袭,认为其与肿瘤的不良预后有关[9]。故CK18 在不同癌症中发挥的作用仍未明确。人乳腺癌BT549 为三阴性乳腺癌细胞,具有高度的侵袭和转移能力,且此细胞株中CK18 高表达,故选择此细胞系进行CK18基因敲除实验。
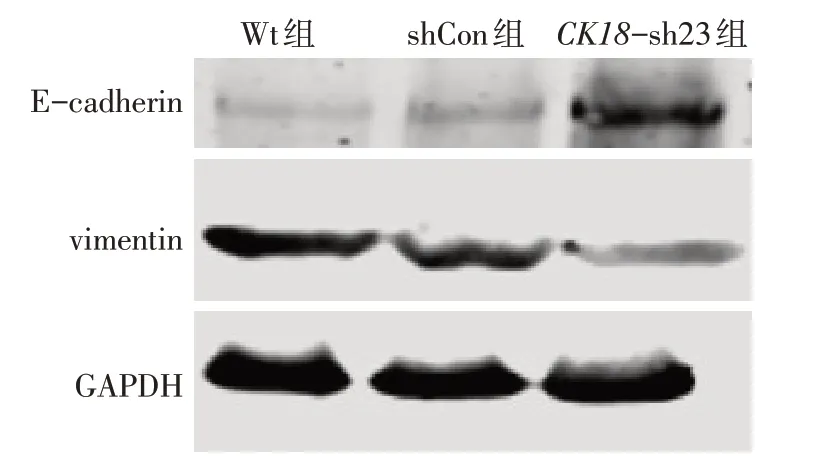
Fig.4 Western blot results of E-cadherin and vimentin expression in breast cancer BT549 cells after CK18 silencing图4 Western blot检测CK18沉默对乳腺癌BT549细胞中E-cadherin和vimentin蛋白表达影响
Tab.4 Relative expression of target protein after CK18 silencing表4 沉默CK18表达后目的蛋白的相对表达量(n=3,±s)
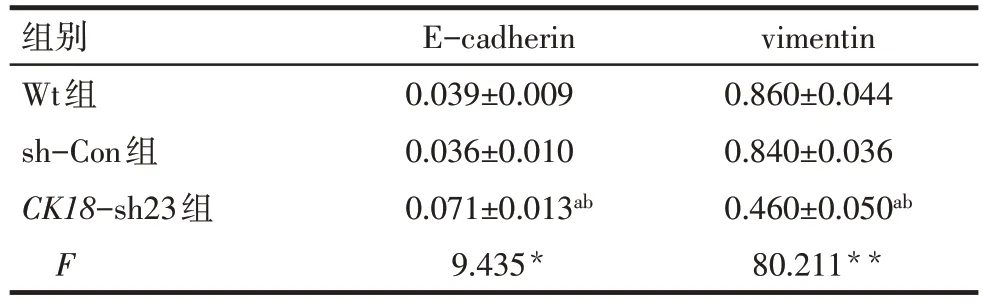
Tab.4 Relative expression of target protein after CK18 silencing表4 沉默CK18表达后目的蛋白的相对表达量(n=3,±s)
**P<0.01;a与Wt组比较,b与sh-Con组比较,均P<0.05
组别Wt组sh-Con组CK18-sh23组F E-cadherin 0.039±0.009 0.036±0.010 0.071±0.013ab 9.435*vimentin 0.860±0.044 0.840±0.036 0.460±0.050ab 80.211**
本实验构建了靶向CK18基因慢病毒载体,并通过其病毒颗粒感染BT549 细胞,且相对于sh-Con组,CK18-sh23组CK18表达抑制率可达 73%,筛选出了CK18表达沉默的稳定转染细胞株。本研究CCK-8 法显示,CK18-sh23组在 24 h、48 h、72 h 时OD 值均小于Wt组和sh-Con组,平板克隆形成实验示CK18-sh23组细胞克隆形成数量较Wt组、sh-Con组明显减少,提示沉默CK18基因的表达,可时间依赖性地抑制BT549 细胞的生长增殖,这与师锐赞等[10]认为CK18表达下调可抑制人乳腺癌MCF-7细胞增殖的结果相一致。同时本研究中CK18-sh23组的凋亡率及G2/M 期比例明显高于Wt组和sh-Con组,与乳腺癌[11]、肝癌[12-13]中CK18研究结果一致,即CK18 的表达能延迟肝癌细胞的凋亡,沉默CK18能促进乳腺癌细胞的凋亡和影响肝癌细胞的周期进展。
CK18不仅参与维持细胞的完整性和生长过程,还在调节细胞迁移转移方面发挥着重要的作用。研究发现,敲低人肺癌细胞中CK18基因表达,可抑制细胞的运动和迁移能力[5]。本实验也证实,较sh-Con组,CK18-sh23组穿越 Transwell 小室和 Matrigel胶的细胞数明显减少,表明沉默CK18基因表达可抑制BT549细胞的运动和侵袭能力,提示CK18可能在乳腺癌BT549 细胞的侵袭转移过程中发挥一定的作用。
上皮-间质转化(EMT)是肿瘤微环境调控癌细胞转移的最重要的机制[14]。其中上皮标志物E-cadherin 和间质性标志物vimentin 是EMT 重要的分子标志物。有研究发现,在乳腺上皮细胞中CK18可促进转移生长因子β1(TGF-β1)介导的smad2/3 的磷酸化,上调snail 和slug 的表达,促进EMT 的发生[15]。然而,另有研究发现,在人肺癌 H1975 和Calu-3细胞中CK18呈低表达,虽然其会降低肿瘤细胞的迁移,但不影响E-cadherin 和vimentin 的表达,提示CK18 没有经过EMT 调控肺癌细胞的侵袭过程[5]。本实验结果显示,较sh-Con组,CK18-sh23组中E-cadherin 表达上调,vimentin 表达下调,提示CK18 可能通过EMT 参与了乳腺癌BT549 细胞的侵袭运动过程,但具体的分子机制仍有待深入研究。
综上所述,CK18 表达在调控乳腺癌细胞增殖、凋亡、周期和侵袭过程中起着重要的作用;CK18 通过EMT 参与了BT549 细胞的侵袭转移。本课题不足之处在于未对CK18参与EMT的一些信号通路进行研究,后续研究将重点关注CK18可能通过影响哪些下游因子的表达影响乳腺癌侵袭转移的分子机制,以期为乳腺癌个体化治疗提供更多依据。

Fig.2 Effects of CK18 silencing on motility ability in breast cancer BT549 cells(×40)图2 沉默CK18基因表达对乳腺癌BT549细胞迁移能力的影响(×40)
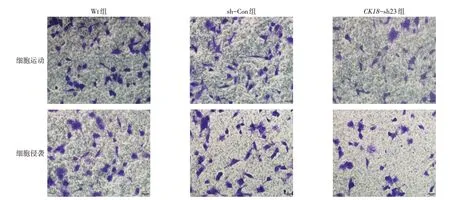
Fig.3 Effects of CK18 silencing on invasion ability in BT549 cells(crystal violet staining,×200)图3 沉默CK18基因表达对乳腺癌BT549细胞运动能力和侵袭能力的影响(结晶紫染色,×200)
