商陆皂苷甲对MRL/lpr小鼠iTr35细胞及其相关细胞因子表达的影响
2019-05-23王幸曾慧林张祥贵汤杰印
王幸,曾慧林,张祥贵,汤杰印
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)严重并发症之一,也是其死亡的主要原因。目前认为LN的发病主要是肾脏细胞增殖与凋亡失衡(表现为增殖过度,凋亡不足)所致[1]。商陆皂苷甲(esculentoside A,EsA)是从中药商陆中提取出的主要成分之一,具有抗炎、免疫调节、抑制细胞增殖和促凋亡的作用[2]。课题组前期研究发现EsA 能显著改善LN 小鼠的尿蛋白及肾脏病理表现,随后对其机制进行探讨,发现EsA 可抑制辅助性 T 细胞 17(T helper cell 17,Th17)的分化,从而降低白细胞介素(IL)-17 的表达,抑制IL-17 诱导的肾小球系膜细胞增殖[3-7]。iTr35(CD4+Foxp3-IL-12p35+IL-27EBI3+)细胞是最新发现的调节性T细胞亚群,由IL-35诱导人或小鼠初始T细胞转变而成,具有强大的免疫抑制功能[8-9],通过分泌特征性细胞因子IL-35发挥作用。IL-35是IL-12家族成员之一,由p35 亚基和EB 病毒诱导基因3(Epstein-Barr virus-induced gene3,EBI3)亚基组成的异源二聚体(IL-12p35/IL-27EBI3),在体内外均可抑制 Th17 细胞的分化,减少 IL-17 的分泌[10-11]。课题组前期体外实验发现EsA 对IL-17 有抑制作用,因此,本次实验以MRL/lpr 狼疮肾炎模型小鼠为研究对象,观察EsA 对MRL/ipr 小鼠体内IL-35、IL-17及iTr35表达的影响,从体内实验进一步证实EsA对IL-17的作用,明确EsA对IL-17的抑制是否通过IL-35来调节。
1 材料与方法
1.1 实验材料 (1)实验动物。16周龄雌性MRL/lpr小鼠24只,体质量(25±2)g,由美国Jackson 实验室提供,动物许可证:SCXK(苏)2016-0010。(2)药品与试剂。商陆皂苷甲(纯度>98%,编号SE8230)、HE 染色试剂盒(编号G1120)、Masson 染色试剂盒(编号G1345)购自北京索莱宝科技有限公司;RPMI 1640 培养液(编号TBD724000)购自武汉华联科生物技术有限公司;IL-12p35单克隆抗体(编号MAB1570)购自R & D公司;尿蛋白检测试剂盒(编号CO35-2)、肌酐测定试剂盒(编号CO11-2)购自南京建成生物科技有限公司;IL-35酶联免疫吸附试验(ELISA)试剂盒(编号MU33024)、IL-17 ELISA 试剂盒(编号MU30074)购自武汉贝茵莱生物科技有限公司;APC anti-mouse CD4(编号110412)购自BioLegend公司;Anti-Mouse FOXP3 FITC(编号8341250100)购自Biogems公司;IL-12 p35 单克隆抗体FITC(编号MA5-23683)、IL-27单克隆抗体PE(编号MA5-23651)购自Invitrogen公司。
1.2 方法
1.2.1 动物分组与给药 取16周龄MRL/lpr小鼠24只,采用随机数字表法将小鼠分为模型对照组、EsA组和EsA+IL-12p35抗体组,各8只。模型对照组每日腹腔注射RPMI 1640培养液 0.2 mL,共 4 周;EsA组腹腔注射 EsA 溶液(20 mg·kg-1·d-1)0.2 mL,共 4 周;EsA+IL-12p35 抗体组腹腔注射 EsA溶液(20 mg·kg-1·d-1)0.2 mL,共4周,在首次注射EsA溶液后注射IL-12 p35 抗体(2.5 mg/kg)1 次。所有小鼠在 SPF 条件下的独立通风笼中饲养,室内温度、湿度恒定,定期更换无菌笼具、垫料和饮用水等。根据体质量调整饮食量,自由进水。
1.2.2 尿蛋白/肌酐值检测 实验结束后用按压膀胱法收集尿液,考马斯亮蓝(CBB)法检测尿蛋白浓度、肌氨酸氧化酶法检测尿肌酐浓度,计算尿蛋白/肌酐比值。
1.2.3 血肌酐检测 实验结束后,采用眼球摘除法收集血液,静置4 h,1 500 r/min 离心15 min,取上清,备用。采用肌氨酸氧化酶法检测血肌酐浓度,用酶标仪测定各样本波长546 nm处光密度(OD)值A1和A2,将A1、A2带入公式计算肌酐浓度=[(测定A2-K×测定A1)-(空白A2-K×空白A1)]×标准品浓度/[(标准A2-K×标准A1)-(空白A2-K×空白A1)],其中稀释因子K=186/246,具体步骤参照说明书进行。
1.2.4 血清IL-35、IL-17检测 采用ELISA方法检测小鼠血清IL-35、IL-17,具体步骤按照试剂盒说明书进行。
1.2.5 流式细胞术检测外周血iTr35细胞比例 采用全血计数法,将小鼠全部处死后取外周血,经体外刺激[丙二醇甲醚醋酸酯(PMA)20µg/L、离子霉素(Ionomycin)1 mg/L],2µmol/L莫能菌素(Monensin)作为蛋白转运抑制剂,37 ℃、5%CO2下孵育6 h,以CD4-APC和Foxp3-FITC设门,固定、破膜,经IL-12p35-FITC、IL-27EBI3-PE 抗体染色 30 min,检测 CD4+Foxp3-IL-12p35+IL-27EBI3+(iTr35)细胞比例,染色结束后,上流式分析仪进行流式检测,使用Flow Jo软件进行分析。
1.2.6 肾脏病理染色 小鼠处死后,提取肾组织,固定12 h后,脱水、常规石蜡包埋、切片,厚度为4µm,进行HE、Masson染色,观察肾脏病理改变情况。
1.3 统计学方法 应用SPSS 21.0 统计软件进行统计分析,符合正态分布的计量资料用均数±标准差(±s)表示,多组样本均数间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠尿蛋白/肌酐值、血肌酐、IL-35、IL-17水平比较 3组小鼠尿蛋白/肌酐值、血肌酐浓度、IL-35及IL-17均有不同程度的改变,其中模型对照组尿蛋白/肌酐值、血肌酐浓度及IL-17含量最高,其次为EsA+IL-12p35抗体组,EsA治疗组小鼠含量最低(P<0.05);模型对照组IL-35 含量最低,其次为EsA+IL-12p35 抗体组,EsA 治疗组小鼠 IL-35 含量最高(P<0.05),见表1。
2.2 各组小鼠外周血iTr35细胞比例比较 与模型对照组(0.064%±0.041%)相比,EsA组(0.398%±0.077%)小鼠外周血iTr35 细胞比例明显升高(P<0.05);经IL-12p35抗体干预后,EsA+IL-12p35抗体组iTr35 比例(0.140%±0.027%)较EsA组下降,但仍高于模型对照组(n=8,F=87.695,P<0.01),见图1。
2.3 各组肾脏病理表现 模型对照组小鼠肾脏病理特点为肾小球系膜细胞及系膜基质增生,毛细血管腔被增生的细胞填满,毛细血管腔闭塞,符合弥漫增生性肾小球肾炎病理改变;此外肾小球周围可见大量炎性细胞浸润,部分可见肾小球硬化及新月体形成。经 EsA 治疗后,EsA组和 EsA+IL-12p35 抗体组系膜增生有所减轻,毛细血管开放增多,炎细胞浸润减少,2组小鼠均未见新月体形成,3组间肾小管无明显变化,见图2。
Tab.1 Comparison of the urine protein/urine creatinine,serum levels of creatinine concentration,IL-35 and IL-17 between the three groups表1 各组MRL/lpr小鼠治疗后尿蛋白/肌酐值、血肌酐浓度、IL-35及IL-17水平比较 (n=8,±s)
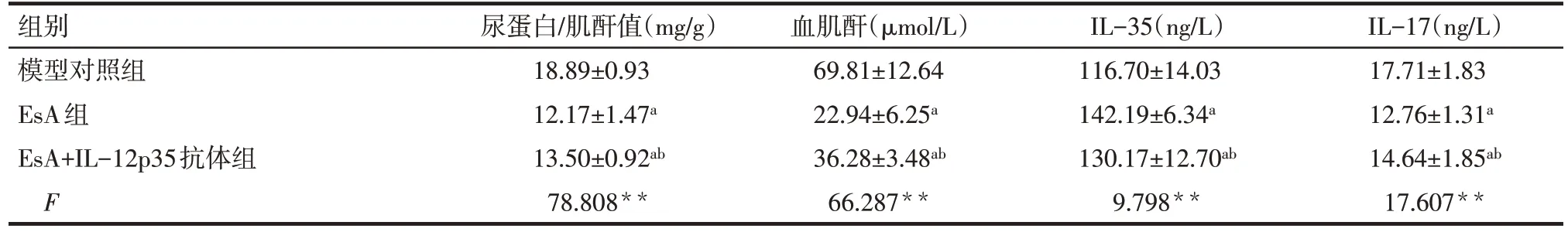
Tab.1 Comparison of the urine protein/urine creatinine,serum levels of creatinine concentration,IL-35 and IL-17 between the three groups表1 各组MRL/lpr小鼠治疗后尿蛋白/肌酐值、血肌酐浓度、IL-35及IL-17水平比较 (n=8,±s)
**P<0.01;a与模型对照组比较,b与EsA组比较,P<0.05
组别模型对照组EsA组EsA+IL-12p35抗体组F尿蛋白/肌酐值(mg/g)18.89±0.93 12.17±1.47a 13.50±0.92ab 78.808**血肌酐(µmol/L)69.81±12.64 22.94±6.25a 36.28±3.48ab 66.287**IL-35(ng/L)116.70±14.03 142.19±6.34a 130.17±12.70ab 9.798**IL-17(ng/L)17.71±1.83 12.76±1.31a 14.64±1.85ab 17.607**

Fig.1 Proportion of iTr35 detected by flow cytometry in three groups图1 流式细胞术检测iTr35在各组中的比例
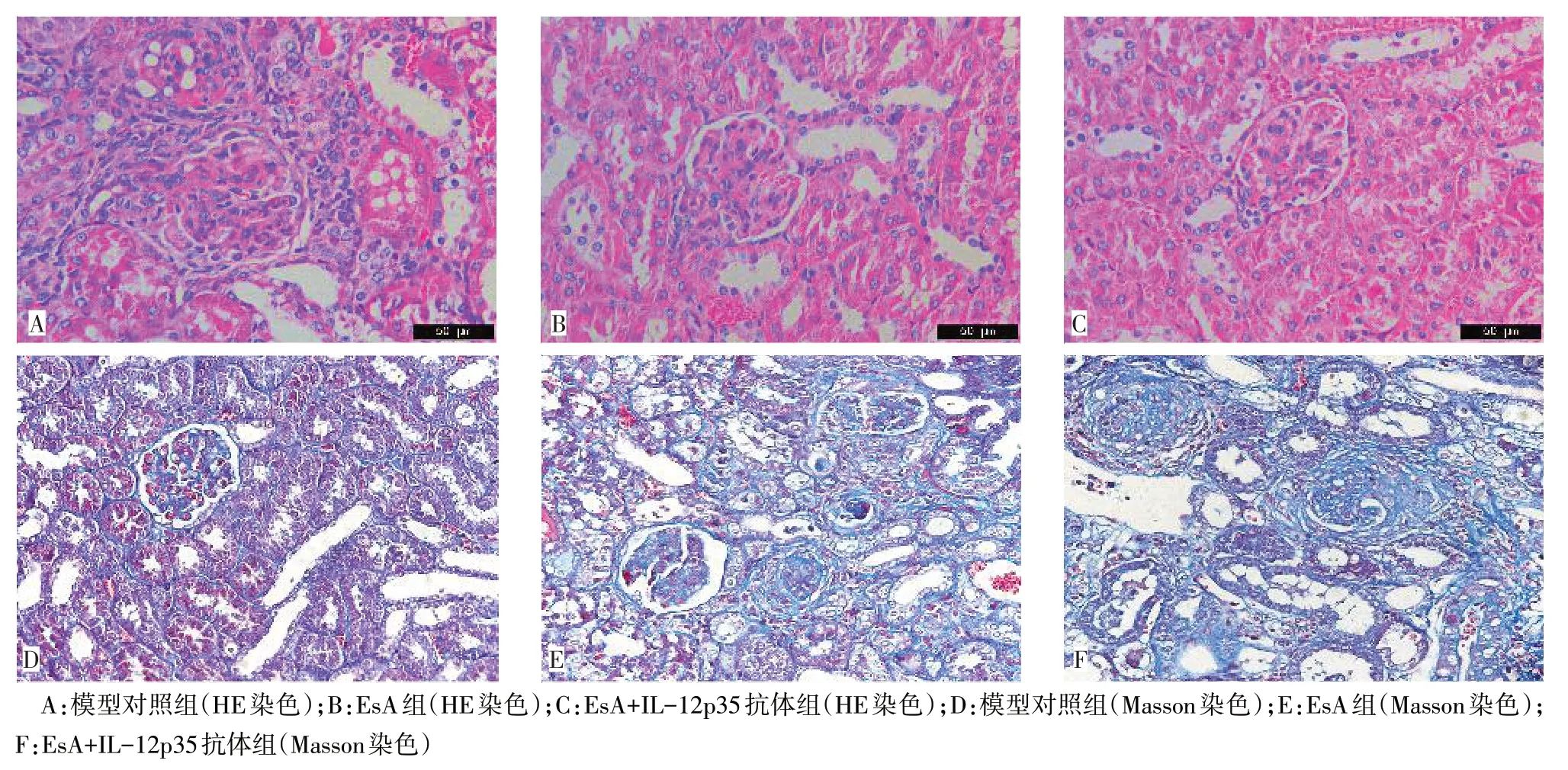
Fig.2 Pathological changes of renal tissues in three groups of mice(×400)图2 各组小鼠肾组织病变情况(×400)
3 讨论
3.1 EsA 对MRL/lpr 小鼠尿蛋白、血肌酐的影响 SLE 是一种以产生自身抗体为特征,从而导致多器官损害的自身免疫性疾病,肾脏是主要受累器官之一,肾功能恶化是引起病情进展及死亡的重要因素。SLE 患者体内存在T 淋巴细胞功能失调,以致抗原不断出现,并在CD4+T 细胞的刺激下引起B细胞持续活化,产生自身抗体,与抗原结合后形成免疫复合物,通过血液循环沉积于肾脏,导致LN 的发生。因此,调节T细胞亚群的紊乱、减少自身抗体的产生对改善LN患者的预后具有重要意义。MRL/lpr小鼠是自发性系统性红斑狼疮小鼠模型之一,最早8 周发病,16 周出现以严重蛋白尿为特征的肾功能退化,50%小鼠于24 周死亡,其发病无性别优势[12-13]。为此,我们选取 16 周龄的雌性 MRL/lpr 小鼠为研究对象,20 周龄为实验终点符合实验需要。尿蛋白是评估肾脏病变的重要指标,本实验随机尿蛋白/肌酐值是临床上尿蛋白定量检测方法之一,具有快速、简便、精确等优点,能够可靠地反映并替代传统的24 h尿蛋白定量检测。治疗终点对3组小鼠进行尿蛋白/肌酐值、血肌酐浓度检测发现,与模型对照组相比,EsA治疗组小鼠尿蛋白/肌酐值、血肌酐浓度明显下降,经IL-12p35 抗体阻断后,EsA+IL-12p35 抗体组尿蛋白/肌酐值、血肌酐浓度下降程度不及EsA 治疗组,3组尿蛋白/肌酐值及血肌酐浓度水平与既往研究结果相近[14-16]。上述结果说明EsA可减少MRL/lpr 小鼠尿蛋白及血肌酐浓度,改善肾功能,经IL-12p35 抗体阻断后,由于IL-35 合成减少,导致其疗效减弱,使得两指标浓度较EsA组上升,推测EsA 对MRL/lpr 小鼠的治疗疗效可能与IL-35有关。
3.2 EsA对MRL/lpr小鼠外周血IL-35、IL-17、iTr35表达的影响 IL-35是新近发现的抑制性细胞因子,参与多种自身免疫性疾病的发病,在体内外均可抑制炎性细胞因子IL-17的表达。iTr35是IL-35诱导人或小鼠初始T细胞转化而成的一种具有较强免疫抑制功能的、且不依赖FOXP3 的新型FOXP3-Treg,即“iTr35 细胞”,通过分泌IL-35 发挥免疫抑制作用[17]。本研究结果表明,MRL/lpr 小鼠存在 IL-35、IL-17 数量及外周血iTr35 细胞比例的异常,模型对照组小鼠IL-35 表达水平和外周血iTr35 细胞比例最低,而IL-17水平最高,经EsA治疗后,EsA组小鼠的 IL-35 水平及 iTr35 细胞比例明显上升,IL-17 则显著减少,说明EsA可上调IL-35表达,诱导iTr35生成,抑制IL-17的分泌。为了观察EsA对IL-17的抑制是否通过IL-35 调控,笔者用IL-12p35 抗体阻断IL-35 的合成,发现EsA+IL-12p35 抗体组小鼠血清IL-35 表达较EsA组减少,但仍高于模型对照组,此时IL-17水平较EsA组增加,说明EsA对IL-17的抑制作用可通过IL-35来调控。
3.3 EsA 对MRL/lpr 小鼠肾脏病理改善情况 肾脏病理是诊断狼疮性肾炎及分型的“金标准”。本研究发现,3组小鼠肾脏病理表现存在不同程度的改变,其中模型对照组肾脏病变最为严重,主要表现为肾小球系膜细胞增生,经EsA治疗后,其病理表现可得到一定的改善,进一步证实了EsA 对狼疮性肾炎的治疗作用。
综上所述,EsA 可显著改善LN 小鼠模型尿蛋白、血肌酐及肾脏病理情况,其机制可能与上调IL-35表达、诱导iTr35细胞生成有关。但其中的因果关系并不明确,可能存在3种情况:一是EsA直接上调IL-35的表达,IL-35诱导iTr35分泌,从而导致iTr35增多;二是EsA 诱导iTr35 细胞的生成,iTr35 再分泌更多的IL-35发挥作用;三是EsA可对IL-35及iTr35均产生作用,EsA对两者的调控机制如何,还需进一步实验研究证实。但可以肯定的是,EsA可通过IL-35 调控IL-17,进而发挥药理作用,减少IL-17 的分泌,减轻炎症反应,缓解LN的病情。
