无义突变与“遗传补偿效应”
2019-05-21马志鹏陈军
马志鹏,陈军
无义突变与“遗传补偿效应”
马志鹏,陈军
浙江大学生命科学学院,生命系统稳态与保护教育部重点实验室,杭州 310058
“遗传补偿效应”(genetic compensation response, GCR)是近年来在斑马鱼()中最先描述的一个遗传现象,是指当敲低某一个基因时有明显的表型,但此基因的敲除遗传突变体由于其他基因的上调反而没有表型。这种基因敲低和敲除表型上的差异并非斑马鱼所独有,在拟南芥()、小鼠()等模式生物中都观察到此种现象。这种奇怪的现象一直困扰着基因功能研究。2019年4月3日,同时在线发表两篇论文揭示了其中的奥秘,其中一篇来自于本实验室,另一篇来自于德国Stainier实验室。利用斑马鱼或小鼠培养细胞的不同基因的遗传突变体为模型,两个实验室分别证明无义突变与核酸序列同源性是激活遗传补偿效应的两个先决条件;无义mRNA介导的降解途径参与激活遗传补偿效应;同时还观察到补偿基因的高表达与其转录起始位点处的组蛋白H3K4me3修饰相关。本文具体介绍了这两篇研究论文中提出的“遗传补偿效应”分子机制的异同,以期为克服遗传补偿效应给基因功能研究带来的障碍提供新的思路和方法。
遗传补偿效应;无义mRNA介导的降解途径;表观遗传学修饰
生命中的遗传物质DNA时时刻刻都会受到损伤的威胁,这些威胁有来自于内在的因素,如细胞分裂、正常细胞代谢产生的活性氧;也有来自于外在因素,如紫外及离子辐射、化学诱变剂等。每个细胞的基因组DNA每天会遇到差不多104次损伤。DNA损伤会产生基因上的变异,这些变异在生命进化中扮演着重要的角色。但其中很多变异会使编码蛋白的基因失去功能,如果变异的基因功能非常重要,机体又不采取措施,它就不能存活,就失去了生命的意义。为了存活,机体就进化出许多机制来应对基因突变这一状况,其中之一就是“遗传补偿效应”(genetic compensation response, GCR)[1,2],即某一基因发生突变彻底失去功能后,机体会采取相应的机制,提高其他基因的表达来代替这一基因的功能,从而能够正常发育存活。但是,其背后的分子机制是什么?在此之前,还不得而知。2019年4月3日,同期在线发表两篇论文:一篇来自于本实验室,另一篇来自于德国马普研究所Stainier实验室,同时对此机制进行了探讨[3,4]。本文将根据这两篇论文所报道的研究结果解读遗传补偿效应的分子机制。
1 无义mRNA降解途径
DNA损伤会造成多种类型的基因突变,包括错义突变、缺失突变、无义突变、染色体重排等。其中最严重的类型之一就是无义突变,即提前终止密码子突变(premature termination codon, PTC)。在细胞中,基因的表达受到严格的监控。如果无义突变的mRNA继续翻译成蛋白质,将会产生一个比正常野生型蛋白短一些的蛋白,通常这种短蛋白不仅没有功能,反而在很多情况下会对细胞产生显性负的作用。因此,真核生物进化了一个mRNA质量监控体系,即无义mRNA介导的降解途径(nonsense mRNA mediated decay pathway, NMD)[5,6],就是当某个基因发生无义突变时,该基因转录出来的无义mRNA就会被NMD降解途径识别,并带到核外进行降解,以消除翻译短蛋白对机体带来的副作用。在NMD降解途径中,首先上游移码蛋白Upf3b与外显子拼接复合体(exon-junction complex, EJC)结合,进一步招募Upf1和Upf2,然后在细胞质中介导无义mRNA降解[7~10]。有意思的是,进化上与Upf3b蛋白高度同源的上游移码蛋白3a (Upf3a)同样可以与EJC结合,但在无义mRNA降解中作用并不明显[11]。那么无义mRNA降解途径是否参与基因补偿效应,是否存在新的生理功能?在这两篇论文发表之前还没有明确答案。
2 多个斑马鱼遗传突变体具有遗传补偿效应
几年前,本实验室在研究斑马鱼一个钙调蛋白酶Capn3a时观察到采用寡聚吗啉代核苷酸(morpholino)抑制蛋白翻译敲低该基因,斑马鱼胚胎会出现小肝脏表型[12]。为了进一步研究基因在肝脏发育中的功能,我们运用TALEN方法[13]构建了一个基因敲除突变体:突变后的转录本在第60个密码子出现终止密码子,即无义突变。令人疑惑的是,突变体发育正常,没有表现出小肝脏的表型。因此,我们推测突变可能激活“遗传补偿效应”。通过检测该突变体中19个capn家族基因的表达,发现多个家族基因上调,同时还证明突变体无表型是由于这些家族基因上调弥补其功能所致[4]。Stainier实验室发现、、和等基因敲除也会激活相应的遗传补偿效应。两个实验室根据各自的遗传突变体分别探讨了遗传补偿效应的分子机制,得出了相似但又有不同的结论,下面将逐一讨论。
3 无义突变与核酸序列同源性是激活遗传补偿效应的必要条件
为了证实是否只有无义突变才能激活补偿效应,本实验室采用CRISPR/Cas9方法构建了多个遗传突变体携带不同类型的突变,如:同框缺失突变(缺失序列长度是3倍数);不同位置无义突变;提前终止密码子在最后一个外显子上的突变。在另一项研究中,Stainier实验室采用同样的技术路线也获得了不同类型的遗传突变体,如:同框缺失突变;提前终止密码子在最后一个外显子上的突变体;启动子缺失突变体。两个实验室针对不同基因遗传突变体的分析结果同时显示只有无义突变才能激活遗传补偿效应。
此外,我们观察到在补偿基因和无义突变基因之间存在着核酸序列的同源性。基于这些结果,我们提出了一个假设即无义突变mRNA通过提高同源基因的表达来实现补偿效应。如果这个假设是正确的,那么具有这些特点的转基因也能激活内源基因的表达。于是我们设计了不同的转基因载体,利用这些载体构建了一系列转基因斑马鱼。结果显示,只有同时携带提前终止密码子(无义突变)和核酸同源序列的转基因载体才能诱导提高内源同源基因的表达。Stainier实验室通过转录本测序,发现在分别敲除、和等基因的小鼠细胞系中也会出现相应同源基因上调的现象;在斑马鱼中,他们采用体外注射的方法,证明只有注射与内源基因同源无帽结构的RNA才可以激活相应内源基因的上调。斑马鱼和小鼠的实验结果揭示无义突变与核酸序列同源性是激活遗传补偿效应的两个必要条件。
4 无义mRNA降解途径参与遗传补偿效应
既然只有无义突变才能诱导遗传补偿效应,NMD降解途径是目前已知的细胞内监控无义突变的唯一机制,那么NMD是否参与遗传补偿效应呢?我们在突变体中通过基因特异反义寡聚吗啉代核苷酸来分别敲低NMD降解途径中几个关键因子、、和,分析敲低这些基因对补偿基因表达的影响。为了进一步验证这些基因在遗传补偿效应中作用,我们利用CRISPR/Cas9方法构建、和突变体;在此基础上,与突变体杂交,获得各个基因与双敲除突变体。非常有意思的是,我们发现遗传补偿效应不需要参与无义突变mRNA降解的因子,如、和;相反,无论是敲低还是敲除功能尚未阐明的因子,都会阻止突变体中的遗传补偿效应,使其出现小肝脏的表型;同时,我们还利用另一个具有遗传补偿效应的基因突变体来验证这些NMD途径中的关键因子在遗传补偿效应中的作用,获得类似实验结果。这些实验数据充分证明,是参与遗传补偿效应的关键因子。但是与我们研究结果不同的是,Stainier实验室在、和等基因突变体的基础上敲除,发现遗传补偿效应降低,于是他们提出无义mRNA的降解过程参与了遗传补偿效应。综合两个实验室的结果可以得出这样结论:NMD途径参与了遗传补偿效应的激活。
5 遗传补偿效应与组蛋白修饰
综合上面的实验结果,接下来我们通过一系列的实验证明无义突变mRNA与以前想象的并不一样,一无用处,无义突变mRNA的转录翻译,以及它的完整性对于“遗传补偿效应”都是必需的。这些实验结果让我们联想到无义突变mRNA可能与一些长链非编码RNA (long non-coding RNA, lncRNA)有类似的功能,即与COMPASS (complex of proteins associated with Set1)复合体结合促进一些基因的表达。COMPASS复合体主要负责组蛋白3上第4位赖氨酸的三甲基化修饰(histone H3 lysine 4 trimethylation, H3K4me3),改变染色质结构,促进基因的表达[14~16]。为了证实这一联想,我们采用染色体免疫共沉淀技术(chromatin immunoprecipitation assay, ChIP)检测在补偿效应基因的启动子区域H3K4me3修饰的程度,发现在突变体中,H3K4me3修饰显著增加;并且,敲低会降低突变体中补偿效应基因启动子区域H3K4me3的修饰。最后,我们通过蛋白互作实验证明Upf3a可以直接与COMPASS复合体中类似于支架蛋白Wdr5结合;并且敲低或敲除,突变体的遗传补偿效应被阻断。这些实验结果充分显示补偿效应基因的启动子区域H3K4me3修饰在遗传补偿效应中起着重要的作用。
Stainier实验室发现在敲除基因的小鼠细胞系中,补偿效应基因的启动子区域H3K4me3修饰显著增加,敲低会削弱遗传补偿效应;同时,敲低也会降低相应补偿基因启动子区域的H3K4me3修饰。两个实验室同时证实遗传补偿效应与染色质的表观遗传学修饰密不可分。
6 结语与展望
根据以上两个实验室的研究结果,我们提出了“遗传补偿效应”的分子机制模型:转录后无义突变mRNA可以与Upf3b结合,在细胞质中通过NMD途径降解;同时,未降解的无义mRNA或降解后的片段都可以与Upf3a结合,在Upf3a蛋白的帮助下,这些RNA重新进入细胞核;Upf3a招募COMPASS复合体,在无义突变mRNA的帮助下,靶向与无义mRNA具有核酸序列同源性的基因附近,COMPASS复合体通过改变基因启动子区域表观遗传学修饰改变染色质构象,促进同源基因表达,弥补缺失基因的功能,完成补偿效应(图1)。
“遗传补偿效应”并不是斑马鱼所独有的现象,在其他模式生物中同样存在,如小鼠、拟南芥[17,18]。来自于不同实验室的人类基因组测序结果显示,在正常人群的基因组中存在着大量携带有纯合无义突变的基因,其中有些基因的错义突变会引起严重的人类遗传疾病[19,20]。我们推测“遗传补偿效应”是产生这一现象的重要原因。该研究发现不仅仅在理论上取得了大的突破,而且还有实践价值。例如,“遗传补偿效应”对机体存活具有重要意义,但对于基因功能研究是一个巨大的障碍。斑马鱼超过80%的基因被敲除后没有表型[21],所以很难研究这些基因的功能,这其中大部分是由于“遗传补偿效应”导致。针对这一问题,目前就可以根据这两项研究发现的机理,用不同方法阻断“遗传补偿效应”即可。比如,开展基因敲低实验或直接在相应的突变体中敲低/除Upf3a;同时在构建突变体时,尽量避免构建导致无义突变的突变体,如敲除基因启动子,以减少基因补偿效应的发生。
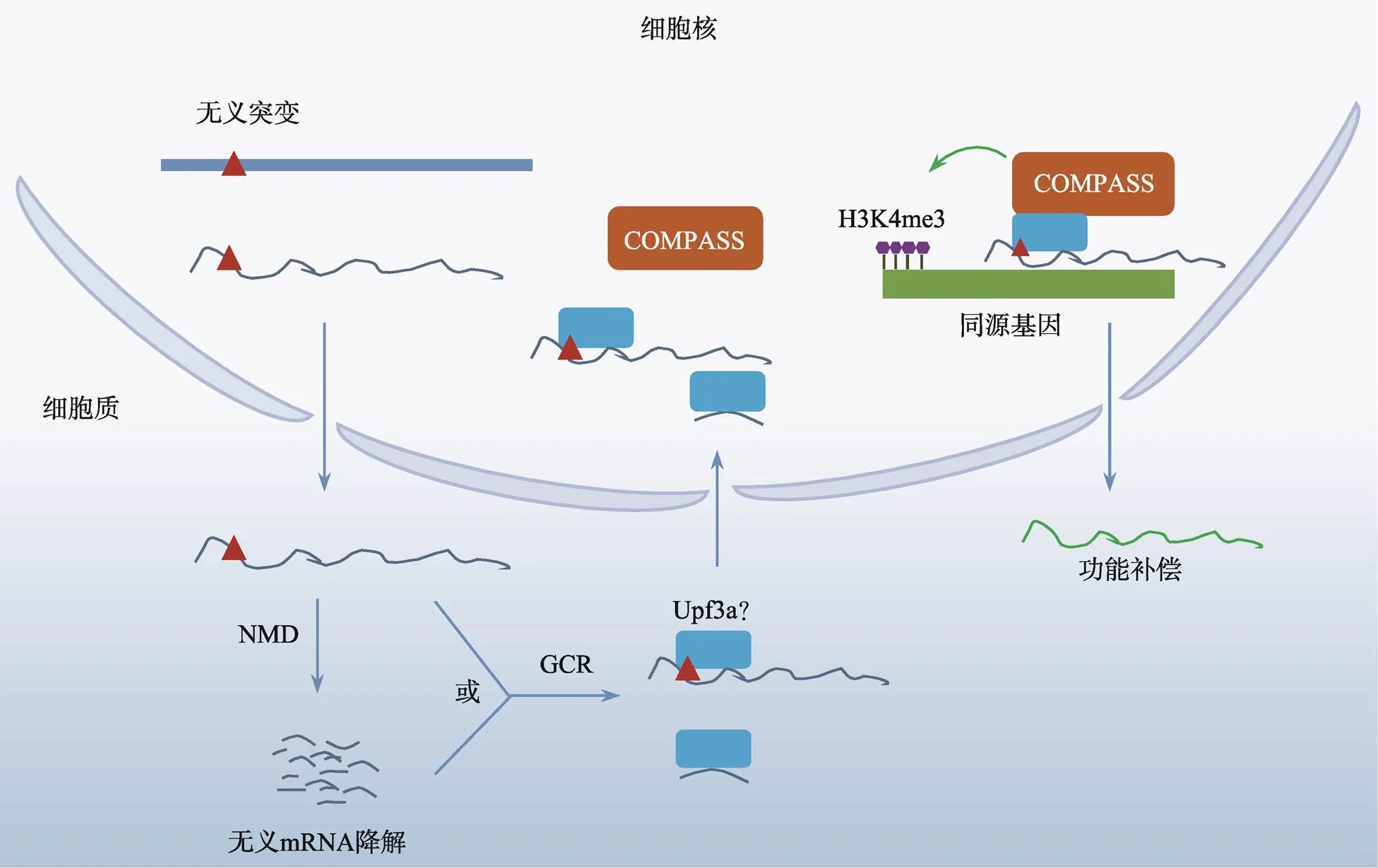
图1 无义mRNA介导的遗传补偿效应机制
NMD:无义mRNA介导的降解途径;GCR:遗传补偿效应;Upf3a:上游移码蛋白3a;COMPASS:与Set1蛋白结合的蛋白复合体;H3K4me3:组蛋白3第4位赖氨酸的三甲基化修饰。
[1] Zhu P, Ma Z, Guo L, Zhang W, Zhang Q, Zhao T, Jiang K, Peng J, Chen J. Short body length phenotype is compensated by the upregulation of nidogen family members in a deleterious nid1a mutation of zebrafish., 2017, 44(11): 553–556.
[2] Rossi A, Kontarakis Z, Gerri C, Nolte H, Hölper S, Krüger M, Stainier DY. Genetic compensation induced by deleterious mutations but not gene knockdowns., 2017, 524(7564): 230–233.
[3] El-Brolosy MA, Kontarakis Z, Rossi A, Kuenne C, Günther S, Fukuda N, Kikhi K, Boezio GLM, Takacs CM, Lai SL, Fukuda R, Gerri C, Giraldez AJ, Stainier DY. Genetic compensation triggered by mutant mRNA degradation., 2019, 568(7751): 193–197.
[4] Ma Z, Zhu P, Shi H, Guo L, Zhang Q, Chen Y, Chen S, Zhang Z, Peng J, Chen J. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components., 2019, 568(7751): 259–263.
[5] Chang YF, Imam JS, Wilkinson MF. The nonsense- mediated decay RNA surveillance pathway., 2007, 76: 51–74.
[6] Conti E, Izaurralde E. Nonsense-mediated mRNA decay: molecular insights and mechanistic variations across species., 2005, 17(3): 316–325.
[7] Lykke-Andersen J, Shu MD, Steitz JA. Human Upf proteins target an mRNA for nonsense-mediated decay when bound downstream of a termination codon., 2000, 103(7): 1121–1131.
[8] Kunz JB, Neu-Yilik G, Hentze MW, Kulozik AE, Gehring NH. Functions of hUpf3a and hUpf3b in nonsense- mediated mRNA decay and translation., 2006, 12(6): 1015–1022.
[9] Kim VN, Kataoka N, Dreyfuss G. Role of the nonsense- mediated decay factor hUpf3 in the splicing-dependent exon-exon junction complex., 2001, 293(5536): 1832–1836.
[10] Chan WK, Bhalla AD, Le Hir H, Nguyen LS, Huang LL, Gécz J, Wilkinson MF. A UPF3-mediated regulatory switch that maintains RNA surveillance., 2009, 16(7): 747–753.
[11] Shum EY, Jones SH, Shao A, Dumdie J, Krause MD, Chan WK, Lou CH, Espinoza JL, Song HW, Phan MH, Ramaiah M, Huang L, McCarrey JR, Peterson KJ, De Rooij DG, Cook-Andersen H, Wilkinson MF. The antagonistic gene paralogs Upf3a and Upf3b govern nonsense-mediated rna decay., 2016, 165(2): 382–395.
[12] Tao T, Shi H, Guan Y, Huang D, Chen Y, Lane DP, Chen J, Peng J. Def defines a conserved nucleolar pathway that leads p53 to proteasome-independent degradation., 2013, 23(5): 620–634.
[13] Shen Y, Xiao A, Huang P, Wang W, Zhu Z, Zhang B. TALE nuclease engineering and targeted genome modification., 2013, 35(4): 395–409.沈延,肖安, 黄鹏, 王唯晔, 朱作言, 张博. 类转录激活因子效应物核酸酶(TALEN)介导的基因组定点修饰技术. 遗传, 2013, 35(4): 395–409.
[14] Shilatifard A. The COMPASS family of histone H3K4 methylases: mechanisms of regulation in development and disease pathogenesis., 2012, 81: 65– 95.
[15] Hu D, Garruss AS, Gao X, Morgan MA, Cook M, Smith ER, Shilatifard A. The Mll2 branch of the COMPASS family regulates bivalent promoters in mouse embryonic stem cells., 2013, 20(9): 1093–1097.
[16] Hu D, Gao X, Cao K, Morgan MA, Mas G, Smith ER, Volk AG, Bartom ET, Crispino JD, Di Croce L, Shilatifard A. Not all H3K4 methylations are created equal: Mll2/COMPASS dependency in primordial germ cell specification., 2017, 65(3): 460–475.E6.
[17] De Souza AT, Dai X, Spencer AG, Reppen T, Menzie A, Roesch PL, He Y, Caguyong MJ, Bloomer S, Herweijer H, Wolff JA, Hagstrom JE, Lewis DL, Linsley PS, Ulrich RG. Transcriptional and phenotypic comparisons of Ppara knockout and siRNA knockdown mice., 2006, 34(16): 4486–4494.
[18] Gao Y, Zhang Y, Zhang D, Dai X, Estelle M, Zhao Y. Auxin binding protein 1 (ABP1) is not required for either auxin signaling or Arabidopsis development., 2015, 112(7): 2275–2280.
[19] Chen R, Shi L, Hakenberg J, Naughton B, Sklar P, Zhang J, Zhou H, Tian L, Prakash O, Lemire M, Sleiman P, Cheng WY, Chen W, Shah H, Shen Y, Fromer M, Omberg L, Deardorff MA, Zackai E, Bobe JR, Levin E, Hudson TJ, Groop L, Wang J, Hakonarson H, Wojcicki A, Diaz GA, Edelmann L, Schadt EE, Friend SH. Analysis of 589,306 genomes identifies individuals resilient to severe Mendelian childhood diseases., 2016, 34(5): 531–538.
[20] Narasimhan VM, Hunt KA, Mason D, Baker CL, Karczewski KJ, Barnes MR, Barnett AH, Bates C, Bellary S, Bockett NA, Giorda K, Griffiths CJ, Hemingway H, Jia Z, Kelly MA, Khawaja HA, Lek M, McCarthy S, McEachan R, O'Donnell-Luria A, Paigen K, Parisinos CA, Sheridan E, Southgate L, Tee L, Thomas M, Xue Y, Schnall-Levin M, Petkov PM, Tyler-Smith C, Maher ER, Trembath RC, MacArthur DG, Wright J, Durbin R, van Heel DA. Health and population effects of rare gene knockouts in adult humans with related parents., 2016, 352(6284): 474–477.
[21] Kok FO, Shin M, Ni CW, Gupta A, Grosse AS, van Impel A, Kirchmaier BC, Peterson-Maduro J, Kourkoulis G, Male I, DeSantis DF, Sheppard-Tindell S, Ebarasi L, Betsholtz C, Schulte-Merker S, Wolfe SA, Lawson ND. Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish., 2014, 32(1): 97–108.
Nonsense mutations and genetic compensation response
Zhipeng Ma, Jun Chen
The genetic compensation response (GCR) was firstly described in zebrafish to explain the phenotypic discrepancies between gene-knockout and gene–knockdown, whereby a deleterious mutation, but not gene-knockdown, can lead to the transcriptional upregulation of related genes, which can assume the function of the mutated gene. This phenomenon was also found in other model systems including mice and.However, the underlying molecular mechanism of the GCR remains elusive until two papers were published inon April 3, 2019: one from our lab and the other from Stainier’s lab. Using different genetic mutants of various genes in zebrafish or culture cells of mice, both of us reveal that the upregulation of compensatory genes is only triggered by mutations that generate a premature termination codon (PTC); the compensatory genes share nucleotide sequence homology to the mutated genes; nonsense mRNA mediated decay pathway (NMD) is essential for the induction of GCR, and the increased transcription of the compensatory genes is accompanied by an enhancement of H3K4 trimethylation (H3K4me3) at their transcription start site (TSS) regions.In this review, we summarize the mechanisms of the GCR proposed in the two studies.
genetic compensation response (GCR); nonsense mRNA mediated decay pathway (NMD); histone modification
2019-04-11;
2019-04-18
国家自然科学基金项目(编号:31571511,31871500)资助[Supported by the National Natural Science Foundation of China (Nos: 31571511, 31871500)]
马志鹏,在站博士后,研究方向:发育生物学。E-mail: singapore1987@163.com
陈军,博士,教授,研究方向:发育生物学。E-mail: chenjun2009@zju.edu.cn
10.16288/j.yczz.19-101
2019/4/23 17:05:01
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190423.1704.001.html
(责任编委: 张博)
