水分胁迫对小麦幼苗中活性氧与细胞死亡的影响
2019-05-14朱美琛马兴立张丽婷时明坤任永哲王志强林同保辛泽毓
朱美琛,马兴立,余 幸,张丽婷,高 翔,时明坤,任永哲,王志强,林同保,辛泽毓
(河南农业大学农学院/河南粮食作物协同创新中心/省部共建小麦玉米作物学国家重点实验室,河南 郑州 450002)
【研究意义】近年来,随着气候变化的波动加剧,作物生育期内降水量发生了很大变化,从而增加了干旱的发生频率和危害程度,加剧了对农业生产的不利影响[1-2]。【前人研究进展】干旱不仅导致植物遭受氧化胁迫、破坏组织器官内的膜脂、蛋白质和核酸等细胞成分,并可引起植株体内代谢紊乱[3]。通常情况下,干旱胁迫可诱导植株体内活性氧(ROS)的产生,例如超氧阴离子和H2O2等[4]。ROS可以引起膜脂过氧化并导致细胞死亡[5]。为了缓解ROS的伤害,植物会启动自身的酶促和非酶促抗氧化系统,例如SOD(超氧化物歧化酶)、CAT(过氧化氢酶)和POD(过氧化物酶)、脯氨酸等渗透调节物质,来缓解逆境胁迫对其的伤害[6]。此外,植物原生质膜透性对逆境反应则较为敏感,研究表明,植物遭受干旱胁迫后,可观察到膜透性明显增加,并且随着干旱胁迫加重,其膜损伤程度越严重,而细胞内的电解液浓度的积累则越高,关于水分胁迫引起植物膜损伤的现象已经被许多学者所证实[7]。同样,亦有报道指出,植物在遭受水分胁迫后,植株体内产生的活性氧参与了植物细胞程序性死亡的过程[8]。例如,James等人的研究表明干旱胁迫形成的超氧化物和H2O2的积累可能是引发植物细胞程序性死亡的原因[9]。【本研究切入点】尽管已有研究指出植物细胞中的膜脂过氧化产物、活性氧、渗透调节物质等的变化与植物的抗旱性密切相关,但是关于水分胁迫后不同基因型小麦的活性氧积累水平和相关渗透调节物质积累的变化结论并不统一。【拟解决的关键问题】因此,本试验拟选用强抗旱品种(旱选10号)和干旱敏感品种(郑引1号)为材料,研究水分胁迫对不同基因型小麦幼苗形态,细胞及相关生理生化指标的影响,以期为小麦的抗旱机制研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试品种 本实验选用旱选10号(强抗旱品种)和郑引1号(干旱敏感品种)作为供试材料。
1.1.2 小麦幼苗培养和试验设计 选取均匀一致的小麦种子,经过1 %的次氯酸钠消毒处理20 min,去离子水冲洗3~4遍后,浸泡12 h,首先将种子腹沟朝下均匀的摆在漂浮铁丝网上,置于清水中,在25 ℃黑暗培养箱中催芽3 d后,光照1 d,然后挑选长势一致的幼苗,移入光照培养箱中,采用1/2 Hoagland营养液中进行培养,光照培养箱温度22/18 ℃(白天/黑夜),光照/黑暗时间为14/10 h,每3 d更换1次营养液。待小麦幼苗生长到2叶1心期时,在20 % PEG-6000(-0.975 MPa)的营养液中进行模拟干旱处理。试验设为4个处理:CK-HX(正常供水的旱选10号)、PEG-HX(水分胁迫处理的旱选10号)、CK-ZY(正常供水的郑引1号)、PEG-ZY(水分胁迫处理的郑引1号)。并在处理后12 h,取小麦幼苗相同部位叶片和根系,进行各项指标的测定,每个处理3次生物学重复(叶片含水量为5个生物学重复)。
1.2 测定项目与方法
1.2.1 形态观察水分胁迫后12 h,进行拍照记录。
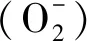
1.3 数据分析
数据均用Microsoft Excel 2010进行数据分析,以及SPSS19.0进行方差分析。
2 结果与分析
2.1 水分胁迫对不同基因型小麦幼苗生长和生物量的影响
在正常供水情况下,旱选10号和郑引1号幼苗长势及长相基本相同(图1)。但在水分胁迫后12 h,旱选10号幼苗与对照相比变化不大,而郑引1号幼苗则表现出明显的干旱胁迫症状,叶片失水明显,萎焉严重。与对照相比,在水分胁迫5 d后,旱选10号生物量下降幅度相对较小(图2),为12.1 %,而郑引1号则下降了36.3 %,达到极显著水平(P<0.01)。

图1 水分胁迫12 h对不同抗旱性小麦外观形态的影响Fig.1 Effects of water stress on appearance and morphology of different drought-resistant wheat cultivar after 12 hours

图2 水分胁迫12 h对不同抗旱性小麦生物量的影响Fig.2 Effects of water stress on biomass of different drought-resistance wheat cultivar after 12 hours
2.2 水分胁迫对不同基因型小麦幼苗叶片相对含水量及根系活力的影响
在正常供水条件下,2个品种幼苗的叶片相对含水量之间相差不大,且郑引1号含水量较旱选10号高,但水分胁迫后12 h,2个品种的叶片含水量均表现出降低的趋势,而郑引1号下降幅度达到极显著水平。与对照相比,旱选10号叶片含水量下降了1.8 %,而郑引1号则下降了5.2 %(图3)。此外,水分胁迫处理后,2个品种幼苗的根系活力均出现上升的趋势。但旱选10号上升幅度较大,与它的对照处理相比提高了110.7 %,在0.01的水平上,表现出极显著差异,而郑引1号虽也有提高,但提高幅度仅为88.5 %(图4)。
2.3 水分胁迫对不同基因型小麦幼苗叶片脯氨酸含量及叶片水分渗透势的影响
水分胁迫可明显增加2个不同基因型小麦的脯氨酸的含量,且旱选10号增加趋势显著高于郑引1号。与对照相比,水分胁迫下旱选10号小麦幼苗脯氨酸含量提高了76.7 %,而郑引1号则提高了45.2 %(图5)。水分胁迫后2个品种的叶片水分渗透势均表现出降低的趋势,但与郑引1号相比,旱选10号的下降幅度较小。其中,旱选10 号与对照相比下降了6.0 %,而郑引1 号则比对照处理下降了20.0 %(图6),方差分析表明,在0.01水平达到极显著水平。

图3 水分胁迫12 h对不同抗旱型小麦叶片相对含水量的影响Fig.3 Effects of water stress on relative water content in leaves of different drought-resistance wheat cultivar after 12 hours

图4 水分胁迫12 h对不同抗旱性小麦根系活力的影响Fig.4 Effects of water stress on root activity of different drought-resistance wheat cultivar after 12 hours

图5 水分胁迫12 h对不同抗旱性小麦叶片脯氨酸含量的影响Fig.5 Effects of water stress on proline content in leaves of different drought-resistance wheat cultivar after 12 hours

图6 水分胁迫12 h对不同抗旱性小麦叶片渗透势的影响Fig.6 Effects of water stress on osmotic potential in leaves of different drought-resistance wheat cultivar after 12 hours

图7 水分胁迫12 h后对不同抗旱性品种小麦叶片丙二醛含量的影响Fig.7 Effects of water stress on malondialdehyde content in leaves of different drought-resistance wheat cultivar after 12 hours
2.4 水分胁迫对不同基因型小麦幼苗叶片丙二醛(MDA)含量及相对电导率的影响
水分胁迫均可明显增加2个不同基因型小麦品种的MDA含量,但郑引1号增加量显著高于旱选10号。与对照相比,旱选10号的MDA含量提高了29.6 %,而郑引1号则增加了83.8 %(图7)。此外,水分胁迫后,2个不同基因型小麦品种的相对电导率含量也表现出上升的趋势,但郑引1号上升幅度显著高于旱选10号。与对照相比,旱选10号的相对电导率提高了39.8 %,而郑引则提高了77.3 %(图8)。
2.5 水分胁迫对不同基因型小麦幼苗氧化损伤的影响
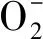

图8 水分胁迫12 h后对不同抗旱性小麦叶片相对电导率的影响Fig.8 Effects of water stress on relative electrical conductivity in leaves of different drought-resistance wheat cultivar after 12 hours
2.6 水分胁迫对不同抗旱性小麦幼苗叶片细胞死亡的影响
从图11可以看出,水分胁迫后2个不同基因型小麦品种的叶片均被染上不同程度的蓝色,但郑引1号染色程度更深,表明水分胁迫对郑引1号细胞伤害更为严重。正常水分下根尖部位被染成淡蓝色,而胁迫以后根尖的颜色逐渐偏深,而郑引1号的根尖颜色被染成深蓝色。

图9 水分胁迫12 h对不同抗旱性小麦叶片和根尖部位H2O2含量的影响Fig.9 Effects of water stress on H2O2content in leaves and root tips of different drought-resistance wheat cultivar after 12 hours

图10 水分胁迫12 h对不同抗旱性小麦叶片和根尖部位含量的影响Fig.10 Effects of water stress oncontent in leaves and root tips of different drought-resistance wheat cultivar after 12 hours

图11 水分胁迫12 h对不同抗旱性小麦叶片和根尖部位细胞死亡的影响Fig.11 Effects of water stress on cell death in leaves and root tips of different drought-resistance wheat cultivar after 12 hours
3 讨 论
干旱是影响小麦生长和发育的主要灾害之一[17],也是造成植物细胞膜系统受伤的重要原因[18],植物在受到干旱胁迫后会发生一系列形态和生理上的变化,但单一的生理指标很难准确的反应小麦的抗旱性,应结合其他的形态生理指标来综合鉴定和评价小麦的抗旱性[19]。
3.1 水分胁迫对不同抗旱性小麦幼苗生长及生物量的影响
研究表明,干旱胁迫可明显抑制小麦幼苗地上部的生长,从而导致幼苗干物质积累降低[20]。本试验结果同样表明,在水分胁迫后5 d,不同基因型小麦幼苗的长势均变慢,生物量均表现出下降的趋势,但与郑引1号相比,旱选10号干物质积累下降幅度相对较小。
3.2 水分胁迫对不同基因型小麦幼苗叶片相对含水量及根系活力的影响
植物体内的水分特征是植物在结构上对环境的响应,是植物耐旱和抗旱性的重要指标。叶片含水量的高低不仅反映了其代谢的强弱,也一定程度上反映植物在干旱胁迫下的吸水能力以及抵抗脱水的能力[14,21-22],更能直接反映作物生长发育的实际状况[23]。而植物根系则是吸收养分和水分的器官,也是同化、转化、合成养分的重要场所[24]。根系作为直接感受干旱胁迫的器官,对胁迫反应更加敏感,反应幅度大[25]。根系的生长发育和活力状况对于植物抵抗逆境至关重要[26]。本试验结果表明,水分胁迫均可导致两个不同基因小麦幼苗叶片失水萎焉,但旱选10 号的叶片含水量下降幅度则显著低于郑引1号。此外,水分胁迫均可提高两个不同基因型小麦幼苗根系活力,但与郑引1号相比,旱选10号幼苗根系活力上升幅度更为显著,这表明,抗旱品种可通过较强的根系活力来抵御水分胁迫对其自身的伤害。
3.3 水分胁迫对不同抗旱性小麦幼苗叶片脯氨酸含量及叶片水分渗透势的影响
干旱胁迫会造成植物体内迅速积累一种水溶性有机渗透调节物质脯氨酸,适应外界环境,保护细胞膜系统免受伤害。脯氨酸含量的增高则能够降低叶片细胞的渗透势,防止细胞脱水[27]。逆境胁迫条件下的渗透势降低值可以反映渗透调节能力的大小[14]。本实验结果表明,水分胁迫均可增加2个不同基因型小麦品种中的脯氨酸的含量。但旱选10号的脯氨酸增加更为明显,此外,水分胁迫均可降低2个不同基因型小麦品种叶片水分渗透势,但与旱选10号相比,郑引1号幼苗水分渗透势下降幅度相对较大。这表明,水分胁迫后,抗旱品种可通过快速积累脯氨酸和调节自身的渗透势水平来适应干旱,这与李德全等人的研究结果一致[28]。
3.4 水分胁迫对不同基因型小麦幼苗叶片丙二醛(MDA)含量及相对电导率的影响
丙二醛是植物抵抗逆境膜脂过氧化的产物,其含量的变化可以判断膜系统过氧化的程度,也可反映细胞膜受损的程度[29]。相对电导率,是植物对逆境胁迫的衡量标准之一,直接反应薄膜在逆境中的透性变化和组织的损伤程度[30]。本试验结果表明,在水分胁迫后12 h,郑引1号和旱选10幼苗叶片MDA的含量均有增加,但旱选10号增加幅度明显小于郑引1号;而水分胁迫后两个不同基因型小麦幼苗的相对电导率则表现为:郑引1号明显高于旱选10号,表明水分胁迫后干旱敏感品种的膜透性显著大于抗旱品种。
3.5 水分胁迫对不同基因型小麦幼苗氧化损伤与细胞死亡的影响
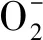
4 结 论
本研究结果表明,在水分胁迫下抗旱性较好的品种能够提高根系活力,增加对水分胁迫的适应性;很好地保持自身叶片含水量和维持细胞渗透势,具有较好的保水能力并保持一定的膨压;降低活性氧和MDA的含量,减缓细胞膜透性和降低膜脂过氧化程度,用来抵御逆境对植株自身的伤害,达到抵抗逆胁迫的目的。
