两种线栓法制作小鼠大脑中动脉栓塞模型的比较
2019-05-14王东亮王冬何天鹏赵婧高欣袁媛
王东亮 王冬 何天鹏 赵婧 高欣 袁媛
随着人们生活水平的提高,高血糖、高血脂、高血压已成为人类的常见疾病,由此导致的脑卒中患者的死亡率也逐年升高。据大数据显示,脑卒中是我国致残和致死的首要原因,目前脑卒中的治疗已成为基础和临床工作者的主要研究方向和热议话题[1]。为了更好的还原脑卒中的病理生理过程,在相应的基础研究中,如何准确选取实验动物制作可行有效的病理模型就极为重要。
由于大脑中动脉是引起脑卒中最为常见的闭塞部位,故大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)的动物模型被越来越多的科研工作者采纳[2]。目前最经典的缺血性脑损伤模型为线栓法制备的MCAO 模型[3]。1986 年Koizumi 等[4]首先报道了利用线栓法制备MCAO 模型,随后Longa 等[5]于1989 年在此方法上做了改进,现如今被广泛应用。目前常用的线栓途径有两种,颈总动脉插线和改良Longa 法颈外动脉插线,本实验拟通过颈总动脉和颈外动脉两种途径插线制备MCAO 模型,比较两种方法所制作模型的优劣,从而提高实验的精准度和可重复性。
材料与方法
一、实验材料
1.实验器材:显微镊、眼科剪、维纳斯剪、止血钳、自制拉钩、微动脉夹、小鼠固定器、缝合线(甘肃省人民医院设备管理处);小动物麻醉机及异氟烷麻醉气体(R520IE,R510-22-16)、台式双目体视显微镜(77001)、反馈式双通道术中体温维持系统(69020)(深圳市瑞沃德生命科技有限公司);术后保温箱(60 cm×40 cm×50 cm,上海玉研科学仪器有限公司),激光多普勒血流仪(潜流系统5000,Perimed,斯德哥尔摩,瑞典),线栓(6-0,L1800,广州佳灵生物技术有限公司),激光共聚焦显微镜(TCS SP8 STED 3X,Leica,德国)。
2.实验试剂:异氟烷麻醉气体(R510-22-16,深圳市瑞沃德生命科技有限公司),2,3,5-氯化三苯基四氮唑(T8877-25G,Sigma-Aldrich,美国),In Situ Cell Death Detection Kit,Fluorescein(11684795910,Roche,德国),0.9%氯化钠注射液(H12020010,中国大冢制药有限公司)。
3.实验动物:SPF 级C56BL/6 雄性小鼠42 只,体质量20~22 g,购自北京维通利华实验动物技术有限公司;实验动物生产许可SCXK(京)2016-0006;实验动物使用许可SYXK(甘)2015-0005。
二、实验方法
(一)动物分组
将42 只C57BL/6 小鼠随机分为假手术组(n=6)、颈外组(n=18)、颈总组(n=18)。动物饲养环境:温度(23℃±1℃),湿度(60%±5%),光照8:00~20:00,术前8 h 禁食禁水[6]。实验中有关动物的操作均严格按照相关实验动物应用规范,造模手术过程中尽量达到无菌操作,术中及术后苏醒期间维持小鼠肛温(37℃±0.5℃)[7]。
(二)模型的制备
1.麻醉:异氟烷诱导并吸入麻醉,颈部常规消毒备皮,采取颈部正中切口剪开皮肤,用显微镊钝性分离皮肤下肌肉层暴露颈动脉鞘,仔细分离右侧颈总动脉、颈外动脉、颈内动脉,注意避免触碰颈动脉鞘内的迷走神经。
2.颈总组模型制备:(1)颈总动脉近心端6-0 丝线结扎;(2)颈总动脉远心端靠近分叉处6-0 丝线活结固定;(3)结扎颈外动脉;(4)动脉夹夹闭颈内动脉;(5)在颈总动脉近心端结扎线与固定线栓的活结之间用维纳斯剪剪一小口,置入线栓,打开颈内动脉动脉夹,两手互相辅助操作使线栓沿颈内方向进入,固定线栓的结扎线勒紧;(6)再灌注时拔出线栓即可。具体信息见图1A。
3.颈外组模型制备:(1)颈总动脉6-0 丝线活结结扎固定;(2)颈外动脉远离分叉处6-0 丝线结扎;(3)颈外动脉靠近分叉处6-0 丝线活结固定;(4)动脉夹夹闭颈内动脉;(5)颈外动脉远离分叉结扎线与固定线栓的活结之间用维纳斯剪剪一小口,以远心至近心方向置入线栓,扎紧线栓固定结,电凝笔离断颈外动脉,调整线栓方向顺时针调整120°左右,再由近心至远心方向插入颈内动脉;(6)打开颈内动脉动脉夹,两手互相辅助操作使线栓沿颈内方向进入,再次固定线栓的结扎线;(7)再灌注时拔出线栓,同时打开同侧颈总动脉固定活结。具体信息见图1B。
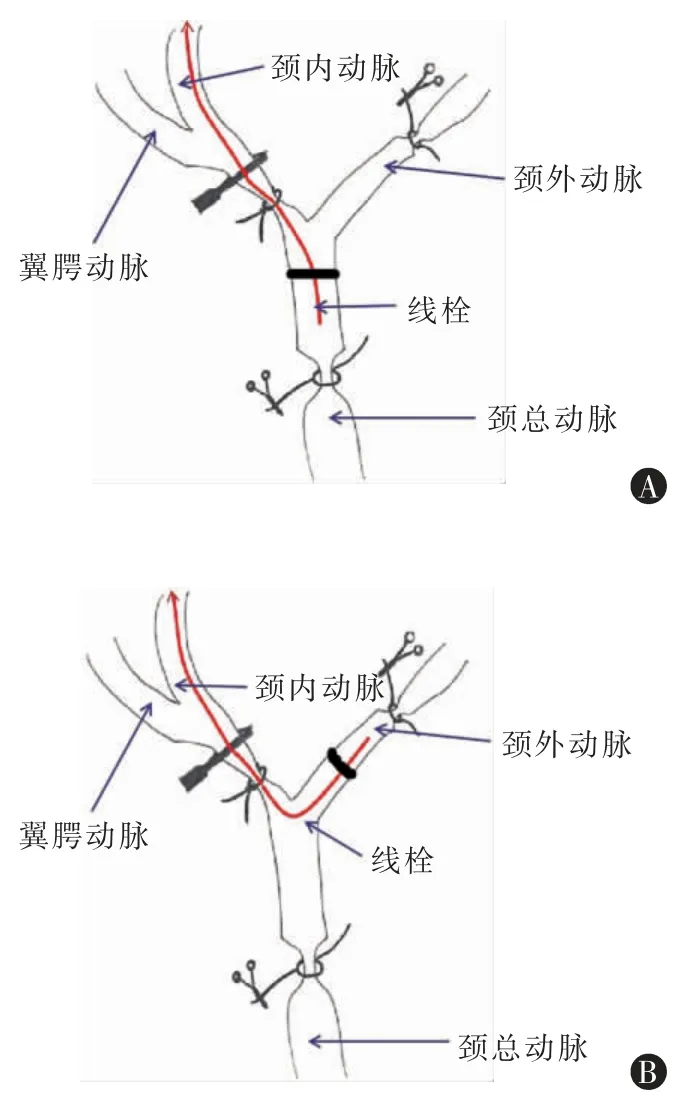
图1 2 种插线途径MCAO 模型示意图
4.MCAO 模型制备要点:插线过程中调整血管方向避免线栓进入翼颚动脉;线栓进入大脑中动脉时会遇到轻微阻力,此时不宜再进,这时线栓深度大约(1±0.2)cm,多普勒血流仪显示中动脉血流曲线约下降70%,剪断多余暴露于血管外部的线栓。由于个体差异,有的小鼠不会遇到阻力,在实验过程中将剔除这一类小鼠。清理手术视野,连续缝合切口。栓塞1 h 后拔出线栓得以再灌注,待动物苏醒后置于保温箱(温度设置27℃),自由流质饮食。
5.假手术组模型制备:假手术组制备与上述相同,但不插入线栓。
(三)行为学评分
在动物缺血1 h 后取出线栓,撤掉麻醉,动物会自然苏醒,再灌注24 h 后,进行Longa 神经行为学评分,并将其作为动物中风严重程度、术后身体状况的综合判定依据。具体评分标准:(1)0 分:没有神经功能损伤的症状,小鼠能够正常活动、进食;(2)1分:将小鼠尾巴提起后,右前肢屈曲;(3)2 分:将小鼠放置于平板上,向右转圈;(4)3 分:将小鼠放置平板上,用手推向右倾倒;(5)4 分:小鼠右侧肢体偏瘫,不能自发行走意识朦胧或丧失。2 分的小鼠模型最为成功、模型稳定且术后状态最佳。比较2 组术后评分为2 分(状态良好)与非2 分(状态不佳,包括死亡)的小鼠例数,比较2 种小鼠模型制备方法的效果。
(四)TTC 染色
MCAO 后24 h,20%乌拉坦5 mL/kg 麻醉小鼠,1×磷酸缓冲盐溶液(phosphate buffer saline,PBS)心脏灌流后,快速取出全脑,迅速将其置于带有碎冰渣的冰冻PBS 中5~10 min,去掉额极和枕极后切成2 mm 厚的冠状切片5 块,切片立即放入2%TTC 染液中在37℃、避光、水平摇床缓慢摇动下孵育5 min,正常组织染色后呈鲜红色,梗死区呈瓷白色;后将染色的脑片置于4%PFA 中固定、拍照。在imagePro plus 软件中分析并计算梗死体积。为了消除脑水肿对梗死体积的影响:梗死体积=(正常侧脑组织体积-梗死侧正常脑组织体积)/正常侧脑组织体积×100%[8]。
(五)脑含水量
TTC 染色后脑片,用滤纸吸水分后称湿质量,锡纸包裹放入70℃恒温干燥箱中72 h,后称干质量。按照脑含水量=(湿质量-干质量)/湿质量×100%[6]。
(六)TUNEL 神经细胞凋亡检测
20%乌拉坦按5 mL/kg 麻醉大鼠,1×PBS 心脏灌流至心脏发白,后用4%多聚甲醛灌流至肢体僵硬。灌注完毕后开颅拨脑壳,取bregma 点至lambda点之间的脑组织,置入4%多聚甲醛中固定24 h,后30%蔗糖溶液中脱水至组织下沉。OCT 包埋,冰冻切片机急速冷冻至样品温度-10℃,冠状切片,片厚30 μm,粘于多聚赖氨酸处理后的正离子防脱玻片上,-80℃避光保存。冰冻玻片室温解冻5~10 min,擦去玻片上残余OCT,疏水免疫组织化学笔圈定组织范围,至于避光免疫组织化学盒中。PBS 洗片3 次,每次5 min,0.3%TritonX-100 破膜10 min,后PBS 继续洗片3 次,每次5 min。按每份材料5 μL TdT 酶、45 μL FITC 荧光液混合成50 μL TUNEL 染色液,37℃避光孵育2 h。PBS 洗片4 次,每次5 min,DAPI 染色液(5 μg/mL),按每份组织50 μL 染细胞核,10 min。PBS 洗片4 次,每次5 min,后用抗荧光淬灭封片剂封片,4℃保存,镜检。结果判定:激光共聚焦显微镜观察,细胞核中有棕黄色颗粒者为TUNEL 阳性细胞,即凋亡细胞。
三、统计学分析
采用prism8 软件统计分析实验数据,采用imageJv1.8.0 软件处理图像,其中小鼠存活情况以及神经功能评分采用χ2检验分析,梗死体积、脑水肿程度、神经细胞凋亡情况以均数±标准差()表示,进行两独立样本的t 检验分析。P<0.05 为差异具有统计学意义。
结果
一、各组小鼠术后存活情况
缺血1 h 再灌注24 h 后对各组小鼠术后存活率进行比较,颈外组术后存活率(100%)明显高于颈总组(72.2%),差异具有统计学意义(P<0.05,表1)。
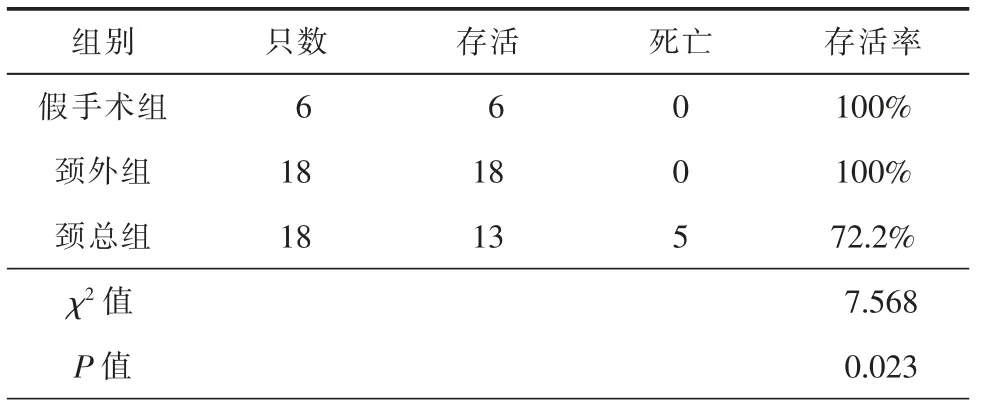
表1 3 组模型小鼠存活率比较
二、各组小鼠longa 神经功能评分比较
缺血1 h 再灌注24 h 后对各组小鼠进行神经功能评分。比较术后评分为2 分(状态良好)与非2分(状态不佳,包括死亡)的小鼠例数,颈外组术后神经功能评分为2 分的小鼠明显多于颈总组,差异具有统计学意义(P<0.05,表2)。
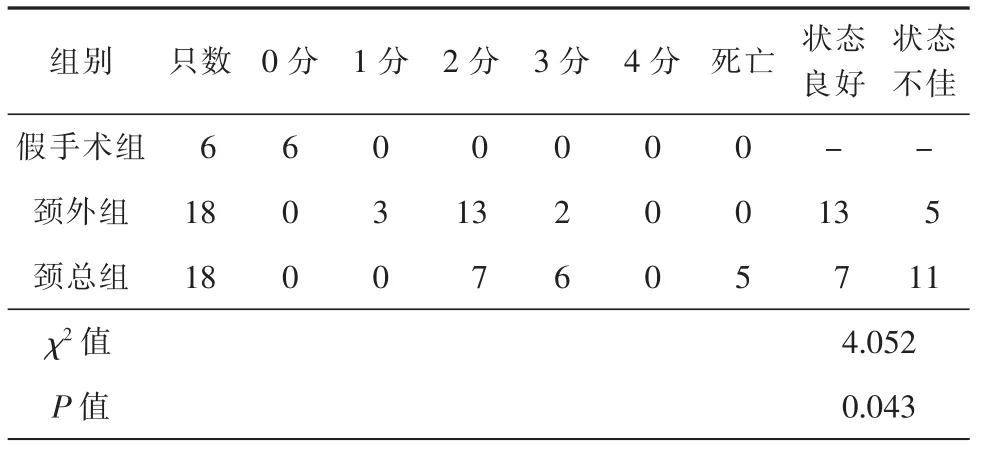
表2 3 组小鼠longa 神经功能评分比较
三、TTC 染色梗死体积统计
颈外组与颈总组梗死体积接近,差异不具有统计学意义(t=2.096、P=0.062,图2)。

图2 TTC 染色梗死体积统计
四、脑水肿程度比较
缺血1 h 再灌注24 h 后,与假手术组相比,颈外组脑组织水肿明显(t=5.789,P=0.002),颈总组脑组织水肿明显(t=5.983,P=0.002),差异具有统计学意义;颈外组与颈总组脑水肿程度相近,差异不具有统计学意义(t=1.297,P=0.251)。具体信息见图3。
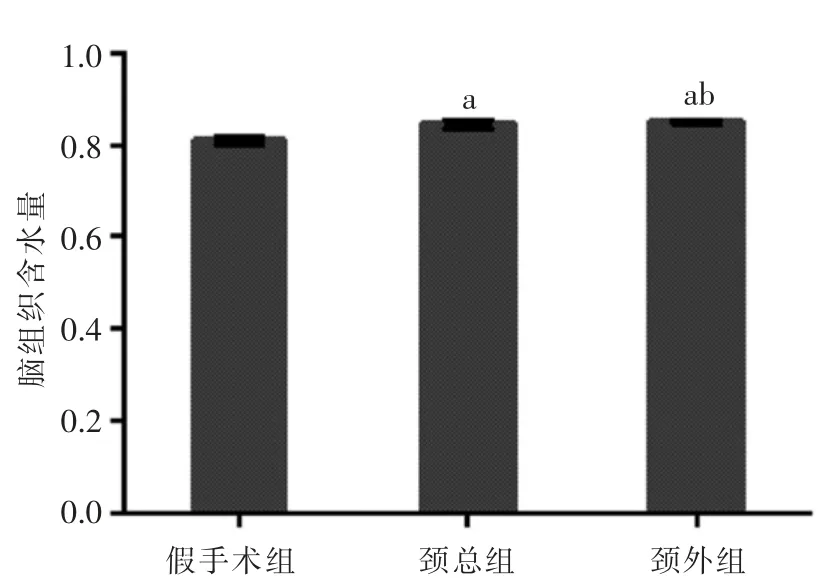
图3 3 组小鼠脑水肿程度比较
五、TUNEL 神经细胞凋亡情况
在20×激光共聚焦显微镜下观察(图4),sham组未见TUNEL 阳性细胞,颈总组和颈外组可见大量TUNEL 阳性细胞。TUNEL 阳性细胞数统计面积取整数为1 mm2,颈外组的TUNEL 阳性细胞数即神经细胞凋亡数量(2505±45.12)与颈总组(2404±58.59)接近,差异无统计学意义(P=0.199,图5)。
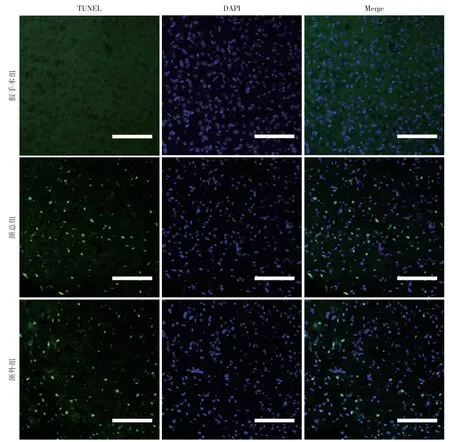
图4 TUNEL 神经细胞凋亡情况(20×)
讨论
缺血性脑血管病约占临床上脑血管病的80%,其中以大脑中动脉栓塞最为常见[2,9]。因此,需要选择稳定性重复性好的动物模型来模拟这一疾病的发生、发展、结局以及转归[10-12]。
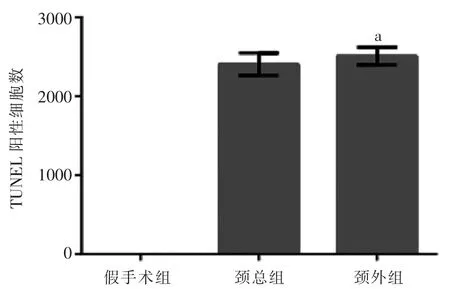
图5 TUNEL 细胞凋亡阳性细胞个数统计图
MCAO 模型是目前被学术界所公认的缺血性脑卒中模型,其出现为临床缺血性脑损伤的理论研究提供了条件[13]。其中线栓法最为贴近临床实际,且可以准确控制栓子的位置、走向以及取栓时间,同时具有不开颅、减少感染、梗死体积稳定、可操作性强等优点,广泛应用于脑血管病的研究[14]。
本次实验通过比较两种不同路径的MCAO 线栓法的效果,可以看出颈外动脉插线更具有优势以及研究价值。作为一个合格的手术模型必须具备稳定性和可重复性,经过统计学比较分析,两种模型所制造的动物行为的改变、梗死体积、脑水肿程度以及神经细胞的凋亡比较一致。但颈外动脉插线的优势在于其保证模型稳定的同时很大程度上提高了实验动物的存活率,有利于对实验动物长期疾病发生过程的长时间跟踪观察,也可满足后续的药物长期干预治疗。
研究分析表明,颈外动脉插线实验动物存活率提高的原因大致有以下几点。首先,在操作上,颈外动脉插线能够尽可能避免术中的出血以及减少手术引起的机械损伤,由于栓子不通过颈总动脉以及颈总动脉的结扎时间较短,可以很大程度上减少机械原因引起的血栓形成;电凝颈外动脉也可以避免颈外动脉在术中的出血。其次,颈外动脉插线可以减少术后动物的苏醒时间,给动物复苏之后的存活提供更多的可能性。更为重要的是,颈外动脉插线很大程度上保留了动物原有的血管构型,这一点在再灌注期表现更为明显,其大脑中动脉供血来源于原有的颈总动脉以及WILLS 循环的对侧的双重血供,氧气和营养物质可以得到充分供给[15,16];而颈总动脉插线致使颈总动脉完全被破坏,大脑中动脉血供只能来源于侧支循环,这一情况等同于慢性反复缺血,再灌注后再缺血,对动物造成二次伤害;颈外动脉插线实现了术后颈总动脉到颈内动脉这一贴合临床实际的再灌注途径。
通过本次实验证明颈外动脉插线制作MCAO模型更具有优势,值得推广应用。但该模型对术者经验手术技巧要求非常高,因动物个体间的差异线栓插入的深度不好掌控,术后护理温度和湿度、术后小鼠补液营养的维持同样是不容小觑的细节管理。因此,MCAO 模型还需要在不断实践中进行探索和改进,使得其更加明晰地模拟人类脑缺血再灌注损伤,能够更大程度地为探索和改进缺血性脑损伤疾病的治疗起到推动作用。
综上所述,根据实验数据对比分析,作为大脑中动脉栓塞模型,颈外动脉栓塞途径实验动物存活率更高,适合长期观察研究应用,所以推荐采用颈外动脉插线方法制作大脑中动脉栓塞模型。
