基于定量蛋白质组学的NT-89抗白念珠菌作用机制研究
2019-05-07刘昱阎澜姜远英
刘昱 阎澜 姜远英
(海军军医大学药学系军特药研究中心,上海 200433)
真菌细胞壁在真菌的生存与致病中发挥着重要作用,并作为重要的抗真菌新药靶标被广泛研究[1]。细胞壁中大部分蛋白质是通过糖基磷脂酰肌醇(Glycosyl-Phosphatidyl-Inositol,GPI)残基锚定于细胞壁葡聚糖层上的GPI锚定蛋白,在真菌细胞壁的形态维持与修复、毒力因子形成以及环境应激作用等生命活动中发挥着关键作用[2-3],抑制GPI的合成将影响细胞壁中GPI锚定蛋白的转运和定位,减少真菌细胞壁蛋白的含量,影响蛋白质生物学功能的发挥并破坏细胞壁结构。目前已被研发出的GPI合成抑制剂包括10b、E1210(APX001A)和G884等[4-7],我们通过对上述几种化合物的结构优化,合成并筛选出具有抗真菌活性的化合物NT-89(见图1),并验证了NT-89能够抑制白念珠菌GPI合成与运输并破坏细胞壁结构[8]。由于细胞壁中存在一百多种已知的GPI锚定蛋白[2],仅通过几种细胞壁蛋白的含量变化难以全面反映NT-89对真菌细胞壁蛋白的实际影响,因此我们采用定量蛋白质组学结合生物信息学方法,分析NT-89作用前后白念珠菌细胞壁GPI锚定蛋白的含量变化,并分析对其他通路或结构中的蛋白质的影响。
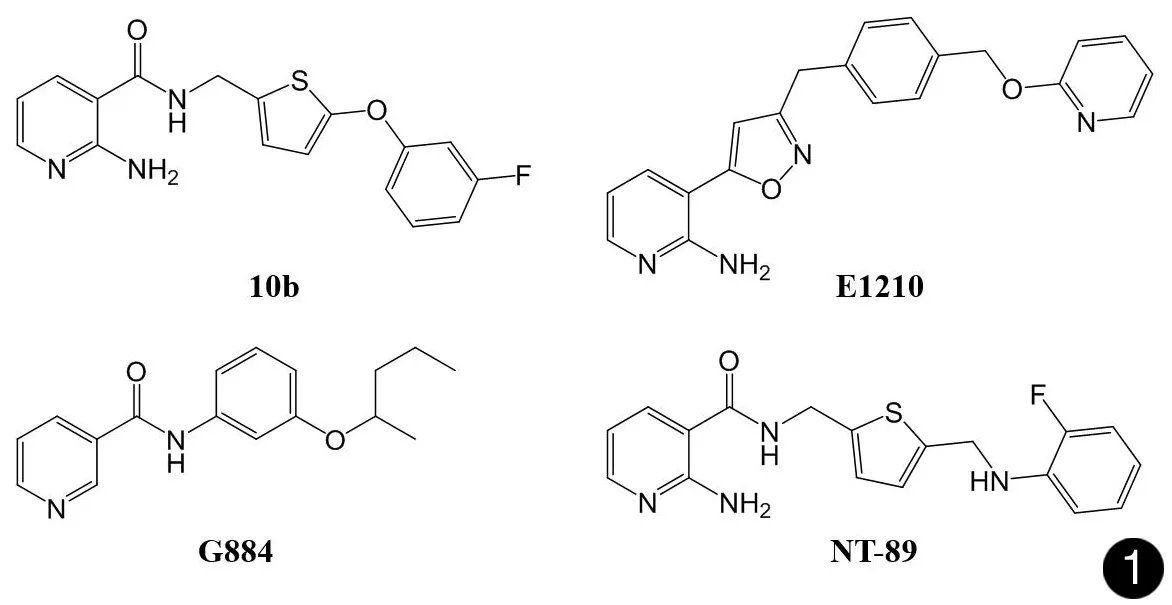
图1 现有的GPI合成抑制剂与NT-89的结构
Fig.1The chemistry structures of GPI synthesis inhibitors and NT-89
同位素标记相对和绝对定量(isobaric Tags for Relative and Absolute Quantification,iTRAQ)技术,是利用不同分子量的同位素标记不同样品蛋白质组中的多肽肽段,并利用LC-MS产生的不同标记的特征离子峰,分离并识别不同肽段及其丰度,从而实现相对或绝对定量的蛋白质组学方法[9]。这一技术具有灵敏度高、分离能力强等特点,目前被广泛应用于药物作用靶点的发现以及细胞凋亡等生命过程中蛋白标记物的研究等[10-11]。本研究中,我们将利用iTRAQ技术并结合生物信息学分析,对NT-89处理前后的白念珠菌进行定量蛋白质组学的研究。除提取总蛋白外,我们还采用氟化氢吡啶(HF-pyridine)提取法,尝试直接提取并检测细胞壁蛋白,以求更准确地反映细胞壁GPI锚定蛋白含量变化[12-13]。
1 材料与方法
1.1 材料
菌株 实验使用国际实验室通用菌株白念珠菌SC5314,由美国华盛顿乔治敦大学免疫微生物教研室的William A. Fonzi教授惠赠。
培养基 YPD(yeast pentose dextrose)培养基:酵母提取物10 g,蛋白胨10 g, D-葡萄糖20 g,加入三蒸水混匀并定容至1000 mL,高温高压(121 °C,30 min)灭菌后于4 °C保存备用。沙氏葡萄糖琼脂(Sabouraud dextrose agar,SDA)培养基:蛋白胨 10 g, D-葡萄糖40 g,琼脂粉20 g,加入三蒸水混匀并定容至1000 mL,高温高压(121 °C,30 min)灭菌后,倒入90 mm直径的培养皿中,冷却至室温凝固后备用。
药品 实验使用的抗真菌化合物NT-89由海军军医大学药学院有机化学教研室合成。使用前溶于DMSO中,保存于-20 °C。
试剂 ①总蛋白提取使用试剂如下:蛋白裂解液:Tris-HCl 50 mmol/L, EDTA 5 mmol/L, DTT 10 mmol/L,1% Triton-100X, 10% 甘油,加入超纯水溶解混匀,使用前加入蛋白酶抑制剂cocktail:Leupeptin 10 μg/mL(约20 μmol/L),Pepstatin A 7 μg/mL(约1 μmol/L),antipain 5 μg/mL,PMSF 1 mmol/L。②细胞壁蛋白提取使用试剂如下:
蛋白裂解液 Tris 1.21 g, HCl调pH值至7.5, 1000 mL超纯水溶解,使用前加入蛋白酶抑制剂cocktail:Leupeptin 10 μg/mL(约20μmol/L),Pepstatin A 7 μg/mL(约1 μmol/L),Aprotinin 5 μg/mL, PMSF 1mmol/L。SDS提取液: SDS 0.2 g,Tris 6.05 g(50 mmol/L),DTT 1.54 g(10 mmol/L),EDTA 0.0292 g(0.1 mmol/L),1000 mL超纯水溶解后,HCl调pH值至8.0,置于室温备用。
仪器 Precellys 24 多功能样品均质器(Bertin Technologies);Thermo Heraeus Fresco 21 微量冷冻离心机; Biospec Bead-beater 搅拌式研磨珠均质器;Thermo Heraeus Multifuge X1R高性能通用台式离心机;Tecan Infinite 200 Pro 多功能酶标仪。
1.2 实验方法
白念珠菌活化与加药培养 -80 °C冻存的白念珠菌SC5314菌株划线接种至SDA培养基平板表面,30 °C静置培养48 h,之后挑取5个单克隆菌落接种至1 mL YPD液体培养基中,30 °C、200 rpm振摇培养16 h。菌液按1∶100的比例接种至加入NT-89 0.08 μg/mL 或不加药的YPD培养基中,按上述条件继续培养16 h用于总蛋白或细胞壁蛋白的提取。
总蛋白(Total Protein,TP)提取 菌株按上述过程活化并加药或不加药培养后,吸取1 mL菌液,4000 r/min离心2 min收集菌体,加入PBS洗涤3次,4000 r/min离心2 min,弃上清后,调整各管中菌体湿重至每管菌量约为20 mg,加入蛋白裂解液700 μL重悬菌体,转移悬液至已加入等体积玻璃珠(0.5 mm)的提取管中并置于冰浴中。使用Precellys 24多功能均质器,以30 s×20次的程序破碎菌体,其间冰浴降温20 s以上,破碎后4 °C、13000 r/min离心10 min,小心吸取上清溶液,即获得总蛋白提取液,BCA法测定蛋白浓度。
细胞壁蛋白(Cell Wall Protein,CWP)提取 菌株活化后,各组分别将3 mL菌液传入300 mL加药或不加药的YPD培养基中,按前述条件继续培养16 h,3000 r/min离心5 min,分多次收集菌体,加入PBS洗涤3次,收集菌体。加入裂解液20 mL并置于冰浴中,加入等体积的玻璃珠(0.5 mm,约40 mL),使用Bead-beater均质器,以30 s×60次的程序破碎菌体,其间冰浴降温30 s。吸取破壁后液体, 4 °C、5000 r/min离心10 min,收集细胞壁碎片。将碎片用冷的超纯水(含1 mmol/L PMSF)洗涤5次,之后依次用5%、2%和1% 的NaCl溶液(含1 mmol/L PMSF)各洗涤5次,最后用冷的超纯水(含1 mmol/L PMSF)再洗涤1次,5000 r/min离心5 min收集沉淀。向沉淀中加入SDS提取液15 mL,95°C水浴加热10 min,5000 r/min离心10 min,弃上清,再重复此步骤1次。用冷的超纯水(含1 mmol/L PMSF)洗涤1次,5000 r/min离心10 min收集细胞壁碎片并冻存于-80 °C。称取约0.6 g湿重的细胞壁碎片,加入氟化氢吡啶(HF-pyridine)3 mL,冰浴3 h后,加入3 mL冷超纯水,全部转移至25 kD的透析袋中,4°C透析24 h,吸取透析袋内上清液,即获得细胞壁蛋白提取液,BCA法测定蛋白浓度。
iTRAQ检测与生物信息学分析 四组蛋白样品送至上海美吉生物(Majorbio)公司进行iTRAQ检测与生物信息学分析。在对样品进行SDS-PAGE检测与浓度测定后,将每组样品分为两份平行测定,共计8个样品,分别标记并进样检测,各组结果取两份样品的平均值。每组蛋白样品取90 μg进行还原烷基化和酶解后,加入8个不同分子量的iTRAQ 8PLEX标记处理,将全部样品混合后进样UPLC-MS检测标记肽段。利用ProteomeDiscoverer Software 2.1软件搜索UniProt数据库获得肽段及对应的蛋白质信息,利用iTRAQ标记的特征峰获得蛋白的相对丰度。利用GO(Gene Ontology)数据库进行蛋白质的功能分类注释。有关蛋白质或基因的功能描述信息参考自NCBI数据库或念珠菌基因组数据库CGD。使用R语言中t.test函数计算样本间差异显著性的P值,显著差异表达蛋白的筛选标准为:①P<0.05;②蛋白相对表达量差异倍数>1.3或<0.77。
2 实验结果
2.1 蛋白质提取液质量检查
蛋白提取送样后,首先利用SDS-PAGE初步鉴定蛋白质提取液的质量,以评价是否适合进行下一步的实验,并比较两种提取液中蛋白质组成与分布的差异。结果显示(见图 2),两种方法均有效提取出白念珠菌的蛋白质成分,且蛋白质分子量差异较为明显,其中总蛋白的条带(1、2)中,蛋白分子量在10~180 kD均有分布,较多集中在40~180 kD,与之相比,细胞壁蛋白(3、4)的分子量较多集中在40 kD以下。
2.2 差异蛋白组成分析
本实验中,将加药前后提取的总蛋白与细胞壁蛋白共四组样品蛋白混合进样后,共检测到有效蛋白3557种。总蛋白组(以下简称TP组)中有效差异蛋白共计295种,其中上调蛋白199种,下调蛋白96种;细胞壁蛋白组(以下简称为CWP组)中有效差异蛋白共计975种,其中上调蛋白493种,下调蛋白482种。通过对差异蛋白的在细胞成分中的组成的GO分析(见表1),我们发现在CWP组的差异蛋白中,膜结构和细胞器中的差异蛋白占比例较高,部分已接近甚至超过TP组中的占比,而位于细胞壁、细胞表面或胞外的差异蛋白占比略低。造成这一现象的原因可能由于破碎菌体获得的细胞碎片中,除了细胞壁碎片外,还包含了细胞器等胞内膜结构的碎片,其中附着或镶嵌在膜结构中的蛋白质在洗涤处理细胞碎片过程中仍部分残留于膜碎片中,或者有部分胞内蛋白附着于细胞壁内表面上,在提取细胞壁蛋白时,这部分蛋白也脱落并游离在提取液中,由于iTRAQ技术的高灵敏度,使得这些含量不定的残留蛋白能够被检测出来,而差异的产生很可能则是在细胞碎片处理过程中产生的蛋白残留量的差异,不能确定是否为药物的影响,同时我们认为检测出的细胞壁GPI锚定蛋白应主要为直接从细胞壁碎片中提取的蛋白,不包含已在胞内合成但未定位至细胞壁上的蛋白成分,因此在分析CWP组差异蛋白时,应主要参考细胞壁或细胞表面等结构上的蛋白,胞内差异蛋白结果则应以TP组为准。
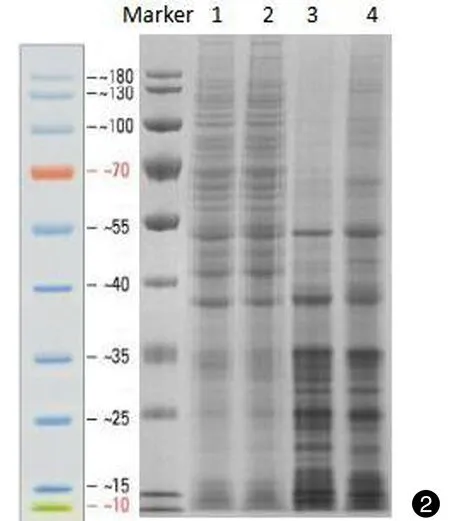
图2两种蛋白提取物的SDS-PAGE检测结果。1和2表示总蛋白的对照组与NT-89处理组,3和4表示细胞壁蛋白的对照组与NT-89处理组
Fig.2SDS-PAGE results of protein extracts. 1 and 2 represent the control and NT-89 group of total protein (TP), and 3 and 4 represent the cell wall protein (CWP)
我们接下来分析了总蛋白中含量增加最多与减少最多的各20种差异蛋白及其功能(蛋白基因与功能信息参考NCBI与CGD数据库)。在相对表达量减少最多的20种蛋白中(见表2),有5种为GPI锚定蛋白,其中Ywp1p与Pga10p两种蛋白在总蛋白中含量减少最多,Ywp1p在白念珠菌在宿主的传播中发挥关键作用,Pga10p为RPMI1640培养基中生物被膜形成的必需成分之一,此外一些如Hsp家族蛋白和黏附素样蛋白等的含量均显著降低。
而在相对表达量增加最多的20种蛋白中没有出现GPI锚定蛋白(见表3),但在其中有7种蛋白在内质网的蛋白质合成加工过程中发挥作用,例如在总蛋白中相对表达含量增加最多的、在内质网中蛋白质的靶向定位、信号肽加工和信号肽酶复合物的定位等过程中发挥作用的信号肽酶复合物亚基蛋白(XP_019330933.1),以及Sec61p等转运蛋白的增加,提示NT-89作用后由于蛋白质合成与运输的缺陷以及到达相应定位位置的蛋白含量减少,可能使得内质网中的蛋白质加工运输过程被反馈性增强,以补偿NT-89引起的蛋白质运输及定位的缺陷。
2.3 细胞壁GPI锚定蛋白的差异蛋白分析
随后我们综合分析了总蛋白与细胞壁蛋白中GO分类注释为二级分类“extracellular region”(GO:0005576)、三级分类“cell surface”(GO:0009986)以及四级分类“cell wall”(GO:0005618)的差异蛋白,将位于这三个分类中的蛋白统一看做细胞壁或细胞表面蛋白。以上三种分类中,TP组共有42种差异蛋白,其中下调蛋白23种;CWP组共有52种差异蛋白,其中下调蛋白26种;两组的共同差异蛋白27种,其中共同下调蛋白14种,共同上调蛋白12种(见图3)。
我们随后查找并分析了两组的共同差异蛋白中CWP组的细胞壁GPI锚定蛋白及相关信息(见表4),得到6种表达下调的GPI锚定蛋白(Ywp1p、Pga10p、Plb4.5p、Pga4p、Rhd3p、Pga45p),以及5种表达上调蛋白的GPI锚定蛋白(Sod5p、Utr2p、Sap9p、Crh11p、Phr1p)。上调的GPI锚定蛋白多与细胞修复与细胞完整性有关,其中Sap9p在黏附与维持细胞表面完整性方面发挥作用,Crh11p与Phr1p均为与细胞壁葡聚糖合成相关的酶,而UTR2基因的诱导则发生在细胞壁的再生修复过程中。这些蛋白的表达上调可能由于NT-89作用后细胞壁中蛋白的减少导致细胞壁结构被破坏,从而触发了细胞的反馈调节,引起细胞壁的修复以及部分细胞壁蛋白合成的增强。
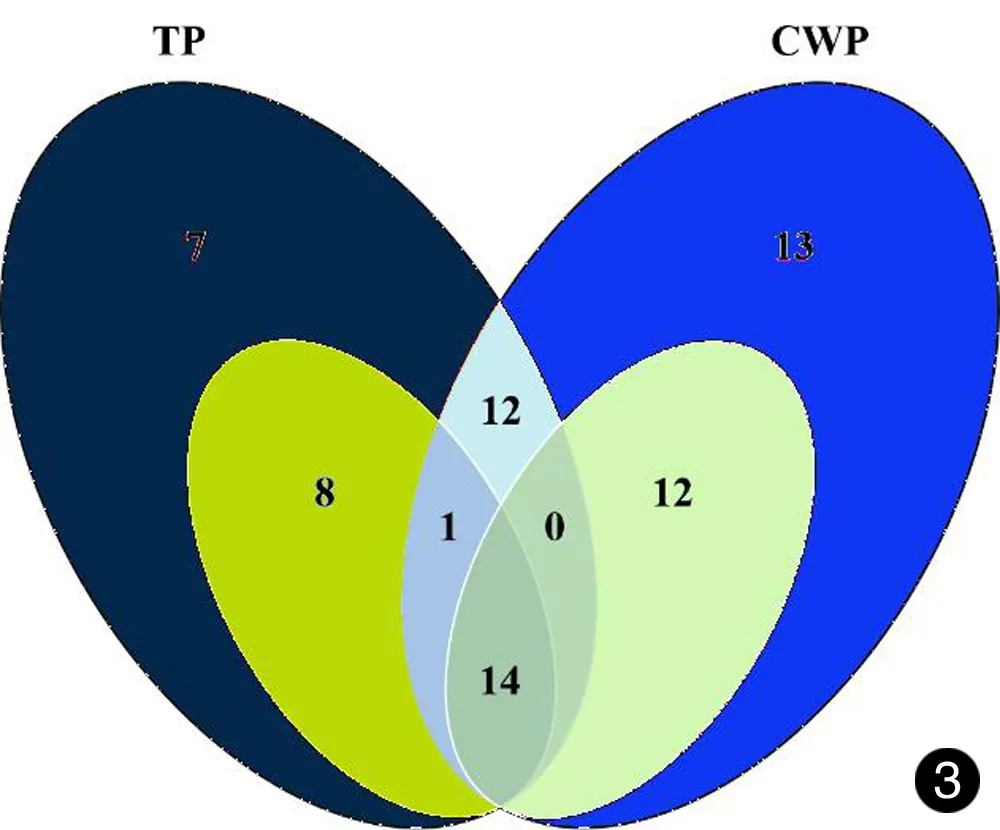
图3两种蛋白提取物中细胞壁与细胞表面差异蛋白Venn图。大圆表示分组中全部差异蛋白,小圆代表下调蛋白
Fig.3Venn of differential proteins on the surface or in the cell wall in two protein extracts. Big circles indicate all the differential proteins, and small circles indicate down-regulated proteins
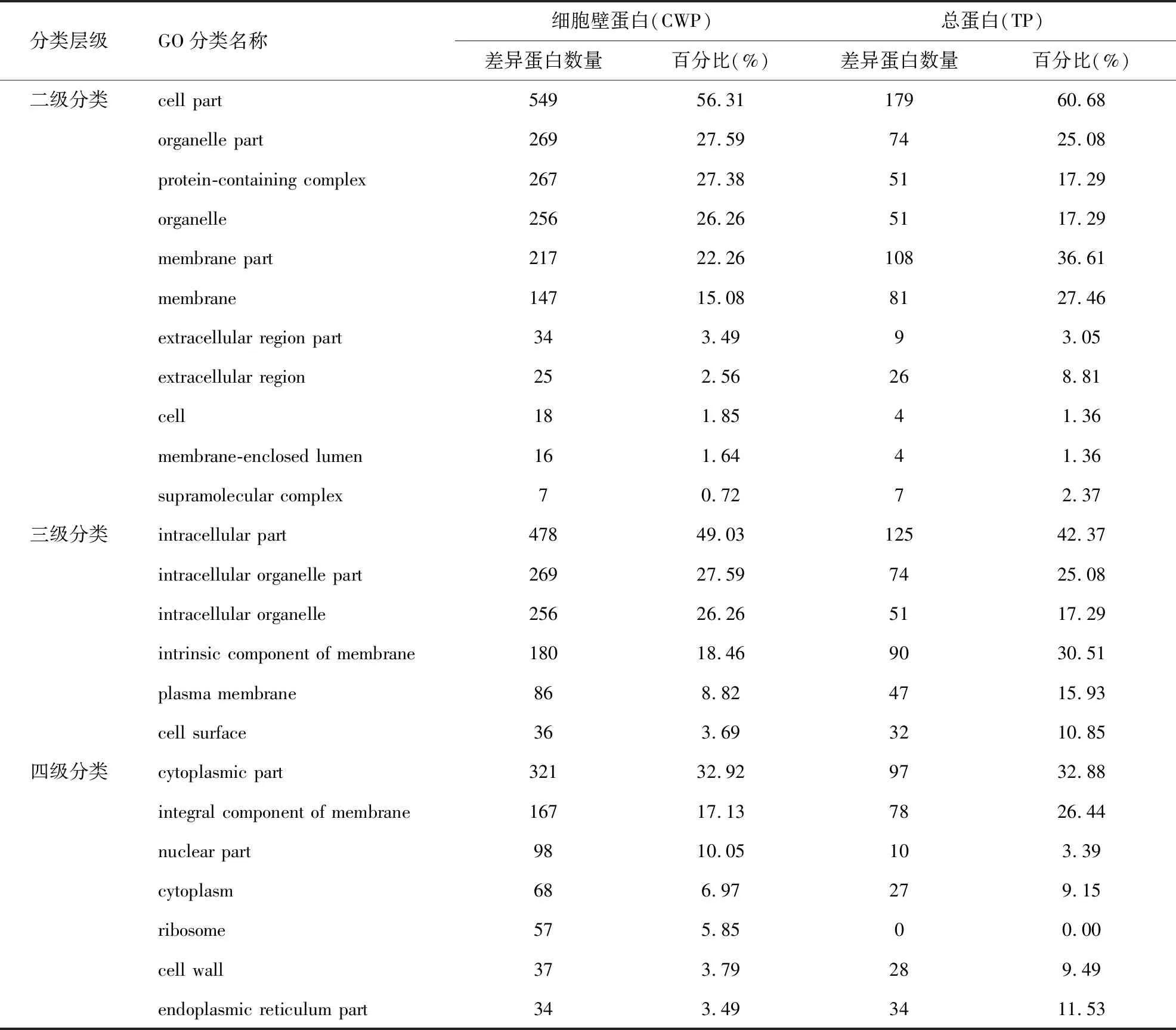
表1 两种蛋白质提取物的差异蛋白在不同GO分类中的分布

表2 总蛋白中NT-89处理后下调最多的蛋白

(续表)
* 准确的或者可能性最大的表达基因
** GPI锚定蛋白用加粗字体表示
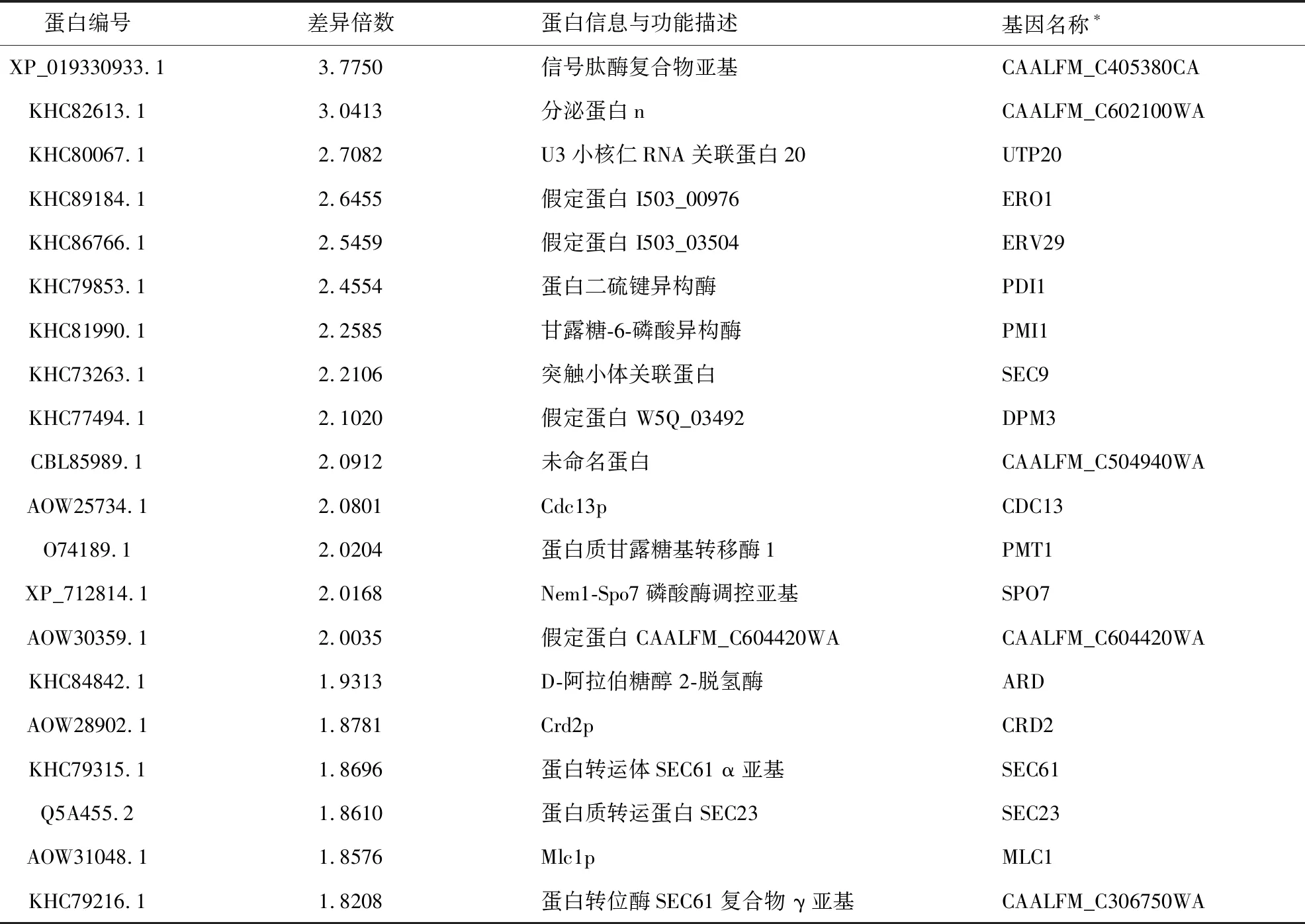
表3 总蛋白中NT-89处理后上调最多的蛋白
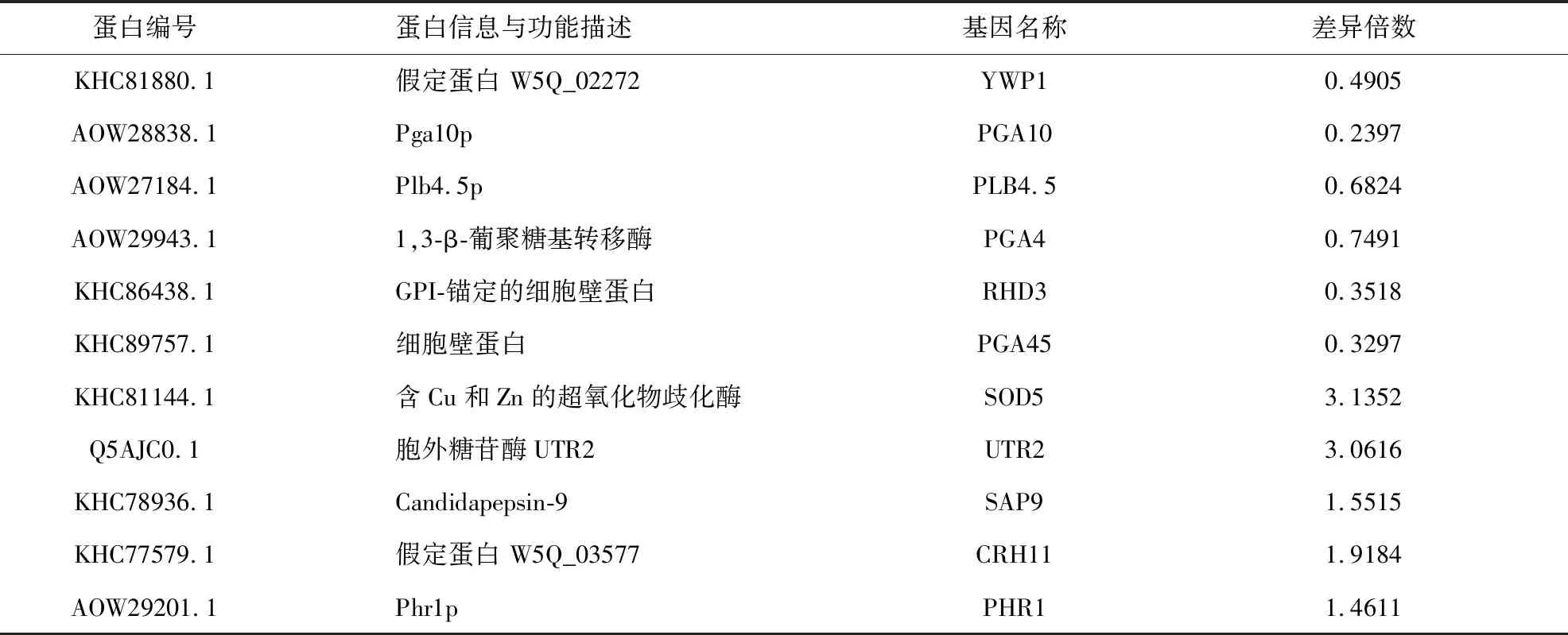
表4 CWP组细胞壁GPI锚定蛋白的差异蛋白
3 讨 论
在本研究中,我们主要利用iTRAQ技术对NT-89处理前后的白念珠菌进行了定量蛋白质组学的研究。为避免细胞内未能运输结合至细胞壁的GPI锚定蛋白的干扰,除了采用一般提取白念珠菌总蛋白的方法外,我们还尝试采用氟化氢吡啶提取法直接提取细胞壁GPI锚定蛋白。从结果上看,在氟化氢吡啶提取出的蛋白中还含有大量的胞内膜结构或细胞器中的蛋白,造成这一现象的原因除了因iTRAQ技术自身的灵敏度与混合进样等因素的影响外,还可能由于氟化氢吡啶提取方法自身存在不足,文献中已有报道发现,除了细胞壁中的GPI锚定蛋白外,氟化氢吡啶提取产物中还包含有数十种分类为非细胞壁蛋白的成分[12],原因可能为细胞碎片处理过程中膜结构以及膜上镶嵌或附着的蛋白未被完全除去,同时我们认为检测到的细胞壁中的蛋白则应当主要来自于细胞壁碎片,不包含胞内已合成但未定位的细胞壁蛋白,因此氟化氢吡啶提取物即CWP组的差异蛋白结果适用于细胞壁与细胞表面的差异蛋白分析。
在总蛋白提取物中,下调差异最大的20种差异蛋白中排名最高的Ywp1p与Pga10p均为GPI锚定蛋白,同时在细胞壁提取物的差异蛋白中,共检测到6种被显著下调的细胞壁GPI锚定蛋白。上述结果说明NT-89能够影响白念珠菌细胞壁GPI锚定蛋白的含量及分布,并影响了白念珠菌的生物被膜形成等生命活动。而通过对上调最多的蛋白以及细胞表面出现上调的GPI锚定蛋白的分析,我们发现NT-89处理后的白念珠菌中,内质网中的蛋白质合成及胞内蛋白质的运输均被增强,而含量增加的GPI锚定蛋白多与细胞壁结构修复有关。综合上述结果,我们推断在NT-89作用后,由于细胞壁表面蛋白质合成运输的缺陷,导致了细胞壁结构的破坏,而修复细胞壁结构的GPI锚定蛋白的含量也在药物作用下减少,因此细胞为修复被破坏的细胞壁,从而增强了蛋白质与细胞壁物质的合成,导致与这些过程有关的蛋白表达增加。
综上所述,本研究主要利用定量蛋白质组学iTRAQ技术检测NT-89处理后白念珠菌蛋白质含量变化,并对蛋白的分类进行GO分析,验证了NT-89能够减少细胞表面的GPI锚定蛋白含量,并推测出部分GPI锚定蛋白含量增加是由于NT-89引起的细胞壁蛋白减少和细胞壁结构的破坏引起的反馈性修复与代偿调节。定量蛋白质组学能够为药物的作用靶点与机制的研究提供大量有价值的信息,而现有GPI锚定蛋白抑制剂研究中尚未报道过类似研究方法,因此本研究中对定量蛋白质组学方法的应用将为同类药物的机制研究提供有效参考与借鉴,除此之外,探索出更加高效的真菌细胞壁蛋白提取方法将更加有利于此类研究的开展。
