枸杞幼苗对盐胁迫的生理响应
2019-05-07白丽丽李玉龙谢志霞王文颖
白丽丽,李玉龙,巩 健,李 豪,谢志霞,王文颖,徐 进
(1.青海师范大学生命科学学院,青海西宁 810008;2.淄博职业学院制药与生物工程系,山东淄博 255314;3.中国科学院遗传与发育生物学研究所农业资源研究中心,河北石家庄 050022;4.山西农业大学林学院,山西晋中 030801;5.中国科学院西双版纳热带植物园,云南昆明 650223)
盐胁迫是严重影响植物生长发育的非生物因素,会扰乱植物正常的代谢活动、影响根系对K+及其他必需元素的吸收,进而造成生理干旱并引起氧化胁迫等次生胁迫,导致植物生长受到抑制甚至死亡。植物在进化中形成不同的对盐胁迫响应机制[1-2]。一些植物在逆境胁迫中会累积有机兼容性溶质并分泌一些有机酸(如脯氨酸)[3-5],在胁迫环境下可以维持细胞膨胀、保护酶和膜免受伤害,在植物抗逆过程中可能起着重要的作用。
1995年,Kavi Kishor P B等人[6]将P5CS(吡咯啉-5'-羟酸氧化酶;脯氨酸生物合成过程中的限速酶)基因转化烟草,发现在转基因烟草中脯氨酸的含量明显提高,其耐盐性也有所提高[7]。另外,可溶性糖(葡萄糖、果糖、蔗糖、果聚糖等)是另一种重要的渗透调节物质。有研究表明,随着盐胁迫时间的延长,番茄叶片中可溶性糖含量逐渐增加[8]。在较低的NaCl胁迫下,枸杞叶片中的可溶性糖含量显著增加,但较高的含盐量(0.5%)下降低其可溶性糖含量[9-10]。在重盐碱地上种植枸杞的脯氨酸含量较对照增加,而可溶性糖在地上部无明显变化,在根部大量积累。在枸杞不同的营养器官中,其含量有所差别,表现为脯氨酸和可溶性糖在根中大量积累,叶片次之,茎中最少[11]。
目前,多年来人们对枸杞的研究主要集中在栽培、育种、中药成分分析及临床应用方面[9,11-13]。但目前对其响应盐胁迫的生理和分子机制研究较少。试验以枸杞为材料,对不同浓度和不同时间的盐胁迫下枸杞幼苗的生理生化指标进行了研究,为进一步探明枸杞响应盐胁迫的生理与分子机理,更好地利用枸杞改良盐碱地和生产高品质的枸杞子提供理论基础。
1 材料与方法
1.1 试验材料
海杞(Lycium barbarum L.),中科院南皮农业生态试验站提供。海杞是中科院南皮农业生态试验站经过6年选育出的枸杞优良品种,在滨海重盐碱地生长和结果良好,并可丰产稳产。
1.2 试验设计
从中科院南皮农业生态试验站挑选生长状况一致的海杞枝条,挑选粗细相近的枝段(直径3.5~5.0 mm)剪裁成15 cm长的枝条,据顶端1 cm处留一个完整的侧芽。然后放入自来水中,21 d后开始长新芽,剪下生长状况相近的新芽,放入IAA质量浓度为0.5 mg/L的自来水中催根,待生根后进入盐浓度梯度和时间梯度的处理。盐处理设4个浓度梯度(0,50,100,150 mmol/L NaCl),处理5 d取样(分别取根和叶)。同时,设置100 mmol/L NaCl处理下,4个时间梯度(0,1,5,10 d)。每个重复处理3次,分别测定根和叶中的抗坏血酸过氧化物酶(APX)、超氧化物歧化酶 (SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、丙二醛(MDA)、可溶性糖和脯氨酸(Pro)的含量。
1.3 测量方法
超氧化物歧化酶(Superoxide dismutase,SOD)测定方法依据超氧化物歧化酶抑制氮蓝四唑(Nitroblue tetrazolium,NBT) 光氧化还原的50%酶量为1个活力单位,参照张雯莉,张潭等人的方法[11-12]。
过氧化氢酶(Catalase,CAT) 测定方法:H2O2于波长240 nm处有强烈吸收,CAT能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低;根据测量吸光率的变化速度测出CAT的活性[13-15]。
抗坏血酸过氧化物酶 (Ascorbate peroxidase,APX)活性测定方法:利用APX在H2O2存在的条件下使抗坏血酸量减少的原理测定[14-17]。
过氧化物酶(Peroxidase,POD) 测定方法:在有过氧化氢酶的存在下,POD能使愈创木酚氧化,生成茶褐色物质,该物质于波长470 nm处有最大吸收,可用分光光度计测量470 nm处的吸光度变化测定POD酶活性[14-17]。
丙二醛(Malondialdehyde,MDA) 含量的测定方法:MDA是常用的膜脂过氧化指标[18],在酸性和高温条件下,可以与硫代巴比妥酸(Thiobarbituric acid,TBA) 反应生成红棕色的三甲川(3,5,5-三甲基恶唑2,4-二酮),测定其最大吸收波长于532 nm处的吸收,并计算MDA含量。
可溶性糖含量的测定方法:于波长485 nm处进行比色测定[8]。
可溶性蛋白含量的测定方法:依据考马斯亮蓝G-250的方法测定[8]。
1.4 数据整理和分析
采用SPSS 16.0统计软件进行分析方差处理,显著性分析采用LSD检验法(p<0.05为差异显著)。
2 结果与分析
2.1 不同盐浓度胁迫条件下枸杞生理生化的响应
2.1.1 不同盐浓度胁迫条件下枸杞氧化伤害的程度
对于海杞品种的枸杞幼苗,叶片中的丙二醛(MDA) 含量显著高于根中的含量(p<0.05)。随着盐浓度的升高,叶片的MDA含量显著升高;而根中的MDA含量在低盐浓度(≤50 mmol/L)下差异不显著,但在高浓度(>50 mmol/L)下显著升高。结果表明,随着盐浓度的升高,叶片和根中的细胞膜氧化伤害显著增多。
不同盐浓度处理条件下枸杞叶片和根中MDA含量变化见图1。
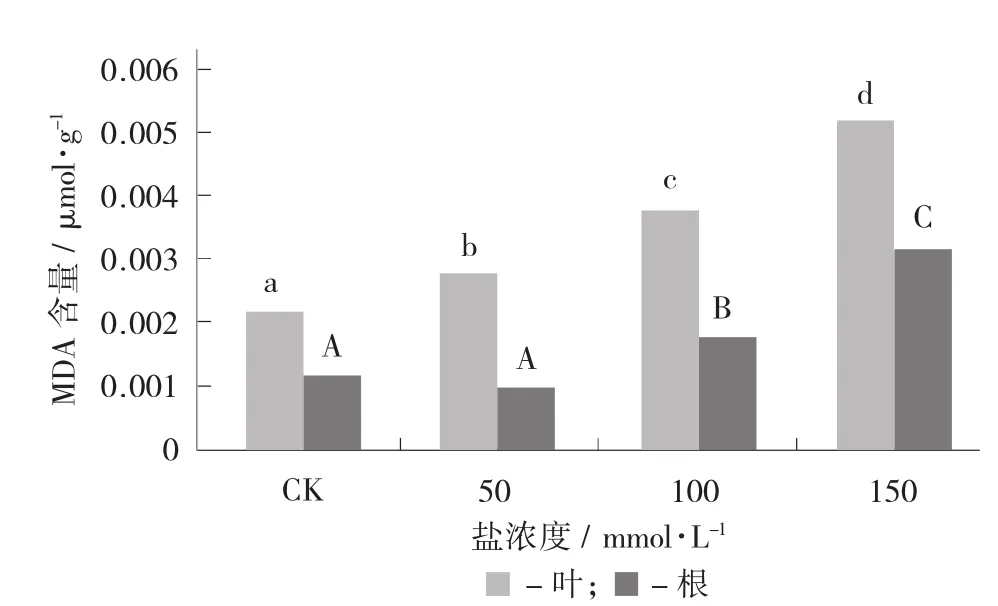
图1 不同盐浓度处理条件下枸杞叶片和根中MDA含量变化
2.1.2 不同盐浓度胁迫条件下枸杞抗氧化酶系统的响应
枸杞幼苗叶片的SOD活性与其根中的SOD活性无显著差异(p>0.05)。随着盐浓度的升高,叶片和根的SOD活性无显著变化。在低盐浓度(<100 mmol/L)处理条件下,CAT活性显著下降,而在高盐浓度处理(150 mmol/L) 条件下CAT又显著升高到对照水平;并且根和叶片对不同盐浓度的反应呈相同的趋势。随着盐浓度的升高,叶片的APX活性无显著变化;根中APX活性显著高于对照组的水平,但在不同盐浓度下差异不显著。与对照组相比,盐处理显著增加叶片中的POD活性;而根中的POD活性在低盐浓度(<50 mmol/L) 下变化不显著,但在高盐浓度下显著上升。
不同盐浓度胁迫条件下枸杞叶片和根中抗氧化酶活性的变化见图2。
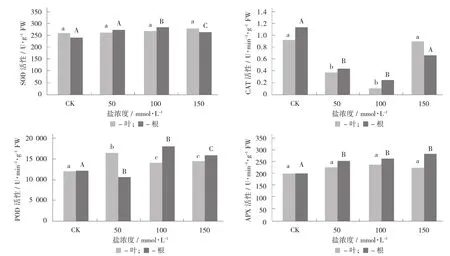
图2 不同盐浓度胁迫条件下枸杞叶片和根中抗氧化酶活性的变化
2.1.3 不同盐浓度胁迫条件下枸杞可溶性蛋白和渗透调节物质含量的变化
与对照组相比,盐处理显著降低叶片中的可溶性蛋白含量;而根中的可溶性蛋白含量随着盐浓度的升高呈显著上升趋势。
不同盐浓度胁迫条件下枸杞叶片和根中可溶性蛋白含量的变化见图3。
在高盐浓度(>50 mmol/L)下,叶片中的可溶性糖含量显著升高;根中的可溶性糖含量在低盐浓度(≤100 mmol/L)下显著增加,但在高盐浓度下又显著降低。叶片中的脯氨酸含量随着盐浓度的升高呈显著上升趋势。
不同盐浓度胁迫条件下枸杞渗透调节物质含量的变化见图4。
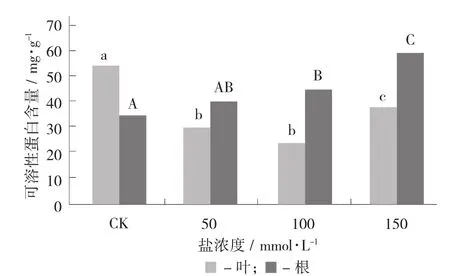
图3 不同盐浓度胁迫条件下枸杞叶片和根中可溶性蛋白含量的变化
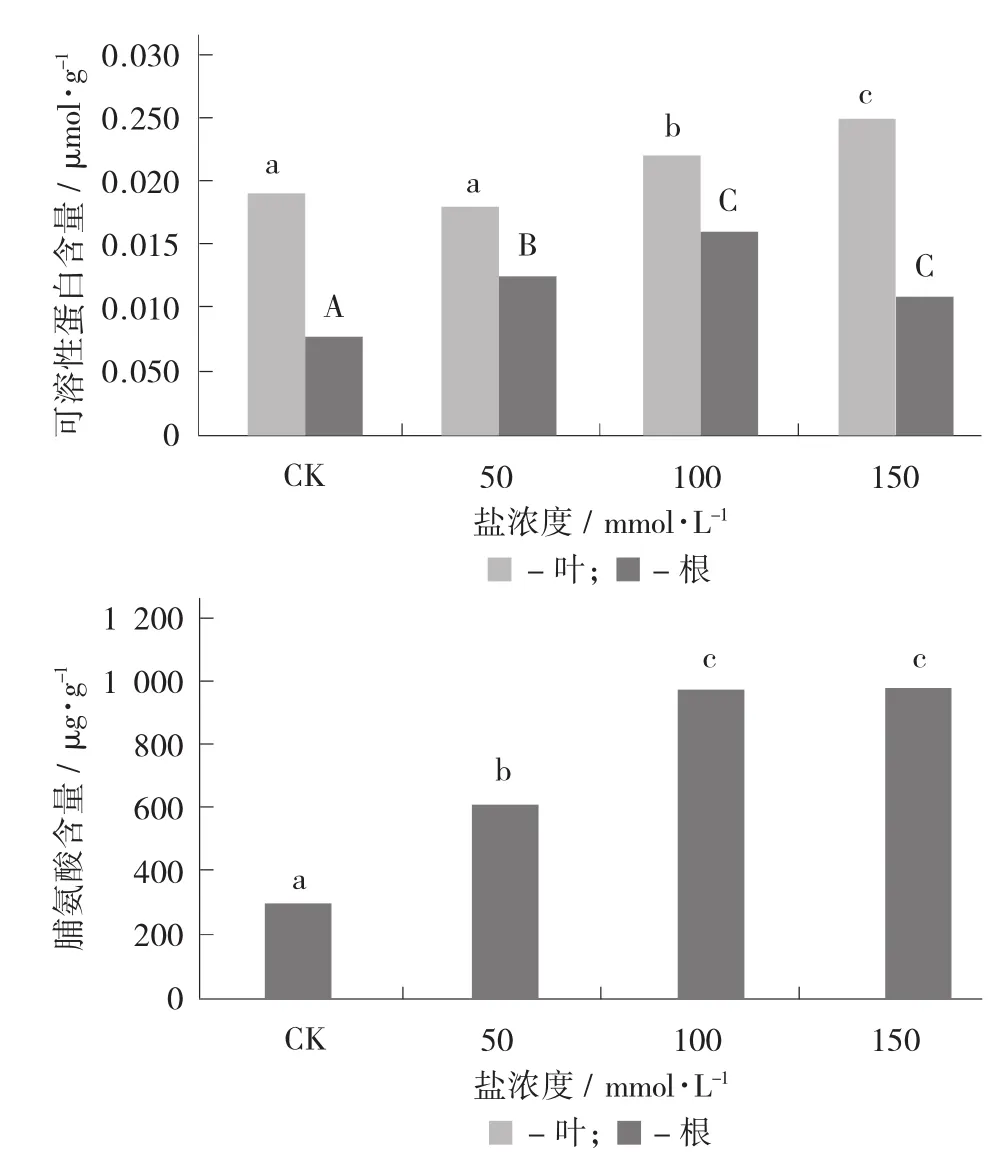
图4 不同盐浓度胁迫条件下枸杞渗透调节物质含量的变化
2.2 不同时间盐(100 mmol/L NaCl)处理下枸杞的生理生化响应
2.2.1 不同时间盐处理下枸杞氧化伤害的程度
不同时间盐(100 mmol/L) 处理下枸杞叶片MDA含量的影响见图5。
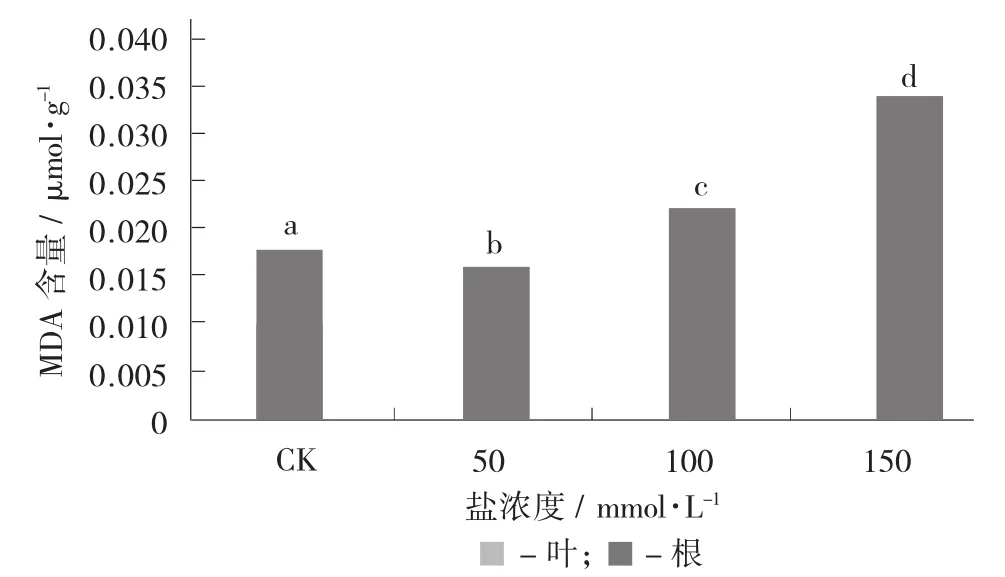
图5 不同时间盐(100 mmol/L) 处理下枸杞叶片MDA含量的影响
由图5可知,随着盐胁迫时间的变长,叶片中MDA含量显著升高,表明盐胁迫时间越长,枸杞受到的膜过氧化伤害加剧。
2.2.2 不同时间盐处理下枸杞抗氧化酶系统的响应
随着盐胁迫的时间延长,叶片中的SOD活性显著升高;根中的SOD活性呈显著上升后显著下降再显著上升的趋势,但都高于对照水平。随着盐胁迫的时间延长,叶片中的CAT活性变化不显著,但根中的CAT活性显著上升,并一直维持在较高的水平;与对照组相比,盐胁迫的时间延长显著增加叶片中的APX活性,但在处理后不同时间差异不显著;但根中的APX活性变化不十分显著。随着盐胁迫时间延长,叶片和根中的POD活性先显著下降后又上升,并高于对照的水平。
不同时间盐(100 mmol/L)处理下枸杞叶片和根中抗氧化酶活性变化见图6。
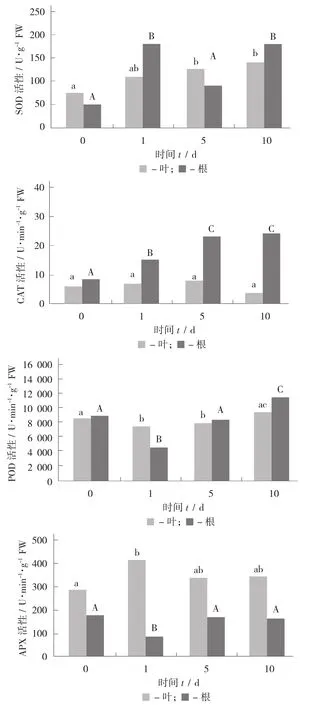
图6 不同时间盐(100 mmol/L) 处理下枸杞叶片和根中抗氧化酶活性变化
2.2.3 不同时间盐处理下枸杞可溶性蛋白和渗透调节物质含量变化
随着盐胁迫的时间变长,叶片中可溶性蛋白含量无显著变化;根中的可溶性蛋白含量则显著升高,分别为对照的145.6%,113.5%,142.8%。
不同时间盐(100 mmol/L)处理下枸杞叶片和根中可溶性蛋白含量变化见图7。
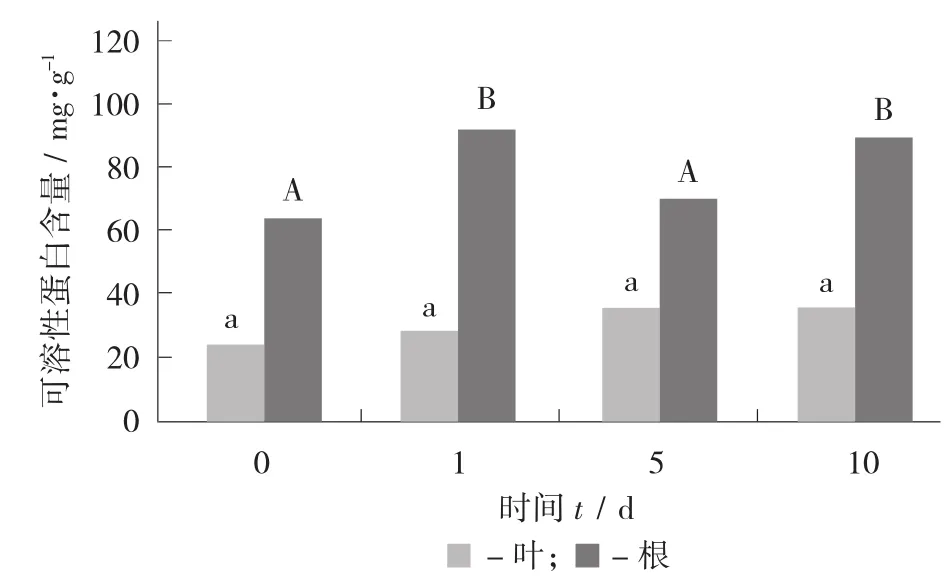
图7 不同时间盐(100 mmol/L) 处理下枸杞叶片和根中可溶性蛋白含量变化
在短时间(<5 d) 的盐处理下,叶片的脯氨酸含量无显著变化;而根中的脯氨酸含量显著升高。在长时间(10 d)处理下,叶片的脯氨酸含量显著升高,而根中的脯氨酸含量显著降低。不同时间盐处理对叶片的可溶性糖含量无显著影响。
不同时间盐(100 mmol/L)处理下枸杞渗透调节物质含量的变化见图8。
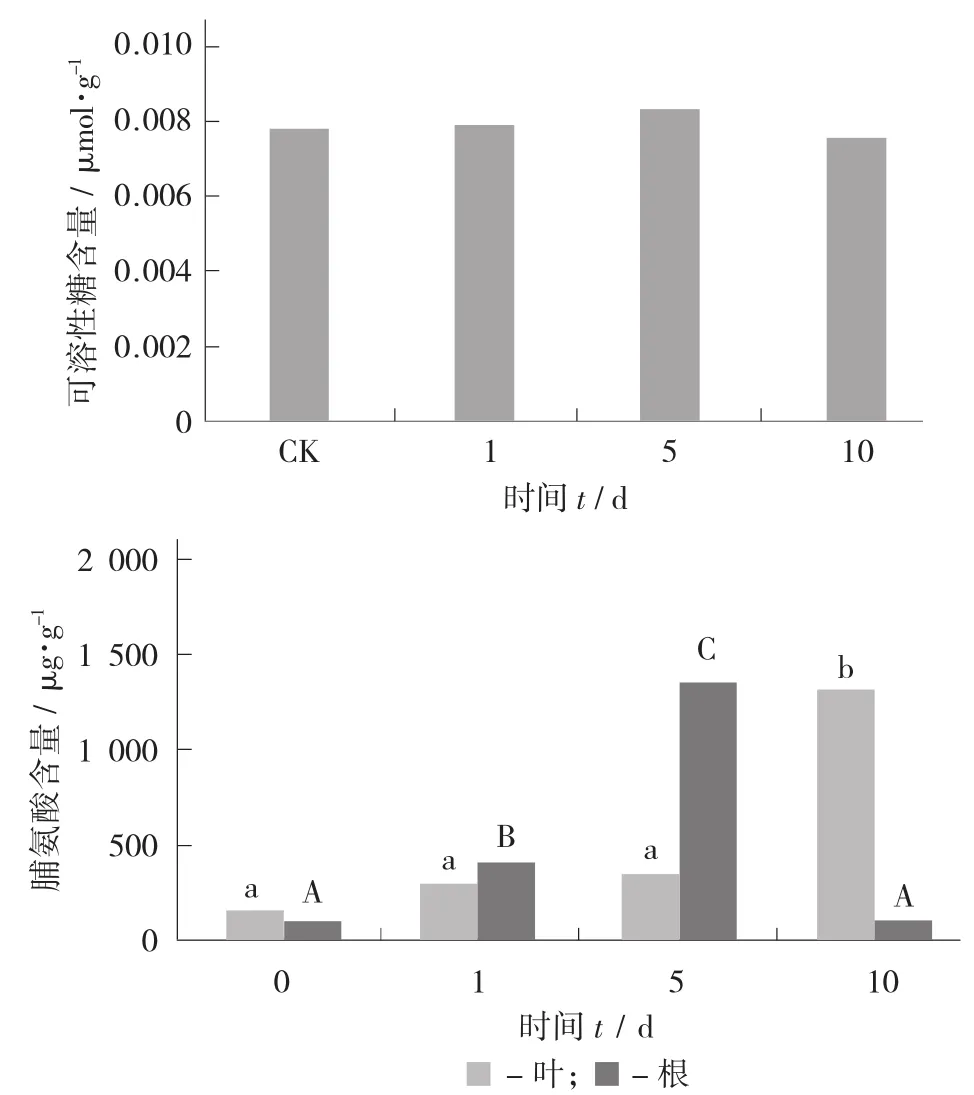
图8 不同时间盐(100 mmol/L) 处理下枸杞渗透调节物质含量的变化
3 结论
细胞膜是植物细胞和外界环境之间的界面和屏障。在盐碱环境下,盐分首先作用于细胞膜,盐胁迫损伤植物细胞质质膜,导致膜透性增大和膜脂过氧化,而膜脂过氧化产物对植物防御体系的破坏又再次加剧了膜脂过氧化作用[19]。丙二醛(MDA) 含量是细胞膜脂质过氧化作用水平反映细胞膜结构受损的程度。在试验中,由图1和图5可以看出,对照组与盐处理组相比MDA含量随着盐浓度升高和处理时间的延长,大体呈现逐渐上升趋势且差异均达到显著水平,说明盐胁迫破坏了枸杞细胞膜的稳定性,且随着盐浓度升高和处理时间的延长对枸杞叶片和根的质膜透性伤害程度不同,且作用增加。在低盐浓度(50 mmol/L) 处理下根中的MDA含量与对照无显著差异,说明低盐浓度对枸杞质膜透性伤害较小。在盐胁迫下,根作为与盐分直接接触的器官,其积累膜脂过氧化产物的速度可能要快于地上部分。但MDA含量在枸杞器官中的分布规律为叶大于根,说明根相比叶片受害较轻,而盐胁迫对叶片的严重伤害,从而严重影响其光合碳同化。枸杞MDA的变化规律与贾新平等人[19]在关于海滨雀稗耐盐能力的研究结论相一致。
植物在正常条件下,活性氧的形成和清除之间保持着一种动态平衡[20]。当受到外界逆境胁迫时,植物通常会通过自身的抗氧化酶系统和抗氧化剂对活性氧进行清除,从而提高其抗逆性[21]。活性氧清除系统主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、过氧化物酶(APX)等。SOD的主要作用就在于它能将超氧阴离子自由基快速歧化为过氧化氢(H2O2)和分子氧[22]。POD催化由过氧化氢参与的各种还原剂的氧化反应,使H2O2还原成水而减小植物体内的氧化状态,并可以与超氧化物歧化酶、过氧化氢酶相互协调配合,清除过剩的自由基。CAT是含有血红素的四聚体酶,是清除H2O2的主要酶类,可以清除线粒体电子传递、脂肪酸β氧化及光呼吸氧化过程中产生的H2O2,避免细胞因H2O2累积而产生伤害。APX是清除H2O2的主酶类,对抗坏血酸有很高的特异性和亲和性。SOD,CAT,APX和POD是植物体内清除活性氧的4种重要酶,在保护细胞膜正常代谢、控制膜脂过氧化、清除超氧自由基等方面起重要作用。试验对枸杞体内这几种保护酶的活性变化进行了分析,其活性的高低变化反映了植物对氧化损伤的修复能力。在盐胁迫条件下,随盐浓度的增加,SOD活性在根、叶中和APX活性在叶中变化差异不显著,说明一定盐浓度范围内枸杞具有一定的抵抗盐害的机制。但随着盐浓度的增加,APX活性在根中明显高于对照,而且差异达到显著。说明在盐胁迫下枸杞体内会自动增强酶的活性,缓解盐胁迫对其的伤害。POD在根和叶中的活性呈先增加后降低的趋势,说明在低浓度盐逆境胁迫下枸杞会通过自身的抗氧化酶系统和抗氧化剂对活性氧进行清除,从而提高其抗逆性,但随着盐浓度的增加,活性会逐渐降低,幼苗会受到一定程度的伤害。然而,CAT活性在根和叶中表现出先下降后上升的增长趋势。这说明植物对盐胁迫可能有一个适应的过程,要先在特定的环境下激发酶的活性,待其稳定后才起作用。随着盐胁迫时间的延长,SOD活性在叶中随处理时间的延长活性增强,一直维持在较高水平,说明枸杞具有较强的抗盐胁迫能力,胁迫长达10 d SOD活性依然没有下降;根中在胁迫初期显著上升,胁迫5 d时下降,然而在10 d时又显著上升,说明枸杞在一定胁迫下幼苗会受到伤害,活性逐渐降低。由于枸杞抗盐能力较强,在幼苗受到伤害后会诱导其增强活性,使枸杞在长时间胁迫下SOD仍能与超氧阴离子反应。APX活性在叶中胁迫初期显著上升,后期出现略有下降趋势,说明随着枸杞体内的盐积累量的增加致使活性氧平衡系统遭到破坏,使其酶活性下降,造成过剩的活性氧不能及时清除,导致枸杞对盐害的防御能力下降;在根中胁迫初期显著下降,后期的上升活性保持对照水平。说明盐胁迫可能有一个适应的过程,要先在特定的环境下激发酶的活性,待其稳定后才起作用。POD活性在叶和根中的变化趋势一致都表现为先下降后上升的趋势,说明枸杞体内抗氧化保护酶防御系统随激活需要有一个诱导的过程,从而使其对盐胁迫有一定的耐受能力。随着盐处理时间的延长,CAT在叶中变化不显著,在根中显著上升,明显高于对照并一直在维持较高水平。说明枸杞能够适应一定程度的盐胁迫,在长期盐胁迫下依然能够增强其活性,提高枸杞抗盐能力。整个抗氧化酶系统的防御能力的变化是这几种酶彼此协调作用的结果,膜脂过氧化作用涉及到多种活性氧及酶促和非酶促保护系统的复杂平衡关系。
大量研究显示,在盐胁迫下许多植物会在体内积累大量渗透调节物质,通过渗透调节和渗透保护来适应逆境条件。脯氨酸(Pro)是一种重要的有机渗透调节物质。脯氨酸除作为植物细胞质内渗透调节物质外,还在稳定生物大分子结构、降低细胞酸性、解除氨毒、作为能量库调节细胞氧化还原势等方面起重要作用。在逆境条件下(旱、盐碱、热、冷、冻),植物体内脯氨酸的含量会显著增加。植物体内脯氨酸含量在一定程度上反映了植物的抗逆性。结果显示,随着盐浓度的升高,枸杞叶片中的脯氨酸积累越多(见图4)。说明当枸杞遭遇盐胁迫时其体内主动调节来适应盐胁迫带来的伤害。随着盐胁迫的时间变长,根中脯氨酸含量第1天呈缓慢上升,到5 d与对照达到显著差异(见图8)。这一结果说明,脯氨酸的大幅增加,必须要经过前期盐胁迫的刺激和信号传导等过程。由于根向叶输送盐需要一个过程,因此叶中盐胁迫前5d差异不显著,到10 d时差异达到显著水平(见图8)。
可溶性糖(葡萄糖、果糖、蔗糖、果聚糖等)和可溶性蛋白也是2种重要的渗透调节物质。高等植物在盐胁迫或水分胁迫条件下通过渗透调节以维持细胞的膨压。渗透调节包括对无机离子及有机小分子物质的转运、累积和区隔化分布[15]。细胞内的各种碳化合物(碳水化合物、糖醇及有机酸)和含氮化合物等渗透调节物质参与细胞的渗透调节。有机溶质在维持细胞的渗透压的平衡过程中发挥了重要的作用。此外,它们还可以保护细胞质内的酶免受盐基离子的损伤。随着盐浓度的升高,枸杞叶片中的可溶性糖含量显著升高,根中的可溶性糖含量显著升高后显著降低,但仍高于对照水平。无论处理组还是对照叶片中的可溶性糖含量始终高于根中的含量。这与徐晨等人[23]在盐胁迫下水稻叶片相比根系积累了更多的可溶性糖的研究结果一致。随着盐浓度的升高,叶中的可溶性蛋白含量先显著降低后显著回升,但仍低于对照水平,根中的可溶性蛋白含量呈显著上升趋势;随着盐胁迫的时间延长,叶片中可溶性蛋白含量变化不显著,根中的可溶性蛋白含量显著升高。无论是盐胁迫浓度的增加还是盐胁迫时间的延长,可溶性蛋白在各器官中的分布规律为根>叶,与丙二醛的分布正好相反,说明在盐胁迫下,可溶性蛋白优先在地下部分积累,并利用其高含量缓解了盐分对根部的直接伤害。脯氨酸、可溶性糖和可溶性蛋白在盐胁迫期间的变化说明,有机溶质通过维持植物细胞的渗透压的方式在枸杞对抗盐胁迫的过程中发挥了重要作用。此结论与李永洁[24]在黑果枸杞幼苗对干旱胁迫的生理响应研究中发现,黑果枸杞幼苗能有效积累脯氨酸和可溶性糖来改变细胞渗透势,从而改变自身的渗透调节能力,以提高自身抗旱能力的结论一致。
植物细胞在盐胁迫下所能忍受的活性氧水平存在一个阈值,在阈值内,植物能够通过提高抗氧化酶活性来清除活性氧自由基,当超过这个阈值时,抗氧化酶活性便会受到抑制,活性氧过多积累,对植物组织会造成伤害[25]。试验中,随着盐胁迫的增强和盐胁时间的延长,抗氧化系统的各项指标并未整体出现达到某值时,其活性急速下降至很低水平,致使植株坏死的现象,说明试验设计的胁迫浓度和胁迫时间均未达到枸杞耐盐的阈值。因此,枸杞对盐渍化土壤有较强的适应能力,这与刘克彪[26]的黑果枸杞种子萌发对水分和钠盐胁迫的响应研究结论具有相似性。在高盐浓度的盐胁迫条件下,枸杞体内大量累积脯氨酸,对枸杞长期处在高盐浓度条件下起到重要的保护作用。在长时间的盐胁迫条件下,后期的抗氧化酶的累积及渗透调节物质的累积可以保证枸杞耐受长时间的盐胁迫。根据河北滨海平原土壤盐渍特点,试验探讨了枸杞在盐胁迫条件下生理生化指标的变化,揭示枸杞对盐胁迫的生理响应,对更好地利用枸杞改良盐碱地和生产高品质的枸杞具有重要科学和现实意义。综合评价,在盐胁迫下,枸杞通过SOD,CAT等抗氧化物质及可溶性糖、脯氨酸等渗透调节物质清除活性氧自由基,保护细胞膜结构,降低过氧化伤害,维持了细胞膜的稳定性和完整性,从而提高枸杞的耐盐性。在高盐浓度处理(150 mmol/L) 条件下,盐胁迫长达10 d时,抗氧化系统和渗透调节物质仍然没有达到紊乱致使不起保护细胞膜结构作用。说明枸杞抗盐性较强,适合在盐碱地种植。但试验中的浓度设置还未达到枸杞盐浓度的阈值范围,对于枸杞耐盐浓度的阈值还需进一步深入研究。
