一种新型锰金属有机框架纳米载体用于克服肿瘤缺氧增效光动力治疗
2019-04-27崔华媛汪钰翔胡一桥
崔华媛,姚 丹,汪钰翔,胡一桥
(南京大学生命科学学院,南京 210093)
光动力治疗(photodynamic therapy,PDT)是一种很有前景的肿瘤治疗新手段,其由3个重要部分组成:特定波长的光、光敏剂和组织中的分子氧。三者共同发挥作用,通过产生高水平的单线态氧(single oxygen,1O2)选择性的破坏肿瘤组织以达到治疗目的[1]。与传统的肿瘤治疗手段相比,它具有高效、选择性好、不良反应小的优点[2]。光动力治疗的效果一方面取决于光敏剂的量子转化产率及其在肿瘤组织中的浓度分布[3],另一方面与肿瘤部位的氧气浓度密切相关[4]。但由于肿瘤组织的致密性、快速代谢能力以及血管不完整性等特点,肿瘤高度乏氧,大大限制了光动力治疗对肿瘤细胞的杀伤效果[5]。
为了克服以上缺陷,研究者们寻找多种治疗策略来提高光动力的治疗效果。例如,有研究者利用纳米技术开发了更高效的光敏剂或者提高了光敏剂对肿瘤组织的靶向性[6]。同时针对氧气供应这个关键因素[7],研究者们主要通过增加肿瘤内部的氧气含量去增效光动力治疗,例如血红蛋白载氧体系、全氟化碳载氧体系、肿瘤微环境响应性产氧体系(过氧化氢酶和二氧化锰纳米粒)、水分解体系等[6-12]。近年来高氧化态的锰吸引了大量研究者的关注,因为其可以利用肿瘤微环境中过表达的过氧化氢(H2O2)特异性产氧,逆转肿瘤乏氧微环境[13-14]。一些课题组以卟啉为基础开发了一系列的新型纳米金属有机骨架纳米载体(nMOFs),其在高效递送光敏剂的同时,实现了肿瘤微环境的特异性产氧,从而提升光动力治疗的杀伤作用[15-16]。
目前,尚未有研究报道过纳米级的异核高氧化态锰金属有机框架。因此在本研究中,首次描述了一种锰簇卟啉金属有机框架纳米载体(nMn-MOF),并将其应用于肿瘤的光动力治疗。该纳米载体通过催化肿瘤微环境过表达的H2O2反应提供氧气,同时在近红外光照射下,该纳米载体还能将氧气转化成具有细胞毒性的1O2,实现光动力治疗的增效。
1 材 料
1.1 药品与试剂
硝酸铈铵、四(4-羧基苯基)卟啉(TCPP)、氯化锰四水合物[萨恩化学技术(上海)有限公司];N,N-二甲基甲酰胺(DMF)、三氟乙酸(国药集团化学试剂有限公司);CCK-8试剂(日本株式会社同仁化学研究所);HIF-1α抗体(美国赛默飞世尔有限公司);其他试剂均为市售分析纯。细胞株:CT26细胞(南京大学附属鼓楼医院)。
1.2 仪 器
CAD4/PC型X射线衍射仪(荷兰Enraf Noius公司);UV-2450紫外-可见分光光度计(日本Shimadzu公司);Safire多功能酶标仪(瑞士Tecan公司);荧光显微镜(日本Nikon公司);Zetasizer Nano纳米粒度仪(英国Malvern公司);NEXUS870傅里叶变换红外光谱仪(美国Nicolet公司);OX25克拉克氧探针(丹麦Unisense公司);FV3000激光共聚焦显微镜(日本Olympus公司);PHI 5000 X射线光电子能谱仪(日本UlVAC-PHI公司);JEM-200CX透射电镜(日本Jeol公司)。
2 方 法
2.1 化学合成
2.1.1 CeMn6O9(CH3COO)9(NO3)(H2O)2簇(锰簇)的制备 在前人研究的基础上,进行了锰簇的合成[17]。向H2O/CH3COOH(7 mL/7 mL)中缓慢加入(NH4)2[Ce(NO3)6]橙色溶液6.78 g(12.4 mmol)至近无色,向H2O/CH3COOH(4 mL/4 mL)中加入Mn(CH3COO)2·4H2O 2.02 g(8.2 mmol)并搅拌。所得到深红棕色溶液室温静置2 d后,过滤得到[CeMn6O9(CH3COO)9(NO3)(H2O)2]·H2O·4CH3COOH黑色结晶,用低温丙酮和乙醚各10 mL洗涤,真空干燥。得到0.98 g目标产物(其中锰含量54%)。
2.1.2nMn-MOF的制备 将[CeMn6O9(CH3COO)9(NO3)(H2O)2]·H2O·4CH3COOH 10.0 mg,TCPP 7.5 mg,三氟乙酸100 μL,DMF 5.0 mL置于10 mL派热克斯玻璃瓶中,超声使溶解,在150 ℃烘箱中反应24 h,冷却至室温,得到黑色棒状晶体,超声剥离分散3次(强度40%,每次6 min),得到纳米级Mn-MOF,命名为nMn-MOF。
2.1.3 (Mn3O)2(TCPP)3(Mn-MOF)的制备 取DMF 2 mL于4 mL派热克斯玻璃瓶中,加入MnCl2·4H2O 5.0 mg,TCPP 4.3 mg,三氟乙酸 75 μL,超声使其溶解。在150 ℃烘箱中反应24 h,冷却至室温,得到黑色棒状晶体[18],将其命名为Mn-MOF。
2.2 粒径、电位和稳定性试验
使用动态光散射仪(DLS)测定nMn-MOF(100 μg/mL)的粒径分布、电位,并在不同条件下对水中和血清中nMn-MOF的稳定性进行考察。
2.3 体外产氧
为了比较nMn-MOF与TCPP产氧能力,使用氧探针对O2产生量进行检测。所有溶液均用氮脱氧后,将氧探针浸入样品溶液(50 μg/mL,4 mL)中数分钟以平衡系统。将H2O220 μL(20 mmol/L)注入待测溶液中,使肿瘤微环境过氧化氢终浓度为100 μmol/L记录氧浓度变化。
2.4 体外单线态氧检测
溶液用氮脱氧后,将样品 100 μL(TCPP和nMn-MOF剂量为分别为5 μg/mL),H2O210 μL(1 mmol/L)和150 μg/mL吲哚菁绿(indocyanine green,ICG)20 μL在黑色96孔板中混合。用液体石蜡密封,创造出乏氧环境。使用635 nm的激光照射6次(30 mW/cm2),每次10 s,测量780 nm处的ICG吸收。每组实验平行3次。
2.5 光热性能检测
将不同质量浓度的样品(0,0.5 mg/mL和2 mg/mL)用635 nm的激光照射10 min(30 mW/cm2),测其温度变化。每组实验平行3次。
2.6 TCPP定量分析
为了确定MOF中配体TCPP的量,用紫外分光光度计检测在438 nm处的TCPP水溶液(5.0,7.5,10.0,15.0,20.0 μg/mL)的吸收度来获得校准曲线。根据MOF在450 nm处的吸收度,确定MOF中的TCPP量。

Figure 1 Absorption spectra of meso-tetra (4-carboxyphenyl) porphine (TCPP) aqueous solution at varied concentration (A);and the calibration plot of TCPP (B)
2.7 细胞毒性检测
为了评估nMn-MOF纳米颗粒的暗细胞毒性,用CCK-8测定其安全性。将CT26细胞以每孔5 000 个细胞的密度接种至96孔板中,培养24 h。用TCPP、nMn-MOF(配体质量浓度分别为2.5,7.5,10,12.5和20 μg/mL)处理细胞并继续培养24 h。用新鲜培养基替换培养基,然后加入CCK-8 10 μL并培养1 h。最后,使用酶标仪在450 nm处测量吸收度。对照为RPMI 1640培养的细胞。
为了评估在乏氧和常氧条件下nMn-MOF的治疗效果,与上述实验类似,将CT26细胞以每孔5 000 个细胞的密度接种到两个96孔板中。培养24 h后,将一个平板转移到含有5% CO2和95% N2的乏氧环境中,另一个依然在常氧条件下培养,两者均继续培养6 h。将TCPP或nMn-MOF以2.5,7.5,10,12.5和20 μg/mL的剂量加入到细胞中。在乏氧和常氧条件下再分别培养4 h后,用LED照射细胞2 h。将细胞进一步温育24 h,使用CCK-8法测定细胞活力。
为了评估nMn-MOF的催化性能,研究了不同H2O2质量浓度下的nMn-MOF的光细胞毒性。H2O2的安全范围是100~300 μmol/L,将nMn-MOF(以配体质量浓度计12.5 μg/mL)和梯度浓度的H2O2加入细胞中,至乏氧环境孵育。2 h后用LED灯照射2 h。使用CCK-8法测定细胞活力。
2.8 nMn-MOF的细胞摄取
为了研究nMn-MOF与CT26细胞之间的相互作用,在24孔板中每孔接种CT26细胞2.5×104个,培养24 h。向每个孔中加入nMn-MOF(以配体质量浓度计5 μg/mL)并孵育1 h。用PBS洗涤2次,加入多聚甲醛固定,用1滴3%甘油将细胞载玻片倒置在另一个载玻片上,用共聚焦显微镜拍摄细胞的荧光图像。
2.9 nMn-MOF改善细胞乏氧研究
为了研究nMn-MOF对CT26细胞乏氧的改善作用,将CT26细胞以每孔2.5×104个细胞的密度接种到24孔板中,培养24 h后,将细胞置于乏氧环境中4 h。细胞分成3组,从乏氧环境中取出后立即将PBS,TCPP,nMn-MOF加入细胞中并在低氧环境中孵育2 h。用PBS处理后,将细胞与兔抗小鼠标记的HIF-1α抗体(1∶800稀释)在37 ℃温育1 h,然后用FITC标记的大鼠抗兔的IgG(1∶800稀释)染色,37 ℃保温1 h。用荧光显微镜拍摄细胞的荧光图像。
2.10 nMn-MOF对CT26细胞中活性氧的影响
在24孔板中每孔接种CT26细胞2.5×104个并孵育24 h。将细胞分成3组:PBS,TCPP,nMn-MOF,在乏氧环境下孵育4 h。取出后,分别加入PBS,TCPP(12.5 μg/mL),nMn-MOF(以配体质量浓度计为12.5 μg/mL)。加入PBS稀释的H2DCFDA,每孔100 μL。将3组细胞再次转移到乏氧环境中培养2 h。取出后,用LED照射细胞 2 h。取出细胞并用PBS处理,用荧光显微镜拍摄细胞的荧光图像。
3 结果与讨论
3.1 nMn-MOF的表征
nMn-MOF在X射线粉末衍射(powder X-ray diffraction,PXRD)中显示,其峰高8.03°,衍射峰宽20.30°(图2-A),与Mn-MOF相同,表明nMn-MOF与Mn-MOF有类似的结构,这种结构与Zhou课题组报道的结构类似[19]。紫外-可见吸收光谱证实了nMn-MOF改善了Mn-MOF的光物理性质:TCPP在419 nm处具有分裂的Soret带,在516,549,590和647 nm处具有4个Q带,这是由于S0→S2和S0→S1的跃迁产生的。在nMn-MOF纳米载体合成过程中,在468 nm处的Soret带红移,仅剩两个与TCPP相关的Q带,峰值出现在563和601 nm(图2-B)[17]。傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)也说明了nMn-MOF保留了锰团簇的特征吸收峰,随着配位螯合的形成,TCPP羧基官能团的C==O在1 707 cm-1处的伸缩振动明显减弱,在1 680 cm-1处出现了新的弱吸收峰。nMn-MOF在1 613 cm-1和1 427 cm-1处出现相同的吸收峰,这可能是由于C==C骨架振动和C-H面内弯曲振动产生的。实验证明,nMn-MOF和TCPP分子有类似的红外光谱(图2-C)。TCPP和nMn-MOF的荧光光谱显示它们在419 nm的激发光照射下,在658 nm处荧光较强(图2-D),或可应用于细胞摄取成像。

Figure 2 (A)PXRD pattern of in nanoscale Mn-metal-organic framework (nMn-MOF) comparison to Mn-MOF and Mn-clusters;(B)UV-visible spectra ofnMn-MOF,Mn-Clusters,TCPP, physically mixed TCPP and Mn-clusters;(C)FT-IR spectrum ofnMn-MOF and TCPP;(D)Fluorescence spectrum ofnMn-MOF and TCPP
透射电镜(TEM)拍摄了nMn-MOF的纳米形态(图3-A)。单个nMn-MOF纳米粒的尺寸在200 nm左右。动态光散射(DLS)测定结果表明,nMn-MOF在去离子水中的平均直径为210 nm,多分散指数为0.159,Zeta电位为-15.43 mV(图3-B)。在24 h内,nMn-MOF纳米粒在水和血清中的尺寸没有显著变化。将nMn-MOF用X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)检测,结果表明Mn4+作为单组分对应物的移位结合能为641.00 eV,而Mn簇中的Mn4+为641.37 eV,不同于Mn-MOF中Mn2+的642.20 eV(图3-C)[18],这表明nMn-MOF具有高氧化性,可以将H2O2转化为O2。氧探针检测的O2质量浓度随时间变化的规律显示,与TCPP相比,nMn-MOF能够产生更多O2(图3-D)。
Figure 3 (A)TEM image ofnMn-MOF;(B)Size distribution and Zeta potential ofnMn-MOF;(C)XPS overlay ofnMn-MOF (red line) with its single component counterparts,Mn-clusters (blue line);(D)Time-dependent O2generation probed by an oxygen sensor
3.2 nMn-MOF的体外研究
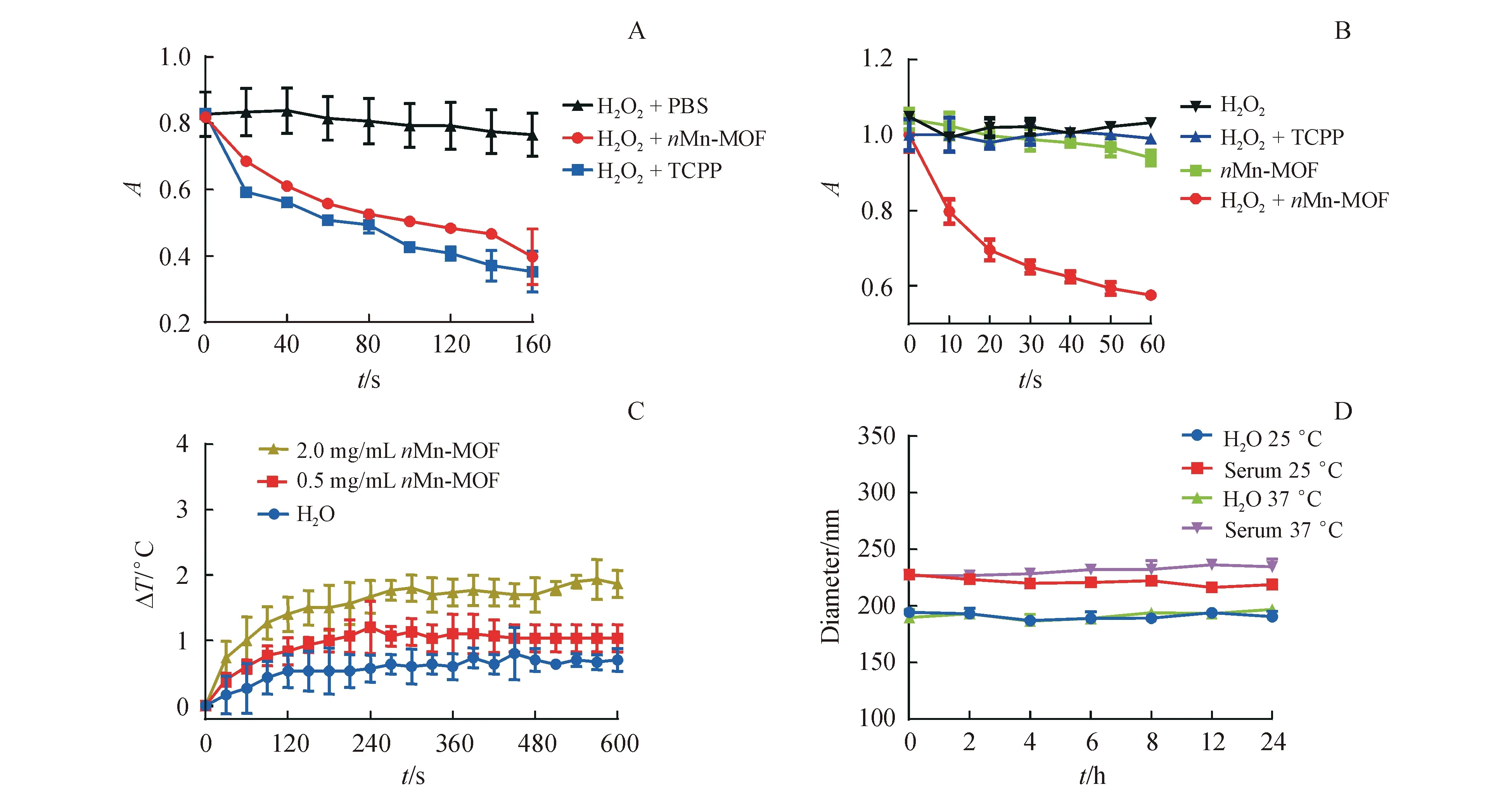
根据实验方法考察了常氧和乏氧条件下nMn-MOF的1O2产生情况。在常氧环境下,水中的nMn-MOF和游离的TCPP均以光照依赖性的方式产生1O2(图4-A)。在体外模拟的乏氧环境中(100 μmol/L H2O2,<1% O2环境)对nMn-MOF和TCPP的1O2生成效率进行了比较。在没有H2O2存在时照射nMn-MOF几乎不产生1O2。在乏氧条件下,向nMn-MOF中添加H2O2后,1O2生成量显著增加,这可能是由于锰簇的高氧化性造成的。与其相反,在H2O2(100 μmol/L)低氧环境中TCPP和对照组经近红外灯照射后仅产生微量的1O2(图4-B)。此外,还评估了nMn-MOF的光热效应。在nMn-MOF(2.0和0.5 mg/mL)和水中未见温度明显升高(图4-C)。结果表明,nMn-MOF可以作为PDT光敏剂,对光热疗法增效不明显。此外,对制剂的稳定性研究显示,nMn-MOF在24 h内不论是在25 ℃还是在生理条件下都有较好的稳定性(图4-D)。
在此基础上,进一步研究了纳米载体的生物学效用。在分析细胞光毒性之前,使用CCK-8考察nMn-MOF对CT26细胞的暗毒性。即使在质量浓度20 μg/mL时,nMn-MOF仍未对CT26细胞显示出明显的暗毒性(图5-A)。在常氧条件下,nMn-MOF和TCPP对CT26细胞都表现出较高的光毒性(图5-B)。另外,在低氧环境下,仅光诱导的nMn-MOF对CT26肿瘤细胞仍表现出较高水平的细胞杀伤性,这种高光细胞毒性可能是锰簇的氧供效应引起的(图5-C)。进一步研究H2O2的浓度梯度显示,在没有近红外光照射时,即使nMn-MOF质量浓度高达300 μmol/L,CT26细胞的活性仍保持在90%左右。这是由于H2O2在nMn-MOF作用下迅速分解为O2。在近红外光下照射下,产生的氧进一步转化为具有细胞毒性的1O2(图5-D)。
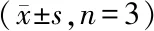

由于在乏氧环境下nMn-MOF的活性氧(oxygen species,ROS)产率较高,用CT26细胞研究了nMn-MOF在体外的治疗效果。激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)反映了其被细胞摄取和分布的情况。CLSM显示出较强的红色荧光信号,这表明nMn-MOF能够被CT26细胞内化(图6-A)。此外,乏氧会导致CT26细胞中HIF-1α积累。用nMn-MOF处理后,HIF-1α的荧光强度明显降低(图6-B)。这些结果表明,nMn-MOF可有效改善细胞水平的乏氧。利用H2DCFDA作为ROS探针,继续研究了nMn-MOF在乏氧条件下在细胞内ROS的产生情况,nMn-MOF在乏氧环境中绿色荧光强于CT26细胞,这表明其能产生ROS(图6-C)。综上所述,即使在乏氧肿瘤微环境下,nMn-MOF仍可发挥增效光动力治疗的作用。

Figure 6 Cellular uptake and penetration ofnMn-MOFinvitro
A:Confocal laser scanning microscopy (CLSM) images of CT26 cells after treatment withnMn-MOF.Red regions indicated localization ofnMn-MOF in the cells;B:CLSM images of green fluorescent intranuclear HIF-1α expression in cells;C:CLSM images of green fluorescent intranuclear ROS expression in cells
4 结 论
在本研究中,开发了一种新型锰-金属有机框架纳米载体。实验结果表明,这一纳米载体能改善PDT中的肿瘤乏氧,产生的单线态氧可有效杀伤肿瘤细胞,在PDT治疗中发挥重要作用。同时,nMn-MOF可能在废水处理,免疫佐剂,核磁共振成像(NMRI)等方面也具有一定的应用价值。
