透明质酸修饰纳米胶束用于靶向肿瘤治疗及药物释放行为的研究进展
2019-04-27孙晓峰陈正炜潘梓浩徐子特
孙晓峰,刘 涛,凌 芸,陈正炜,潘梓浩,徐子特,罗 令
(1湖南中医药大学医学院组胚教研室,长沙 410208;2湖南中医药大学医学院,长沙 410208;3湖南中医药大学中西医结合学院,长沙 410208;4中南大学湘雅三医院骨科,长沙 410013)
在肿瘤药物治疗中,降低毒性的关键是利用恶性肿瘤和正常组织之间的解剖、病理生理学和微环境差异来积极地靶向肿瘤。分化簇44(CD44)是透明质酸(HA)高亲和性的受体,其在肿瘤细胞中过表达,是一种理想的受体[1]。目前已有多种抗肿瘤药物纳米递送系统上市,如Doxil、Daunoxome、Abraxane、Genexol-PM等。近些年来,纳米胶束的应用也取得了较多进展,其中Supratek公司开发的阿霉素纳米胶束(SP1049C)于2007年12月被用于上胃肠道转移性腺癌的Ⅲ期临床试验。目前,SP1049C已被美国FDA认定为治疗食管癌的孤儿药,疗效显著。本文综述了HA纳米胶束用于肿瘤靶向及释放行为的研究进展。体内外(HA)实验研究表明,基于HA的纳米载体是靶向特异性的药物和基因传递平台,在临床肿瘤治疗中具有良好的应用前景。
1 透明质酸和CD44受体
HA是一种天然的糖胺聚糖,由Meyer和他的助手John于1934年首次从牛眼玻璃体中提取出来[2]。这种大分子聚合物的相对分子质量随着链长度的变化而变化,从几千到数百万道尔顿不等[3]。众所周知,与受体结合的HA有助于血管生成、组织形成、细胞信号传导、伤口愈合和组织水合作用,在细胞外基质中扮演着关键角色[4-5]。另外,HA能够增强其受体高表达细胞的药物摄取率,从而提高药效[6]。CD44是HA的主要受体,是一种在许多肿瘤中过度表达的跨膜糖蛋白[7]。CD44受体在基因表达上有可变的外显子拼接法和转录后修饰,存在许多亚型[8],其在N端附近含有一个特定于HA的结合域,而与HA结合是CD44受体大多数功能的起始步骤[9]。
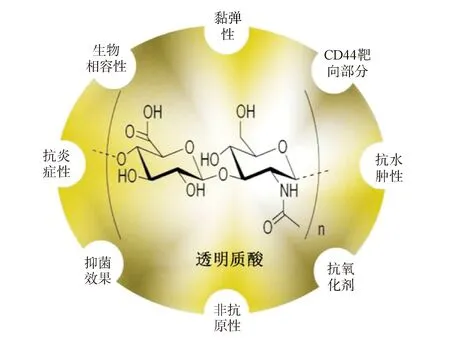
图1 透明质酸(HA)的结构和功能
1.1 HA-CD44在肿瘤进展中的相互作用
HA和CD44表现出一系列信号通路之间的相互作用,这些信号通路决定了肿瘤细胞的黏附、转移和生长情况,能够引起恶性肿瘤发展和肿瘤转移。Anttila等[10]通过评估HA水平和CD44的表达,证明了基质HA积累与肿瘤进展相关,但是他们认为HA的聚集与人卵巢癌细胞表面的CD44表达无关。另一个重要方面是CD44天然体和变异体在肿瘤中都有表达,且参与肿瘤的发生,它们在HA受体结合中起着关键作用。CD44v6是CD44的一种变异体,能够激活Wnt/β-catenin通路,并影响结肠肿瘤干细胞的转移[11]。Zhao等[12]的研究发现CD44在肺癌细胞中通过激活丝裂原蛋白激酶(MAPK)信号引起细胞增殖,然而删除CD44的基因编码会抑制小鼠体内Kras介导的肺腺癌增殖。此外,HA-CD44相互作用会促使锚定蛋白(ankyrin)与MDR-1结合,排出化疗药物,导致肿瘤细胞化疗耐药[13]。在另一项研究中,Chen和Bourguignon[14]指出HA与CD44相互作用能够促进c-Jun信号传导和miRNA21表达,导致三阴性乳腺癌细胞中Bcl-2/IAP上调表达以及出现化学抗性。
1.2 CD44是肿瘤诊断中的生物标志物
在各种肿瘤细胞中,CD44或其亚型可作为诊断肿瘤的生物标志物。Wu等[15]报道了在基底乳腺癌中CD44的mRNA和蛋白高表达水平之间的关系,强调CD44作为诊断基底乳腺癌的生物标志物的有效性。此外,Desai等[16]的一项研究发现,CD44的变异体CD44v和CD44s在前列腺癌PC3细胞表面高度表达,并在PC3/OPN克隆表达高水平全长度骨蛋白时增加。其中,CD44v9被报道可以作为一种生物标志物检测上尿路上皮癌的复发率和死亡率[17]。另外一项大规模免疫组织化学分析发现,CD44v6在识别卵巢癌远处转移患者中起着至关重要的作用[18]。CD44的变体还可以作为早期检测工具来预测肿瘤复发。有研究表明,在原发性胃癌组织中,CD44v9能够检测曾接受过多次早期胃癌治疗患者的复发[19]。基于以上研究报道可以得出,无论是单个CD44,还是与另一种蛋白相互作用的CD44及其变异体,都在肿瘤诊断中起着重要作用。
2 CD44受体在肿瘤中过表达
HA的药物纳米载体在多种肿瘤中的效果已经得到了验证,研究显示有巨大成效。下列所述肿瘤都表现出CD44受体的过度表达,基于HA的药物载体治疗是它们的理想选择。
2.1 乳腺癌
CD44受体在许多乳腺癌亚型中过度表达,其中在三阴性乳腺癌中显著过表达[20]。Berner等[21]研究报道,在110例乳腺癌患者中,CD44s,CD44v5,CD44v6,CD44v7呈阳性的比例分别为60%、79%、74%和54%。Li等[22]在一个装满紫杉醇(Taxol)的HA-脱氧胆酸(DOCA)共聚物中合成了平均直径为120 nm的靶向胶束,实现了34%的载药量。利用MTT实验分析并对比这个配方与临床上使用的紫杉醇在MDA-MB-231乳腺癌细胞和正常成纤维细胞(HELF)中的细胞毒性,结果显示,与紫杉醇相比,紫杉醇负荷的HA胶束对CD44阳性的肿瘤细胞有较强的细胞毒性;在对HELF细胞进行测试时,该制剂的毒性小于相同浓度的紫杉醇。这些体外数据的结合显示出一种有前景的配方,其具有更大的潜力来靶向肿瘤和提高正常细胞的安全性,表明积极的肿瘤靶向是一个有利的选择。卢增红等[23]发现乳腺癌患者淋巴管内HA Layilin受体高表达可能与肿瘤细胞的转移有关。马鸿云等[24]合成了乳腺癌靶向的载药HA纳米粒HACDDP-DOX,并发现该纳米粒可有效靶向乳腺癌细胞,抑制小鼠移植性乳腺癌。
2.2 结肠直肠癌
CD44的几种亚型在结肠直肠癌(CRC)中过度表达。Amirghofran等[25]研究发现,在健康人体内CD44的含量为[(696±259) ng/mL],而在结直肠癌病人中,CD44的含量为[(875±204) ng/mL],显著高于健康人体的数值。由于HA胶束已被证明在体外有效,因此结肠直肠癌治疗成为了一个对HA胶束研究有前景的靶组织[26]。Pitarresi等[27]根据CD44靶向策略,通过结合聚乳酸(PLA)的HA形成共聚物,根据分子的两亲性性质,在水溶液中自组合聚合成胶束,设计出的这种新的胶束配方能够治疗结肠癌。此外,通过连接聚乙二醇(PEG)可形成聚乳酸胶束,产生聚乙二醇胶束,HA-PLA和HA-PLA-PEG胶束均含有抗肿瘤药物阿霉素;进一步测试表明,与非聚乙二醇化的制剂相比,HA-PLA-PEG胶束显示药物的装载量增加。在处理CD44阳性和CD44阴性的细胞时加入阿霉素负荷的配方,比较两种细胞的细胞毒性。HCT-116人结肠癌细胞由于CD44受体的过度表达而被用作CD44的靶标,而正常的人成纤维细胞则被用于比较差异。MTT细胞增殖试验证明,HA-PLA和HA-PLA-peg胶束制剂均具有靶向细胞毒性,与用载药胶束治疗的正常组织相比,HCT-116结肠癌细胞的细胞活力显著降低。Pitarresi等[27]将这一差异归因于通过HA-CD44相互作用的胶束摄入的增加,并认为HA-PLA配方是一种有前途的体外肿瘤治疗手段。
2.3 肝癌
CD44在肝癌细胞中过度表达,Amirghofran等[25]研究发现CD44v5,CD44v7-8和CD44v10在非肿瘤区的表达非常微弱,然而在107例肝癌患者中,CD44s,CD44v5,CD44v 6,CD44v7-8和CD44v10的阳性病例分别为34%、49%、27%、38%和24%。Son等[28]利用PLGA聚合物设计了CD44靶向胶束,将羧基末端与六亚甲基二胺结合,加入HA偶联形成PLGA-胺共聚物,随后形成了多烯紫杉醇负荷HA胶束外壳,是一种尺寸约为50~200 nm的球形形态,其靶向HepG2肝癌细胞,实现了50%甚至更高的药物释放率,药载量为5%~11%。此外,MTT细胞活力分析多烯紫杉醇负荷HA胶束处理后的结果表明CD44阳性HepG2肝癌细胞活力呈浓度依赖性降低。然而,在相同浓度的配方中预处理过量自由HA时,细胞表现出更高的增殖。他们用荧光素异硫氰酸酯(FITC)来标记胶束,内化后观察到的荧光强度在预先处理了HepG2细胞的条件下比预先处理自由HA条件下多出8倍。这些观察结果证实HA共轭胶束利用CD44通路进入细胞,体现了这种方法在靶向CD44过度表达的肝肿瘤治疗中的应用前景。
2.4 胰腺癌
Li等[29]研究发现CD44在73.1%胰腺瘤组织中呈阳性。Kesharwani等[31]将HA与苯乙烯马来酸(SMA)相结合,在水溶液中形成了自组合的HA-SMA胶束。针对平均直径114 nm的靶向胶束,一种新型药物3,4-二氟苯磺酰亚胺(CDF)被用于治疗CD44阳性的MiaPaCa-2和AsPC-1胰腺癌细胞系。游离的二氟苯磺酰亚胺在MTT实验中显示了对胰腺癌细胞的高毒性,这种效力在HA纳米胶束配方中通过靶向递送进一步增加。对比靶向的HA-SMA-CDF胶束与非靶向SMA-CDF胶束发现,结合HA后,细胞摄取和离体癌的毒性增加,表明靶向治疗CD44过表达的胰腺肿瘤干细胞可能会助力肿瘤抵抗传统肿瘤治疗[30-31],CD44受体的过表达有助于患者适应使用HA结合的胶束治疗。
3 药物释放与纳米胶束内外部环境差异的关系
为系统性管理HA胶束,药物必须封装在胶束内核心。过早的药物泄漏会导致靶向部位的活动减少以及增加非靶向组织的不良反应,而药物释放的百分比和释放率是治疗策略整体疗效的关键因素。为了探索药物释放的最佳条件,许多研究集中于利用纳米胶束内部和外部环境之间的差异或者通过外部刺激后处理应用来诱导细胞溶胶中的药物释放。
3.1 pH敏感性
Wu等[32]在不同的pH条件下观察到胶束在酸性环境中会有更强的释放。鉴于人体的生理pH是7.4,而溶酶体环境的pH是5.5,他们提出酸性条件下激活药物释放有利于药物传递到靶向肿瘤细胞。Stenzel等[33]利用既定的点击反应概念附加硫醇盐HA(HA-SH)到磷酰胆碱的侧链双键设计了一个pH敏感HA胶束配方。这一共聚物自组装成具有10%药载量的阿霉素胶束,在pH 7.4和pH 5.0下对该制剂的药物释放进行了研究。48 h后,酸性条件(pH 5.0)下的阿霉素释放几乎是在pH 7.4生理缓冲条件下胶束释放的两倍。姜伟伟等[34]指出,在pH 5.0条件下紫杉醇的药物释放量明显高于生理环境(pH 7.4)介质中药物的释放量,且在72 h后有突释现象,可以实现在酸性条件下靶向治疗肿瘤细胞的效果。由此可以得出,酸性条件更有利于药物释放并靶向肿瘤细胞。
3.2 氧化还原敏感性
在肿瘤研究中,胶束药物递送策略常见疏水药物释放缓慢和对靶位点缺乏特异性这两个缺点,它们会增加药物副作用,同时限制抗肿瘤效果。为了克服这些挑战,Li等[35]合成了HA-ss-XXXX(DOCA)聚合物作为用于抗肿瘤药物紫杉醇的递送系统。通过结合HA,共聚物通过二硫键连接,预期靶向受体CD44的特异性增加,且细胞溶胶中谷胱甘肽(GSH)的减少会导致更快的药物释放。研究显示,HA-ss-DOCA胶束显著提高了紫杉醇的载药量,包封率为93.2%,载药量达到34.1%。在10 mmol/L GSH存在下观察到HA-ss-DOCA胶束缓慢释放紫杉醇,前4 h内只有6.3%的紫杉醇被释放;而当GSH浓度高达20 mmol/L时,4 h内释放约55.2%的PTX,24 h释放90%以上。他们证实了二硫键在此配方中的重要性,并在最高浓度(20 mmol/L)GSH的情况下,对未连接二硫化物的HA-DOCA胶束进行了合成和测试。在这个测试中,只有6%的紫杉醇在最初的4 h内被释放。MTT细胞增殖试验的结果与初步结果一致,HA-ss-DOCA和HA-DOCA治疗72 h后的IC50分别为25.6和56.6 ng/mL。他们使用流式细胞仪发现与预处理过量HA的MDA-MB-231细胞相比,在CD44表达MDA-MB-231人乳腺癌细胞中HA靶向细胞摄取增加。因此,基于这些结果,Li等[35]展望了HA-ss-DOCA胶束在胞质减少环境中,CD44阳性肿瘤和工程药物释放的活性靶向的潜在应用。同样地,余丽丽等[36]研究发现,在聚乙二醇-聚甲基丙烯酸甲酯的结构中引入含有二硫键的交联结构,可获得具有氧化还原敏感性的纳米胶束,该胶束中的二硫键在细胞内的高GSH水平下快速断裂,可实现药物的细胞内控制释放。
3.3 高强度聚焦超声
Liang等[37]研究了高强度聚焦超声(HIFU)在HA-C16胶束制剂中控制药物释放的应用。HIFU聚焦波能够通过干扰聚合物胶束外壳中的聚合物键来诱导药物释放。在没有使用HIFU治疗的情况下,体外释放药物是一个稳定的过程,在最初的120 h中只有37%的药物被释放。应用HIFU后,60%的胶囊在治疗后的第40小时被释放。此外,Zheng等[38]观察到HIFU暴露后细胞摄取增加,HIFU通过细胞膜增加渗透性,表明HIFU在体外诱导药物摄取和释放、增强药物传递到肿瘤方面都具有应用可能性。他们还比较了无HIFU条件下载药12 h和载药36 h的DTX胶束的释放情况,发现HIFU触发DTX突然释放后,DTX释放模式加快。此外,有研究者通过酰胺反应在HA上接枝了硝基咪唑,并通过超声法制备了缺氧响应型聚合物胶束,利用DLS,AFM,TEM等手段表征了聚合物胶束缺氧响应前后大小及形貌的变化,利用HPLC研究了胶束的药物释放特性。结果表明该聚合物胶束对缺氧具有响应性,负载药物的胶束粒子在常氧环境下不会发生突释,而在缺氧环境下药物可以快速完全地释放,证明该胶束粒子具有作为抗肿瘤药物载体的潜力,并为药物控释体系的研究提供了新的思路。
3.4 HA酶
有研究指出,乳腺肿瘤细胞内部含有高浓度的HA酶(hyaluronidase,HAase),可以把HA为基础的药物载体快速降解,释放药物并作用于肿瘤细胞[39-40]。Feng等[41]构建了一种肿瘤靶向和多重刺激响应的核壳结构纳米粒,该纳米粒可以通过乳腺癌细胞MCF-7上的CD44受体介导进入细胞,然后在HA酶作用及近红外光照射和溶酶体弱酸性环境的刺激下,协同把药物释放出来,结果显示实验小鼠体内的肿瘤体积抑制率最高达到88.9%。因此,肿瘤部位高表达的HA酶能够快速降解HA,从而促进药物释放。Csapó等[42]发现从cl-HyA/50%中释放KP的动力学是最快的,但是控制得很差。通过将链接器从50%添加到75%和100%进入聚合物,就有可能实现对药物从聚合物载体释放更精确的控制。cl-HyA/100%在第7小时结束时,药物总含量释放了近80%。另一方面,使用最少的表面活性剂,在实验过程中只有60%的活性成分溶解。
4 结 论
体内外研究都有力地证明将HA结合到胶束的外表面更有利于药物靶向肿瘤细胞。与被动靶向相结合,这种主动靶向策略是向CD44过度表达的肿瘤提供化疗药物的一个很有发展潜力的途径。基于HA的纳米胶束在生物学上是安全的,它具有药物释放、血液相容性和系统性肿瘤靶向的巨大潜力,在临床肿瘤治疗中具有良好的应用前景。
