天山1号冰川前缘土壤中光合细菌的分离鉴定及氮转化能力分析
2019-04-26刘珍珠李玉国刘欢欢马贵军刘建伟晁群芳
刘珍珠,樊 振,高 雁,李玉国,刘欢欢,3,马贵军,娄 恺,刘建伟,晁群芳,曾 军*
(1.新疆农业科学院微生物应用研究所,新疆 乌鲁木齐 830091;2.新疆特殊环境微生物实验室,新疆 乌鲁木齐 830091;3.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;4.新疆天康饲料科技有限公司生物添加剂分公司,新疆 乌鲁木齐 830013;5.乌鲁木齐膳源生态农业有限公司,新疆 乌鲁木齐 830037)
【研究意义】冰川前缘原生裸地是冰川退缩后暴露的一类营养匮乏,无植物生长,贫瘠的土壤[1]。大量研究表明土壤中氮含量是这种贫瘠土壤发育,微生物原生演替主要驱动力和限制性因素[2]。【前人研究进展】本实验室前期通过分子生物学技术对天山1号冰川前缘土壤中氮循环功能微生物的原生演替进行了研究,结果发现该冰川前缘土壤中存在大约5 %~10 %紫色非硫光合细菌(例如,类球红杆菌和沼泽红假单胞菌)[1-2]。紫色非硫光合细菌(Non-sulfur Purple potosynthetic bacteria,P,SB)因其能够在黑暗有氧和光照厌氧条件下进行固碳、降解大分子有机物、固氮、硝化、反硝化和硫化物氧化等代谢,而被广泛的应用于各种有机含氮废水处理[3]。其中,类球红杆菌和沼泽红假单胞菌是PSB中目前最为广泛使用的菌株,全基因组测序结果显示这两种细菌包含固氮(nifH)和反硝化基因(nirK)[4],这表明其在氮循环过程中可能起到独特的作用。【本研究的切入点】本研究通过对冰川前缘土壤进行光合细菌定向富集、分离与纯化、以其能够分离得到可培养菌株,通过对其生理生化和氮转化(氨氮和硝酸盐降解以及亚硝酸盐的生成)能力进行研究。【拟解决的关键问题】为揭示冰川前缘土壤氮素循环提供模式菌株以及为环境有机污染物降解和修复提供优良菌株。
1 材料与方法
1.1 供试材料
菌种来源:光合细菌分离自新疆天山1号冰川退缩后新暴露出的土壤(43°06′N, 86°49′E))。培养基:富集培养基为RCVBN培养基[5]:乙酸钠3 g;丙酸钠1 g;硫酸铵1 g;硫酸镁0.2 g;氯化钠1.0 g;磷酸二氢钾0.3 g;磷酸氢二钾0.5 g;氯化钙0.05 g;酵母膏0.1 g;微量元素1 mL;蒸馏水1000 mL;pH 7.0。分离、纯化培养基:RCVBN固体培养基,添加1.5 %琼脂。仪器:超净工作台(SW-CJ-2FD)、灭菌锅(YXQ-LS-75)、紫外分光光度计(UV-2550)、pH仪(多参数测试仪S220)、电子天平(JY20002)、离心机(20PR-52)。
1.2 试验方法
1.2.1 光合细菌的富集 称取5 g冰川前缘土壤加入至250 mL 的锥形瓶中,加入灭菌的液体RCVBN培养基至瓶口,使用无菌的液体石蜡封口隔绝空气,放入25 ℃的光照强度为3000~5000 lx的培养箱中静置培养。观察瓶中培养基是否出现明显的红色,粉红色或黄色。待培养基变色后重复2~3次转接,直到瓶中光合细菌占明显优势后,进行下一步平板分离和纯化。
1.2.2 光合细菌的分离与纯化 采用双层琼脂平板法,按照10倍逐级稀释富集液,将10-5,10-6两个梯度的稀释液用移液枪吸取100 μl于固体RCVBN平板上,用涂布棒均匀涂布,室温放置30 min,待菌液被培养基吸收完毕后,平铺一层无菌液体琼脂封闭,其凝固后,将平板置于30 ℃光照强度为3000~5000 lx的培养箱中培养。待平板中长出紫色菌落后,挑取不同生长速度的单菌落进行纯化。
1.2.3 分离纯化菌株生长形态观察 在纯化培养基上对已纯化的光合细菌菌株进行菌落形态观察,革兰氏染色和显微镜观察。
1.2.4 活细胞吸收光谱测定 取培养7 d的菌液5 mL加入到离心管中,8000 r/min离心10 min,弃上清,加入无菌生理盐水反复洗涤2次并离心,弃上清,加入60 %蔗糖溶液充分溶解后定容至10 mL,以60 %蔗糖溶液为空白对照,在波长300~900 nm范围内测定吸光值,绘制吸光度曲线。
1.2.5 生长性能测定 为研究其生长规律,测定光合细菌的生长曲线。取容量为2.5 L的透明塑料袋,置于超净工作台下开紫外杀菌3 h,加入2 L灭菌后的液体培养基,随后挑取纯化后的单菌落加入液体培养基中,混匀。将透明塑料袋中的空气排空后封口。培养方法同1.2.2,每24 h超净工作台中吸取菌液10 mL使用紫外分光光度计测量吸光度值。
1.2.6 最适生长pH测定 将纯化后单菌落的菌液分别取1 mL加入到液体培养基中,调节pH梯度分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0进行培养。每隔24 h取样测量OD600nm值,共培养7 d。
1.2.7 分子生物学鉴定 结合16S rDNA基因序列比对分析进行鉴定。上游引物27F: 5’-AGAGTTT GATCCTGGCTCAG-3’,下游引物1492R: 5’-GGT-TACCTTGTTACGACTT-3’。扩增体系(50 μl): 上下游引物各1 μl, 模板DNA 3 μl,Mix 25 μl,Taq酶20 μl。扩增条件: 预变性95 ℃ 2 min;35个循环包括变性95 ℃ 20 s,引物退火 58 ℃ 20 s,引物延伸 72 ℃ 1 min;最后延伸72 ℃ 10 min。PCR扩增产物经1.2 %琼脂糖凝胶电泳检测后,交由昆泰锐生物科技有限公司进行测序。测序结果在NCBI(https://blast.ncbi.nlm.nih.gov/)GenBank数据库中进行同源性比对,并下载序列相似性最高菌株。利用MEGA软件[8]对光合细菌16S rDNA序列同源性相近的其他光合细菌进行系统发育分析并构建系统发育树。
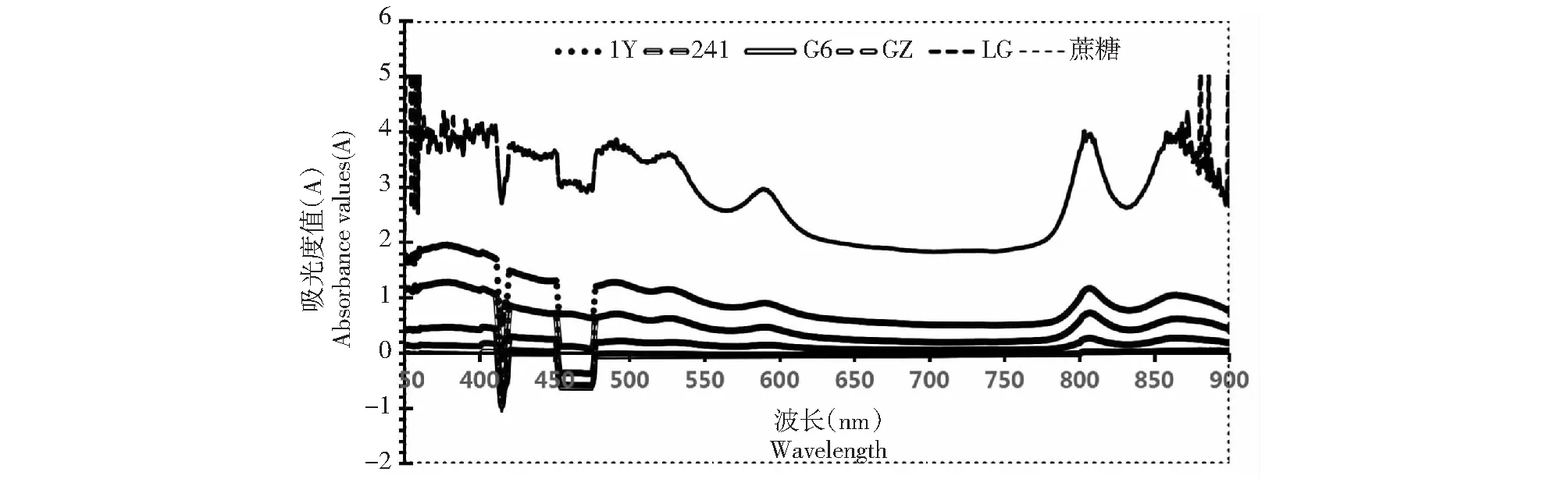
图1 5株光合细菌的活菌吸收光谱Fig.1 Absorption spectrum of five photosynthetic bacteria
1.2.8 光合细菌氮转化能力比较 氨转化能力的比较:为排除有机氮降解产生的氨氮对硝化速率的影响,硝化速率测定在RCVBN液体培养基中去除酵母浸粉。连续监测15 d,每天同一时间取样检测氨氮[6,9],亚硝氮[7,10],硝态氮含量[11]。反硝化能力(硝态氮转化能力)比较,为了消除培养基中有机氮对研究的影响,反硝化能力测定同样在RCVBN液体培养基中去除酵母浸粉,并且培养基中的1 g/L硫酸氨换成1 g/L硝酸钾。
接种:取生长指数期光合细菌,12 000 r/min离心10 min,弃去上清使用0.9 %生理盐水悬浮菌体,共清洗3次,然后将20 g菌泥接种于2 L培养基中(1 %,W/V),摇匀,放入25 ℃的光照强度为3000~5000 lx的培养箱中静置培养。
2 结果与分析
2.1 光合细菌的分离与鉴定
2.1.1 细胞形态观察 在RCVBN琼脂平板上共分离得到5株紫色菌株,分别命名为1Y、241、LG、G6和GZ。革兰氏染色结果显示5株菌都为革兰氏阴性杆状菌。
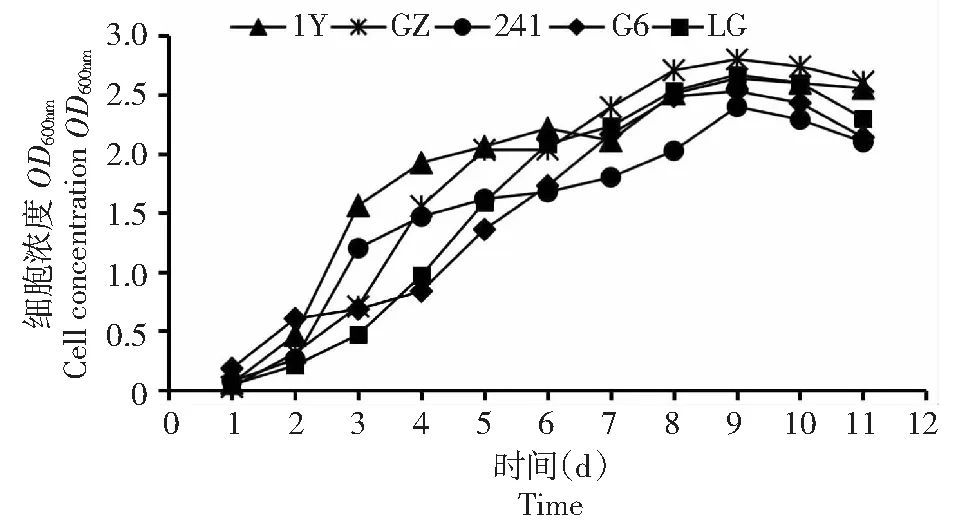
图2 5株光合细菌生长曲线Fig.2 Growth curve of five photosynthetic bacteria
2.1.2 活细胞吸收光谱测定 将5株菌的菌液在波长300~900 nm范围内测定其吸光度值(图1)。与蔗糖对照相比5株菌在波长300~900 nm范围内有4个特征峰,分别位于480、510、590和810 nm处。
2.1.3 生长速率比较 由图2显示,5株菌的生长速率比较,它们的生长趋势基本一致,接种后2 d内为生长迟滞期。3~7 d为生长指数期,8~10 d内为生长稳定期,第10天开始衰退。菌株GZ和LG的生长速度略高于其余3株菌。
2.1.4 最适生长pH测定 绝大多数光合细菌最适生长pH为7.0,pH低于5.5明显不生长,超过8.5生长明显被抑制。如图3所示,菌株1Y、LG和GZ在pH7.0左右菌体浓度最高。菌株241在pH为6.0左右菌体浓度最高。菌株G6在pH 8.5左右菌体浓度最高。
2.2 分子生物学鉴定及系统发育分析
由图4显示, 5株菌中1Y、241、G6和GZ与类球红杆菌(Rhodobactersphaeroides)基因登录号NR029215相似性为99.3 %。菌株LG与沼泽红假单胞菌(Rhodopseudomonaspalustris,基因登录号NR115542)相似性为100 %。

图3 pH对5种菌株的生长影响Fig.3 Effect of pH on growth of five strains
2.3 光合细菌的氮转化能力比较
2.3.1 氨氮转化能力比较 将5株菌培养在去除酵母浸粉的RCVBN液体培养基中,连续监测15 d。氨氮降解动态变化结果如图5所示,其中转化能力最高的是菌株LG,转化率为65.7 %,其次是菌株GZ,转化率为56.22 %。菌株G6的转化率为55.9 %,菌株1Y的转化率为53.99 %,最少的是菌株241,转化率为53.93 %。从图5A中可看出,前7 d菌株LG的转化速率最快为46.78 %,其次是菌株1Y转化速率为40.13 %,菌株GZ为34.6 %,菌株G6为13.14 %,菌株241的转化速率最慢,为3.58 %。
5株菌降解氨氮生成亚硝酸盐动态变化如图5B所示。从第3 天开始,菌株1Y,241,LG亚硝酸根的转化量有所增加,但在第7天菌株1Y,GZ转化的亚硝酸盐量高达1.2和2.5 mg/L占整个降解的氨氮的0.14 %~0.2 %。硝酸盐生成量监测结果如图5C所示,硝酸盐生成高峰在培养第8~12天,生成量最高为0.4~0.5 mg/L。另外,在整个培养期间,并未检测到有气体生成。
2.3.2 反硝化能力比较 从图6可以看出,对5株菌的反硝化转化能力进行检测,在以硝酸盐为唯一氮源情况下(RCVBN培养基不添加酵母粉),连续取样15 d分别检测硝酸根的转化和亚硝酸根的生成。从图6A可以看出,菌株G6对硝酸根的转化能力最强,转化率为95.79 %。菌株LG对硝酸根的转化能力次之,转化率为95.58 %。菌株1Y对硝酸根的转化率为94.99 %。菌株GZ对硝酸根的转化率为87.73 %。菌株241对硝酸根的转化能力最弱,为69.96 %。亚硝酸盐的生成如图6B所示,从培养时间第7天开始,第8~9天亚硝酸盐的积累达到顶峰。其中,菌株GZ的生成量最高,为11.19 mg/L。其次是菌株G6为10.77 mg/L,菌株241的生成量最低为4.10 mg/L。
3 小结与讨论
本实验通过双层琼脂平板法分离纯化出5株纯菌株,经革兰氏染色与活细胞吸收光谱测定,5株菌都为革兰氏阴性菌,并且在480 和510 nm处有吸收峰,说明活菌中含有类胡萝卜素[12];在590 nm处有吸收峰,说明活菌中含有细菌叶绿素a;光合细菌的吸收光谱主要受类胡萝卜素和细菌叶绿素a的影响。在790~1030 nm之间的810 nm处有吸收峰,综合这几处吸收峰结果与文献报道的紫色非硫光合细菌的吸收峰完全一致[12]。进一步的基于16S rRNA基因测序的分子生物学鉴定,NCBI数据库上其他同源性序列的进化树分析,进一步的确定了这五株菌为紫色非硫光合细菌,并且1Y、G6、241和GZ为类球红杆菌,LG为沼泽红假单胞菌。最适pH检测结果显示大部分菌株在pH 7.0的培养环境下菌浓度最高,说明光合细菌喜好中性偏碱的生长环境,这一结果也与其所处的冰川前缘新暴露出的土壤普遍偏弱碱性(pH>7.5)有关[2,4]。
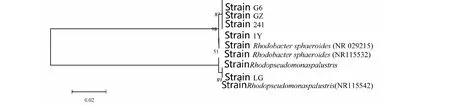
图4 光合细菌系统发育分析Fig.4 Phylogenetic analysis of the photosynthetic bacteria

A:氨氮降解;B:亚硝酸盐;C:硝酸盐生成动态变化图5 株光合细菌对氨氮的降解Fig.5 Dynamic changes of ammonia nitrogen degradation, nitrite and nitrate production by the five strains
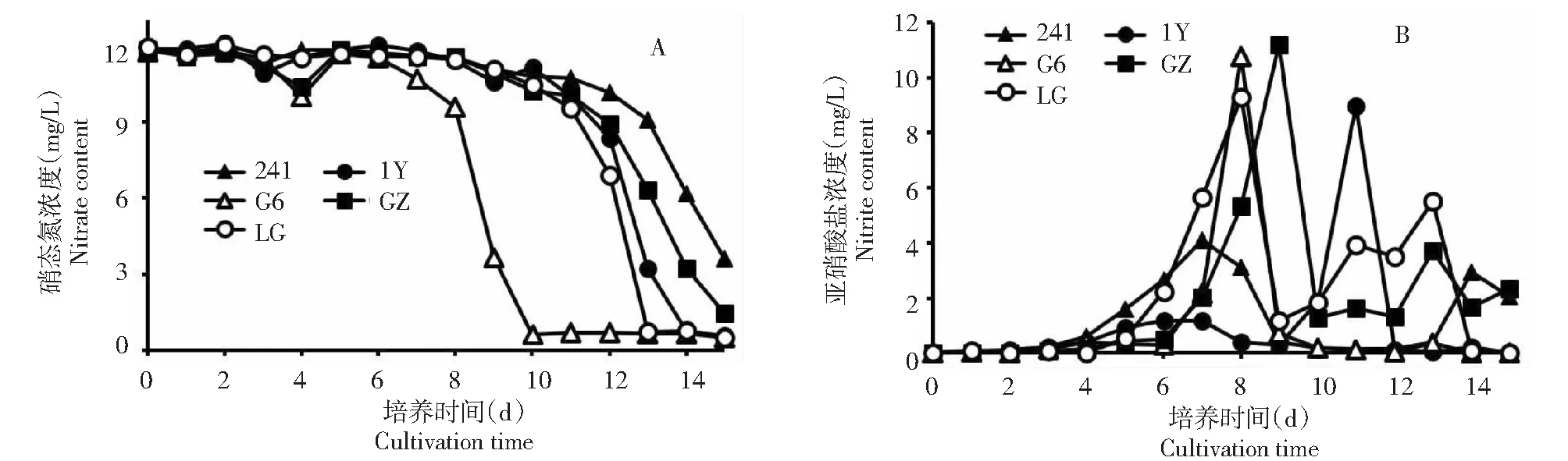
A:亚硝酸盐的生成;B:亚硝酸盐生成动态变化图6 5株菌对硝酸根的转化Fig.6 Dynamic changes of denitrification
这5株菌对氨态氮转化结果可知,在以(NH4)2SO4为唯一氮源情况下,其能够将绝大多数的氨用于菌体生长,繁殖,仅有少部分氨被转化为亚硝酸盐和硝酸盐。本实验室前期研究结果发现,这类光合细菌在冰川0年土壤固氮微生物中相对丰度占10 %左右[4],因此推测其可能对推动冰川前缘早期土壤发育具有重要作用。这5株菌的反硝化能力测定结果显示,其能够在以硝酸盐为唯一氮源的RCVBN培养基上生长,并且随着硝酸盐的被利用,亚硝酸盐的量呈现上升趋势,并且在短暂的时间内降低,这可能与沼泽红假单胞菌和类球红杆菌被报道具亚硝酸盐还原酶基因(nirK)有关[13-15]。本研究培养期间也发现密闭培养容器内有大量气体生成,经定性检测气体主要是以N2为主,N2O,NH3,CO2。此外,菌体量也有所增加,但增加幅度不高,表明光合细菌虽然可以利用硝态氮,但利用硝态氮转化为菌体蛋白率较低,硝态氮主要是通过反硝化作用生成氮气,氧化亚氮,氨气等方式损失,但其对氮损失过程中的贡献量,需要进一步的研究。
本研究从新疆天山1号冰川前缘土壤中分离到的紫色非硫光合细菌纯菌株,据其特殊的低温生长环境可推测,而本研究所分离得到的菌株可能属于低温菌;并且对其氨氮和硝态氮转化活性进行了研究,揭示了其对氨氮的高固定率和硝态氮的反硝化过程,为揭示冰川前缘土壤发育过程中氮素循环具有重要参考价值,并且这一研究结果在国内外目前尚属首次。此外,由于紫色非硫光合细菌已被广泛的应用于诸如高化学需氧量(COD),氨氮的有机废水处理和资源化等方面研究,因此其可以作为低温污染物修复提供高效菌种的依据。
