载芦荟大黄素新型纳米微球体外抗胰腺癌细胞的实验研究
2019-04-25麻忠武俞海波邱笑琼宋洪亮金肖丹贺亚东
麻忠武 俞海波 邱笑琼 宋洪亮 金肖丹 贺亚东

[摘要] 目的 探讨新型的靶向性表皮生长因子受体(EGFR)壳聚糖芦荟大黄素纳米微球对人胰腺癌细胞SW1990细胞生长的抑制作用及其对细胞增殖周期和凋亡的影响。 方法 采用四甲基偶氮唑蓝法(MTT)观察抗EGFR芦荟大黄素包埋的壳聚糖纳米微球在不同作用时间内对在体外培养的SW1990细胞增殖的影响,同时应用流式细胞术检测细胞增殖周期及凋亡率的变化。 结果 芦荟大黄素能对胰腺癌细胞SW1990的增殖起到抑制作用(P<0.05),抗EGFR芦荟大黄素包埋的壳聚糖纳米微球可明显增强芦荟大黄素对人胰腺癌细胞SW1990生长的抑制作用(P<0.05),使细胞凋亡率升高达(40.56±1.24)%(P<0.05),在G0/G1期阻滞细胞增殖(P<0.05)。 结论 抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对胰腺癌SW1990细胞增殖的抑制作用显著,可能为将来中药对胰腺癌的靶向性治疗提供新的研究方向。
[关键词] 芦荟大黄素;胰腺癌细胞SW1990;凋亡;壳聚糖
[中图分类号] R735.9 [文献标识码] A [文章编号] 1673-9701(2019)07-0015-04
[Abstract] Objective To investigate the inhibitory effect of novel targeted epidermal growth factor receptor(EGFR) chitosan aloe-emodin nanospheres on the growth of human pancreatic cancer cell line SW1990 and its effect on cell proliferation cycle and apoptosis. Methods The effect of anti-EGFR aloe-emodin-encapsulated chitosan nanospheres on the proliferation of SW1990 cells cultured in vitro was observed by MTT assay. Flow cytometry was also applied to detect changes in cell proliferation cycle and apoptosis rate. Results Aloe-emodin could inhibit the proliferation of pancreatic cancer cell line SW1990(P<0.05). Anti-EGFR aloe-emodin-encapsulated chitosan nanospheres could significantly enhance the growth inhibition effect of aloe-emodin on human pancreatic cancer cell line SW1990 (P<0.05), which increased the apoptosis rate to(40.56±1.24)%(P<0.05), and could made cell proliferation arrested in G0/G1 phase(P<0.05). Conclusion The anti-EGFR aloe-emodin-encapsulated chitosan nanospheres have significant inhibitory effects on the proliferation of pancreatic cancer SW1990 cells, which may provide a new research direction for the traditional Chinese medicine targeted treatment of pancreatic cancer in the future.
[Key words] Aloe-emodin;Pancreatic cancer cell SW1990;Apoptosis;Chitosan
胰腺癌惡性程度高,预后极差,5年点生存率约为5%[1]。治疗胰腺癌的首选方法是根治性手术切除,但可切除率低于20%。胰腺癌患者主要的治疗措施是化疗,但目前胰腺癌的化疗药物缺乏靶向性和特异性,治疗肿瘤效果不佳。因此研制新型胰腺癌化疗药物在药物研究领域受到学者的广泛关注,尤其传统中药的抗肿瘤作用更是当前药物基础研究的热点项目。本实验通过研制新型的靶向性表皮生长因子受体(epidermal growth factor receptor,EGFR)壳聚糖芦荟大黄素纳米药物,探讨其体外对胰腺癌SW1990细胞生长的抑制作用及其对细胞增殖周期和凋亡的影响,为其他中药治疗胰腺癌提供新思路和途径。
1 材料与方法
1.1试剂与仪器
(1)主要试剂:芦荟大黄素(Delta天然有机化合物信息中心)、载芦荟大黄素新型纳米微球由温州市医药科学研究所协作采用以壳聚糖为基质,通过膜透析技术,制备壳聚糖负载芦荟大黄素纳米微球,详细微球制作方法参考Hyung PJ等[2]研究,包括芦荟大黄素包埋的壳聚糖纳米微球(GC-DDP)、抗EGFR芦荟大黄素包埋的壳聚糖纳米微球(AbC-GC-DDP)(冷冻干燥保存的GC-DDP纳米粒,溶于蒸馏水中,将抗EGFR抗体与抗壳聚糖抗体结合制成)、空白壳聚糖纳米微球(GC)。甲基噻唑(MTT)购于美国Sigma公司的二甲基亚砜(DMSO)、N-羟基琥珀酰亚胺乙二醇壳聚糖购于杭州四季青生物工程公司的胎牛血清(PBS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺购于Santa Cruz公司的抗壳聚糖抗体与购于美国Hyelone公司的抗EGFR抗体购于美国Hyclone公司的RPMI1640细胞培养基。(2)实验设备:自动温控细胞培养箱(Thermo Scientific Form),酶标仪、酶联免疫检测仪(美国Bio-tek公司),细胞计数板(上海医用仪器厂),FACSC alibur流式细胞仪(美国BD公司)。试验开展于2017年3月~2018年2月。
1.2 实验细胞
所需细胞系为购自中国科学院上海细胞生物研究所细胞库的人胰腺癌细胞系SWl990,培养于RPMI-1640完全培养液中,置于相对湿度为95%、恒温37℃、含5%CO2的环境中单层生长,取对数生长期细胞用于实验。
1.3 实验方法
①MTT实验 分组:A组:抗EGFR芦荟大黄素包埋的壳聚糖纳米微球(AbC-GC-DDP)组;B组:芦荟大黄素包埋的壳聚糖纳米微球(GC-DDP)组;C组:芦荟大黄素组(aloe-emodin,AE);D组:空白壳聚糖纳米微球(GC)组;E组:无药对照组(只加RPMI-1640培养液);A、B、C组芦荟大黄素浓度一致为60 μmol/L[3,4],以RPMI-1640培养液配置。取对数生长期的SW1990细胞消化、计数,以5×103/孔的密度接种到96孔培养孔中,继续培养24 h,细胞贴壁后给药。给药后继续培养24 h、48 h、72 h,每孔加入20 μL的MTT(5 mg/mL)溶液,继续在培养箱内进行孵育6 h,培养完成后去除孔内培养液,每孔加入二甲基亚砜,轻轻震荡,溶解后用酶标仪测OD值。细胞抑制率(IR)=(1-给药组OD值/无药组OD值)×100%。②细胞周期测定 采用流式细胞术分析[5],即分别收集经A、B、C、D、E组处理24 h后的SW1990细胞,先用胎牛血清洗涤2次,再加入70%乙醇(-20℃预冷的),在4℃恒温固定过夜;去除乙醇液,再次用胎牛血清洗涤1次,加入RNase 50 μg/mL,在37℃恒温水浴30 min;加染色剂碘化乙啶(PI),在避光条件下染色30 min,最后用流式细胞仪检测细胞周期变化。
1.4 统计学方法
采用SPSS 17.0统计软件进行统计学分析。计量资料用均数±标准差(x±s)表示,对组间差异采用方差分析;若数据不符合正态性或者方差齐性,则采用秩和检验,P<0.05为差异有统计学意义。
2 结果
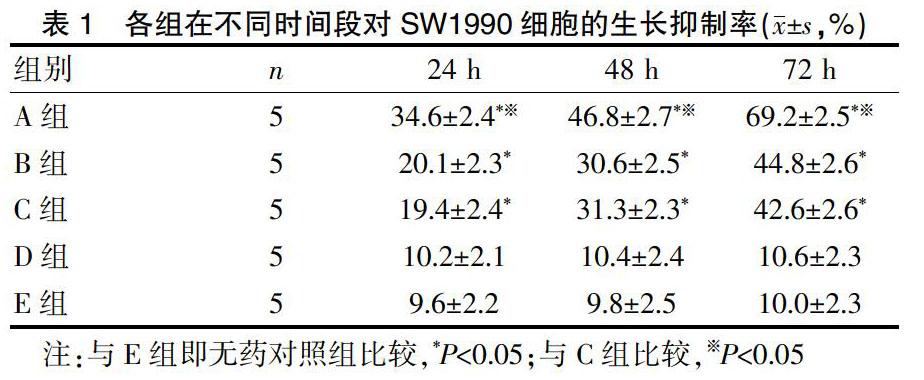
2.1 抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对胰腺癌细胞SW1990生长的影响
芦荟大黄素对胰腺癌细胞SW1990的增殖有一定的抑制作用,芦荟大黄素包埋的壳聚糖纳米微球在对胰腺癌细胞SW1990的抑制率上与芦荟大黄素无统计学差异(P>0.05),但抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对胰腺癌SW1990的抑制率明显上升,差异有统计学意义(P<0.05),且随着时间的推移,对SW1990细胞株的抑制率呈明显上升趋势,该抑制作用有一定的时间延续性,药物具有明显的缓释作用。见封三图1、表1。
2.2 抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对胰腺癌细胞SW1990的凋亡的影响
各组干预SW1990细胞株24 h后细胞出现凋亡现象,A组细胞凋亡率最高,B、C组细胞凋亡率相当,D、E组中仅有极少量的凋亡细胞存在。见表2。
2.3 抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对胰腺癌细胞SW1990增殖周期的影响
给予芦荟大黄素干预后,本研究观察到胰腺癌SW 1990细胞周期各时相的细胞数占比与对照发生了明显的改变,其中G0/G1期肿瘤细胞比例显著增加,S期肿瘤细胞比例减少,尤其是A组在胰腺癌SW1990细胞在G0/G1期的肿瘤细胞比例最高,与对照组相比具有显著差异(P<0.01),见封三图2。
3 讨论
芦荟大黄素(aloe emodin,AE)存在于芦荟、决明子及大黄等中草药中,属于蒽醌类物质,因其含有蒽醌环和两个酚羟基,决定其具有抑制肿瘤及清除氧自由基等多种生物活性。因此近年来,作为一种传统中药中重要的抗肿瘤成分,芦荟大黄素被国内外研究人员密切关注。研究表明,芦荟大黄素对多种癌症具有抑制肿瘤活性作用。如利用芦荟大黄素的光动力活性,芦荟大黄素可通过重构PKC-delta介导的细胞骨架来杀死人肺癌细胞[6],也可提高肺癌细胞对anoikis 再敏感性[7]。芦荟大黄素可抑制人口腔癌KB细胞的生长[8]。芦荟大黄素能够抑制具有高转移能力的乳腺癌细胞MDA-MB-231的侵袭转移[9]。对于子宫颈癌,芦荟大黄素也具有一定的作用,如芦荟大黄素可使得人子宫颈癌细胞停滞于G2/M期,增强子宫颈癌细胞的分化[10]。
纳米技术作为一种新兴技术,纳米药物即是以纳米技术研制的药物,其表面通过生物或者理化修饰后可使药物具有靶向性作用,即称为靶向纳米药物[11]。壳聚糖是一种可生物天然分解的高分子聚合物阳离子材料,近年来在临床医学、药学领域及生物医学领域广泛应用。壳聚糖在靶向基因药物研发、药物控制性释放等方面广泛应用,是目前医药研发领域的热点之一[12,13]。EGFR在胰腺癌中的表达率可达60%左右[14]。已有研究证实EGFR可作为胰腺癌治疗的理想靶点之一,通过将抗EGFR抗体与EGFR蛋白进行特异性结合,可以提高吉西他滨纳米粒抗胰腺癌细胞的靶向性与有效性[15]。壳聚糖负载芦荟大黄素纳米微球的制备是通过膜透性技术,在不影响芦荟大黄素的抗肿瘤活性的基础上,使其与壳聚糖基质结合,然后将抗壳聚糖抗体与抗EGFR抗体做成抗体联合体,利用抗原抗体特异性结合的特点,将壳聚糖负载芦荟大黄素纳米微球输送至胰腺癌细胞,使其具有一定的靶向性。因此,本研究所用抗EGFR芦荟大黄素包埋的壳聚糖纳米微球即由该法制备,并开展其对人胰腺癌细胞株SW1990的体外抑制效应的研究。
本文在离体实验中,采用MTT法观测了抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对人胰腺癌细胞株SW1990的体外增殖抑制效果,结果显示:芦荟大黄素对胰腺癌细胞SW1990具有一定的抑制增殖的生物活性,且抗EGFR芦荟大黄素包埋的壳聚糖纳米微球对胰腺癌细胞SW1990的增殖抑制活性明显增强,且随着时间的推移,对SW1990细胞株的抑制率呈明显上升趋势,有一定的时间延续性,药物具有明显的缓释作用。本研究发现芦荟大黄素具有诱导胰腺癌细胞凋亡的作用,从而实现对其细胞增殖的生物抑制作用。细胞凋亡又称程序性细胞死亡,诱导肿瘤细胞凋亡是多数化疗药物的共同作用机制。研究表明芦荟大黄素可促使线粒体膜电位丧失,阻滞细胞周期、诱导U87胶质细胞凋亡[16]。芦荟大黄素可以通过上调促凋亡蛋白和下调抗凋亡蛋白,诱导乳腺癌MDA-MB-231细胞凋亡,阻滞其细胞周停滞在G1期[17]。实验中发现,经含芦荟大黄素的各组处理后,细胞中出现大量凋亡小体,且经抗EGFR芦荟大黄素包埋的壳聚糖纳米微球处理的SW1990细胞株中凋亡小体比例最高,凋亡率明显上升,差异有统计学意义(P<0.05)。可能的原因是AE诱导细胞线粒体结构改变,通过增加细胞膜通透性同时降低细胞膜电位,激活Caspase及促凋亡因子的活性,促使细胞色素C释放入细胞质诱发细胞凋亡。亦有AE通过降低Akt/mTOR信号通路表达并降低其磷酸化水平,而达到促使肿瘤细胞自噬、凋亡的可能[18]。当然具体的诱导凋亡机制或者自噬机制,需要进一步的实验研究去阐明。大量研究表明,AE对肿瘤细胞的分裂周期产生干扰,可在不同细胞周期起到阻滞作用,从而抑制肿瘤细胞的增殖,起到抗癌作用。Lin ML等[20]通过流式细胞术发现肝癌细胞Hep3B在AE的作用下S期细胞占比明显升高,AE可降低细胞周期蛋白A(Cyclin A)和细胞周期蛋白依赖性激酶2(Cyclin-dependent kinase 2,CDK2)的表达水平,破坏编码CARP(Caspase associated RING protein)的mRNA稳定性,从而线粒体死亡途径激活,阻滞细胞于S期。Suboj P等[21]研究发现AE能通过降低细胞周期蛋白B1(Cyclin B1)和细胞周期依赖性蛋白激酶1(Cyclin-dependent kinase 1,CDK1)的表达水平,将结肠癌细胞阻滞于G2/M期。通过流式细胞技术试验,本研究发现将细胞阻滞在G0/G1期,是芦荟大黄素抑制胰腺癌细胞增殖的关键环节。G0/G1期为细胞分裂后期,其中G1期作为细胞周期的关键阶段,其主要是为DNA复制及蛋白合成做准备工作,只要正调节蛋白在G1期内合成量累积到一定水平,細胞就可以脱离对于细胞外生长因子的依赖,而自主顺利完成整个细胞周期[19]。我们发现抗EGFR芦荟大黄素包埋的壳聚糖纳米微球能增强芦荟大黄素对胰腺癌细胞细胞周期的抑制作用且有一定的靶向性,诚然其作用机理尚待开展更深入的实验研究。
綜上所述,抗EGFR芦荟大黄素包埋的壳聚糖纳米微球在体外对胰腺癌细胞具有一定的靶向性和显著的抑制作用,是具有潜在发展前景的抗胰腺癌中药。为提高具有抗癌作用的中药对胰腺癌的靶向性,本实验提供了一个可行的思路及发展方向。对抗EGFR芦荟大黄素包埋的壳聚糖纳米微球抗肿瘤及靶向性的机制研究,仍需基础动物实验研究以进一步阐明。
[参考文献]
[1] Jemal A,sigel R,Wand E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96.
[2] Hyung PJ,Kwon S,Lee M,et al. Self-assembled nanoparticles based on glycol chitosan bearing hydr-ophobic moieties as carriers for doxorubicin:In vivo biodistribution and anti-tumor activity[J]. Biomaterials,2006,27(1):119-126.
[3] 南菁,秦云霞,刘晶,等. 芦荟大黄素对人胃癌细胞HGC-27增殖周期及凋亡的影响[J]. 现代肿瘤医学,2008,16(6):919-921.
[4] 杨宾,付强,王亚娟,等. 芦荟大黄素对人结肠癌细胞SW480增殖周期及凋亡的影响[J].山西中医,2008,24(6):48-50.
[5] Chen YC,Shen SC,Lee WR,et al.Emodin induces apoptosis in human promyeloleukemic HL-60 cells accompanied by activation of caspase 3 cascade but independent of reactive oxygen species production[J].Biochem Pharmacol,2002,64(12):1713-1724.
[6] Chang WT,You BJ,Yang WH,et al. Protein kinase C delta-mediated cytoskeleton remodeling is involved in aloe-emodin-induced photokilling of human lung cancer cells[J]. Anticancer Res, 2012,32(9):3707-3713.
[7] Lee HZ,Yang WH,Hour MJ,et al. Photodynamic activity of aloe-emodin induces resensitization of lung cancer cells to anoikis[J]. Eur J Pharmacol,2010,648(1-3):50-58.
[8] Xiao B,Guo J,Liu D,et al. Aloe-emodin induces in vitro G2/M arrest and alkaline phosphatase activation in human oral cancer KB cells[J]. Oral Oncol,2007,43(9):905-910.
[9] He ZH,Huang YQ,Weng SF,et al. Effect of Aloe-emodin on invasion and metastasis of high metastatic breast cancer MDA-MB-231 cells[J]. Zhong Yao Cai,2013,36(9):1481-1485.
[10] Guo JM,Xiao BX,Liu Q,et al. Anticancer effect of aloe-emodin on cervical cancer cells involves G2/M arrest and induction of differentiation[J]. Acta Pharmacol Sin,2007, 28(12):1991-1995.
[11] Liu Y,Miyoshi H,Nakamura M. Nanomedicine for drug delivery and imaging:A promising avenue for cancer therapy and diagnosis using targeted functional nanoparticles[J]. Int J Cancer,2007,120(12):2527-2537.
[12] 孙晋敏,夏正东,周士东,等.负载As_2O_3壳聚糖纳米粒的药代动力学及其毒性观察[J].中国组织工程研究,2011,15(12):2166-2170.
[13] Veiseh O,Kievit FM,Fang C,et al. Chlorotoxin bound magnetic nanovector tailored for cancer cell targeting,imaging,and siRNA delivery[J]. Biomaterials,2010,31(31):8032-8042.
[14] Jimeno A,Rubioviqueira B,mador ML,et a1.Dual mitogenactivated protein kinase and epidermal growth factor receptor inhibition in biliary and pancreatic cancer[J].Mol Cancer Ther,2007,6(3):1079-1088.
[15] 俞海波,陈海川,王哲近,等.靶向壳聚糖新型纳米药物体外抗胰腺癌细胞的实验研究[J].医学研究杂志,2017, 46(6):84-87.
[16] Ismail S,Haris K,Abdul Ghani AR,et al. Enhanced induction of cell cycle arrest and apoptosis via the mitochondrial membrane potential disruption in human U87 malignant glioma cells by aloe emodin[J]. J Asian Nat Prod Res,2013,15(9):1003-1012.
[17] 陶毅明,洪雪,馬义丽,等. 芦荟大黄素联用顺铂对乳腺癌MDA-MB-231细胞增殖和凋亡的影响[J]. 中国实验方剂学杂志,2015,21(20):127-130.
[18] 郑建军,蔡沣,刘开渊,等. 芦荟大黄素对大肠癌LOVO细胞自噬、凋亡及迁移的作用研究[J]. 中国医师进修杂志,2018,41(2):144-148.
[19] Wasserman L,Avigad S,Beery E,et a1.The effect of aloe-emodin on the proliferation of a new merkel carcinona cell line[J].Am J Dermatopathol,2002,24(1):17-22.
[20] Lin ML,LU YC,Su HL,et al. Destabilization of CARP mRNAs by aloe-emodin contributes to caspase-8-mediated p53-independent apoptosis of human carcinoma cells[J].J Cell Biochem,2011,112(4):1176-1191.
[21] Suboj P,Babykutyy S,Srinivas P,et al.Aloe-emodin induces G2/M cell cycle arrest and apoptosis via activation of caspase-6 in human colon cancer cells[J].Pharmacology,2012,89(1-2):91-98.
(收稿日期:2018-11-11)
