雌激素-ERα-36信号通路参与胃黏膜肠上皮化生的发生
2019-04-25桂华伟王绪明黄利华陈琼霞刘丽江
桂华伟,王绪明,黄利华,黄 萱,陈琼霞,刘丽江△
(1.湖北省武汉市第四医院病理科 430032;2.病理诊断所组织病理部,湖北武汉,430056)
胃癌是全球发病率位居第4位的恶性肿瘤,而在中国,其发病率常高居第2位[1-2]。胃癌早期发现率低,一经发现多为进展期。5年生存率低,病死率高,居恶性肿瘤的第2位[1-2]。慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是我国胃癌的主要癌前病变,其肠上皮化生(肠化)是CAG的重要病变之一。因此,肠化被认为是肠型胃癌的主要癌前病变[3],但其发生机制不详。
研究发现,男性与绝经期前女性胃癌发病率之比为2∶1,而女性绝经期后,这种差异逐渐消失。因此推测女性体内生理性较高浓度的雌激素可能阻碍或延缓了胃癌的发病[4-5]。来自大样本量、多地区的流行病学报道,CAG的男性患者肠化发生率远高于女性患者,而无幽门螺杆菌(Helicobacter pylori,H.pylori)感染的女性患者绝经后CAG的发病率逐渐升高且病变加重。肠型胃癌的病变中出现肠化的比例及严重程度,男性往往高于女性。使用抗雌激素药物他莫昔芬可降低伴有肠化的胃炎发生。动物实验发现,雌性动物体内生理性较高浓度雌激素可阻碍CAG实验动物模型中肠化的发生、发展[3,6-11]。因此,目前认为,肠化确实存在显著的性别差异[12]。
1 材料与方法
1.1材料 BALB/c小鼠购于华中科技大学同济医学院实验动物中心,雌性200只和雄性100只,6~8周龄,无特定病原体(SPF)级;N-甲基-N-硝基-N-亚硝基胍(MNNG)购自上海润成生物科技有限公司,ERα-36抗体由美国王兆一教授馈赠(克瑞屯大学,美国内布拉斯加州),GES-1细胞购自湘雅医学院实验中心,COX-2抗体(sc-19999)、内参β-actin抗体(sc-517582)购自Santa Cruz公司,相应的辣根酶标记山羊抗兔IgG(ZB-5301)、辣根酶标记山羊抗小鼠IgG(ZB-5305)及通用型免疫组织化学SP试剂盒(小鼠/兔链霉卵白素-生物素法检测系统,SP-9000)购自北京中杉金桥生物技术有限公司。用于Western blot检测的增强化学发光试剂ECL和BCA蛋白定量试剂盒为上海碧云天生物技术有限公司(上海,中国)产品。聚偏氟乙烯(PVDF)膜购自美国Millipore公司。
1.2方法
1.2.1BALB/c小鼠胃黏膜肠化动物模型构建 雌性小鼠200只,雄性小鼠100只,6~8周龄,体质量约20 g,选取100只雌性小鼠按文献介绍的实验方法去除双侧卵巢[13],1周后待伤口愈合进行正式实验,实验分为3组,雌性小鼠100只,去除卵巢雌性小鼠100只和雄性小鼠100只。每组各挑选10只作为对照组,仅给予普通食物和饮水,其余90只用于建立小鼠胃黏膜肠化动物模型。将MNNG溶解于超纯水中做成储存液(储存浓度为1 g/L)。使用前将储存液用蒸馏水稀释至终浓度100 μg/L。除对照组小鼠外其余组小鼠从铝箔包裹饮水瓶中自由摄取MNNG溶液(唯一水源)。同时,给予不规律饮食(第1天足够的饲料后第2天禁食,交替进行)。在10周后,处死解剖全部小鼠,通过镜下观察胃黏膜组织学变化(显微镜下观察是否出现杯状细胞及出现比例)以验证是否成功建成小鼠胃黏膜肠化动物模型。所有动物实验都经江汉大学医学伦理学委员会批准。
1.2.2慢性胃炎人体组织标本中肠化发生率检测 收集分析江大病理诊断所和湖北省武汉市第四医院2010年1月至2016年12月所有慢性胃炎活检标本共计5 326例,其中男3 084例,女2 242例。所有标本收集后,用10%的中性甲醛固定后,常规石蜡包埋,切片、制片、苏木素-伊红(HE)染色后,经两个中级职称及以上的病理专科医生复片并对肠化程度分级(直径少于1/3腺体出现肠化为1级轻度,1/3~2/3腺体出现肠化为2级中度,>2/3腺体出现肠化为3级重度)。因为围绝经期(45~55岁)的雌激素变化情况比较复杂,所以去除围绝经期女性和相应年龄的男性患者,仅仅研究未绝经和完全绝经的女性患者。所有人体组织标本的获取都经江汉大学医学伦理学委员会批准且患者知情同意。
1.2.3免疫组织化学检测 免疫组织化学检测严格按照通用SP试剂盒说明书进行操作,石蜡包埋切片常规脱蜡至水,经过氧化氢(H2O2)孵育10 min去除内源性过氧化物酶活性,柠檬酸钠缓冲液进行抗原修复,然后10%胎牛血清室温封闭10 min,一抗37 ℃孵育2 h,二抗37 ℃孵育30 min,最终用DAB显色,苏木素复染,脱水、透明、封片。
1.2.4Western blot实验 收集慢性胃炎人体组织冰冻材料标本(伴有肠化和不伴肠化各15例),用液氮研磨方法收集蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后湿转至PVDF膜,含5%脱脂奶粉的TBST(含0.1% Tween-20的TBS)37 ℃封闭60 min,一抗ERα-36、CDX-2、β-actin抗体4 ℃孵育过夜。TBST漂洗3次,每次5 min,加入相应的辣根过氧化物酶标记的羊抗小鼠或羊抗兔IgG,37 ℃孵育60 min。TBST漂洗5 min×3次,ECL化学发光试剂检测。
1.2.5细胞转染和不同浓度雌激素联合MNNG对GES-1细胞中ERα-36和COX-2表达的影响 ERα-36表达质粒和siRNA干扰质粒由王兆一教授馈赠,本实验室保存。细胞转染按照LipoFiterTMLiposomal Transfection Reagent试剂盒说明书操作步骤进行转染。1×106个GES-1细胞被接种于10 cm直径的培养皿中过夜,24 h后换新鲜培养基。按照说明书要求,将4.6 μg的ERα-36表达质粒(过表达组)或siRNA干扰质粒(干扰组)分别混合于4.8 μL LipoFiterTMLiposomal Transfection Reagent转染试剂,分别转染细胞。转染6 h后换新的不含转染试剂的培养基,接着培养48 h后,用于实验。细胞分别用20 μmol/L的MNNG、0.1 nmol/L(生理性低浓度)的雌二醇(E2)、5 μmol/L(药理性高浓度)的E2、20 μmol/L的MNNG联合0.1 nmol/L的E2、20 μmol/L的MNNG联合5 μmol/L的E2处理24 h后,用Western blot方法检测ERα-36及COX-2的表达。
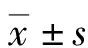
2 结 果
2.1BALB/c小鼠胃黏膜肠化动物模型构建 实验结果显示,建模10周时,雄性小鼠和去卵巢雌性小鼠中,肠化的发生率明显高于雌性小鼠,见表1。雄性对照组,去卵巢雌性小鼠对照组和雌性对照组小鼠均未出现肠化现象。

表1 小鼠胃黏膜肠化动物模型出现肠化的性别差异(n)
χ2、P值为肠化发生率比较所得;a:雌性小鼠vs.雄性小鼠;b:雌性小鼠vs.去卵巢雌性小鼠;c:雄性小鼠vs.去卵巢雌性小鼠
2.2不同性别肠化的发生率 人体慢性胃炎组织材料中,男性与女性相比,男性肠化的发生率和严重程度高于绝经期前的女性,但是与绝经以后的女性差异无统计学意义(P>0.05)。见表2。

表2 慢性胃炎人体组织出现肠化的性别差异及绝经影响
2.3人体组织标本免疫组织化学检测结果 收集来源于江大病理诊断所和湖北省武汉市第四医院的伴有重度肠化的慢性胃炎样本和不伴有肠化的慢性胃炎新鲜人体组织样本各20例,用免疫组织化学的方法检测胃黏膜腺体中ERα-36和COX-2的表达,ERα-36、COX-2阳性表达主要定位于胃黏膜细胞的细胞膜和细胞质。用Image-pro plus 6.0软件分析阳性表达区的平均光密度。结果显示,伴有肠化的慢性胃炎样本,ERα-36和COX-2的表达均明显高于不伴有肠化的慢性胃炎样本,差异均有统计学意义(P<0.05),见图1A~G。
2.4人体新鲜胃炎组织样本Western blot实验检测结果 收集来源于江大病理诊断所的人体新鲜胃炎组织样本,其中包括伴有重度肠化的慢性胃炎标本和不伴有肠化的慢性胃炎人体组织样本各15例。用液氮研磨加上RIPA裂解液按照说明书方法提取组织蛋白后,加入蛋白酶抑制剂后放入-80 ℃冰箱保存。伴有重度肠化的慢性胃炎样本中ERα-36和COX-2的表达均高于不伴有肠化的胃炎样本,其差异有统计学意义(均P<0.05),见图1H~I。
A:伴有肠化的慢性胃炎HE染色(×200);B:伴有肠化的慢性胃炎高表达ERα-36(×200);C:伴有肠化的慢性胃炎高表达COX-2(×200);D:不伴有肠化的慢性胃炎HE染色(×200);E:不伴有肠化的慢性胃炎低表达ERα-36(×200);F:不伴有肠化的慢性胃炎低表达COX-2(×200);G:选取伴有肠化的慢性胃炎和不伴有肠化的慢性胃炎各100例,用免疫组织化学方法分别检测ERα-36和COX-2表达,用Image-pro plus6.0软件分析平均光密度;H:Western blot方法检测伴有肠化的慢性胃炎(case 1~case 4)和不伴有肠化的慢性胃炎(case 5~case 8)中ERα-36和COX-2表达;I:伴有和不伴有肠化的慢性胃炎新鲜组织标本各15例,用Western blot方法分别检测ERα-36和COX-2表达,用Image-pro plus6.0软件分析平均光密度
图1 伴有和不伴有肠化的慢性胃炎标本中ERα-36和COX-2表达
2.5不同浓度E2对ERα-36和COX-2表达的影响 实验结果显示,单独使用MNNG处理不能诱导ERα-36和COX-2的表达,生理性低浓度E2不能单独诱导COX-2的表达,可以促进ERα-36的表达,药理性高浓度E2不能单独诱导COX-2的表达,可以抑制ERα-36的表达。生理性低浓度E2和MNNG联合处理后ERα-36表达增高,且COX-2的表达也增高;药理性高浓度E2和MNNG联合处理后不能诱导COX-2高表达,见图2。
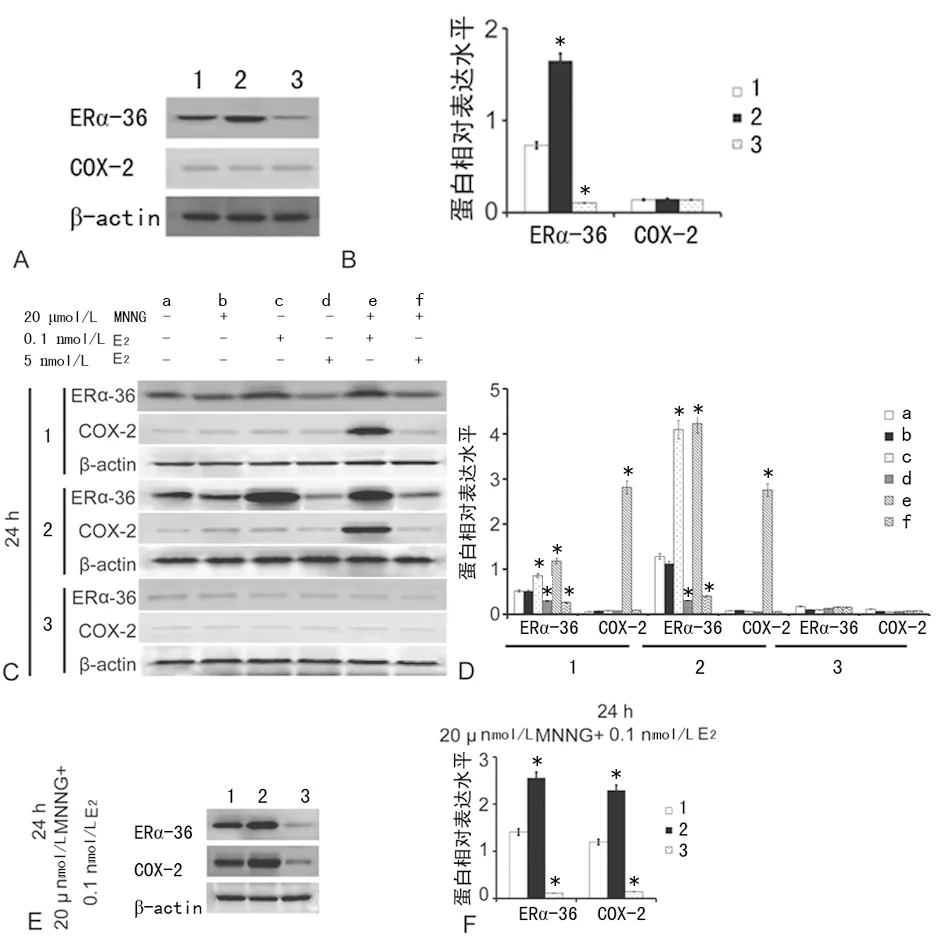
A、B:过表达和下调ERα-36表达的GES-1细胞株中ERα-36和COX-2表达(a:P<0.05,与GES-1组比较);C、D:单独或联合用MNNG、生理性低浓度E2(0.1 nmol/L)和药理性高浓度E2(5 μmol/L)处理正常胃黏膜细胞GES-1及其重组细胞株24 h后ERα-36和COX-2表达变化[a:P<0.05,与同种细胞同种蛋白的组中溶剂对照组(a)比较];E、F:联用MNNG和生理性低浓度E2处理GES-1和重组细胞株24 h后,ERα-36和COX-2表达变化[*:P<0.05,与同种细胞组中同种蛋白的溶剂对照组(a)比较];1:GES-1组;2:过表达组;3:干扰组
图2 不同浓度E2对ERα-36和COX-2表达的影响
3 讨 论
流行病学的调查数据提示,肠化的发生,可能与E2有关。E2可通过与E2受体(ER)结合而发挥多种生物学效应。研究显示体内的多种细胞/组织/器官(经典的E2依赖性器官,如乳腺、子宫、卵巢等;非E2依赖性器官,如胃、肝、肠、神经系统与心血管系统等)均能对E2产生信号应答[14-15]。E2信号在老年痴呆、骨质疏松症、冠状动脉粥样硬化性心脏病及某些恶性肿瘤(如乳腺癌、神经胶质母细胞瘤及胃癌等)的发生发展中发挥重要作用[14-20]。
E2介导的信号传导途径,近年来获得如下进展:(1)ER包括ERα和ERβ两个亚型;(2)ERα和ERβ可表达于细胞核和细胞膜;(3)E2介导的信号传导包括细胞核(经典途径)、细胞膜(非经典途径)和线粒体途径(mtDNA途径),因此E2参与执行的生物学功能(如细胞生长,分化与凋亡等)并非仅依赖于细胞核途径;(4)除传统相对分子质量为66×103的ERα-66(经典的ERα)外,新发现了相对分子质量为46×103的ERα-46和36×103的ERα-36两个新亚型。ERα-66主要介导E2的细胞核信号通路(经典通路),而ERα-46和ERα-36主要介导E2的细胞膜信号通路(非经典通路),其中ERα-46和ERα-66同源性极强,较难对其开展特异性的研究[5,19-20]。ERα-36的分子生物学特征为:(1)其蛋白中缺少AF1和AF2功能区,其转录启动子位于ERα-66基因的第一个内含子中;(2)其功能及表达不完全依赖于ERα-66,其作用机制类似于生长因子受体,可经细胞膜起始的E2信号传导发挥生物学功能;(3)可抑制ERα-66和ER-β介导的细胞核E2途径;(4)针对ERα-36的药物对乳腺癌细胞生长有抑制作用[5,20-21]。
MNNG是一种可以诱导CAG肠化、不典型增生,甚至胃癌的化学物。前期实验结果显示,MNNG在雄性大鼠更容易诱导出肠化的动物模型。本实验结果也证实了这个现象,提示MNNG诱导肠化的发生过程中有E2参与作用,机制不明。
COX是前列腺素类生物合成的限速酶,共有2个亚型,COX-1和COX-2,是一种膜结合蛋白质,近年研究较多,COX-2与胃黏膜肠化、不典型增生及癌变的发生有关[22-26]。编码COX-2的基因位于人类l号染色体q25.2~q25.3,全长约8.3 kb,蛋白全长227个氨基酸[22-26]。胃黏膜发生肠化时,COX-2表达增加[22-26]。
本实验的结果显示,低浓度E2与MNNG作用于胃黏膜细胞株,如果ERα-36低表达,那么COX-2的表达不增加,ERα-36增加,则COX-2的表达也增加,提示ERα-36也参与了肠化的过程。
综上所述,低浓度E2与MNNG通过ERα-36信号通路共同参与胃黏膜肠化过程。
