胃癌组织中AKT1与STMN1表达的关系及其临床意义
2019-04-24马子涵贾西云陈发帅彭方慧张自森
马子涵,贾西云,徐 倩,陈发帅,彭方慧,巴 楠,张自森
(1.郑州大学第五附属医院肿瘤内科,河南 郑州 450052;2.新乡医学院第一附属医院普通外科,河南 卫辉 453100)
胃癌是我国常见恶性肿瘤,发病率居第2位[1],是一种多基因参与的异质性疾病。蛋白激酶B(AKT)呈癌基因特性,本课题组前期研究[2-3]中发现,AKT参与了胃癌细胞增殖和化疗敏感性调节。微管不稳定蛋白STMN1也呈癌基因特性,其高表达可促进肿瘤细胞增殖和侵袭,与胃癌化疗耐药和不良预后相关[4]。AKT和STMN1在肿瘤细胞信号传导机制中密切相关,AKT1/STMN1信号通路的异常激活促进肿瘤细胞增殖与耐药[5-6],STMN1基因沉默也可通过AKT1信号通路抑制胃癌细胞的增殖、迁移和侵袭[7]。然而,AKT1和STMN1在胃癌发生中的关系及其临床意义并不明确。本文通过检测42例胃癌及其对应癌旁组织中AKT1与STMN1表达,分析两者之间的相关性及与临床病理学参数的关系,为进一步探讨两者在胃癌诊断和治疗中的应用价值提供参考。
1 资料与方法
1.1 一般资料选取2015年6月至2018年5月于郑州大学第五附属医院行胃癌根治术的42例胃癌患者的石蜡包埋胃癌组织及其对应癌旁组织标本,癌旁组织距离肿瘤组织边缘均>5 cm,所有患者均经组织病理学证实为腺癌,术前未进行放、化疗。42例患者中,男34例,女8例,年龄42~81岁,中位年龄65岁。本研究经郑州大学第五附属医院医学伦理委员会审查同意。
1.2 免疫组化染色方法组织标本经常规甲醛固定、脱水、石蜡包埋等处理,切片、脱蜡后用柠檬酸盐缓冲液进行抗原修复,以已知阳性标本作为阳性对照,用磷酸盐缓冲液代替一抗作为阴性对照,实验步骤按照S-P免疫组化试剂盒说明书进行,最后用罗氏全自动免疫组织化学染色仪检测AKT1和STMN1表达。其中AKT1(75692)抗体购自美国Cell Signaling Technology公司,STMN1(11157-1-AP)抗体购自武汉三鹰生物技术公司。
1.3 免疫组化染色判断标准AKT1以细胞核或细胞质内出现棕黄色颗粒为阳性表达,STMN1以细胞质内出现棕色至棕黄色颗粒为阳性表达。观察阳性细胞百分比及染色强度,计数阳性细胞百分比(阴性为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分),评判阳性细胞染色强度(无阳性染色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分)。最终结果以阳性细胞百分比及染色强度评分相乘进行评估,>6分为阳性表达,≤6分为阴性表达。
1.4 统计学处理采用SPSS 22.0进行统计分析,计数资料用百分数表示,组间比较用χ2检验或Fisher确切概率法,AKT1、STMN1相关性分析用Spearman等级相关分析,检验水准α=0.05。
2 结果
2.1 AKT1、STMN1在胃癌组织及其对应癌旁组织中的表达胃癌组织中AKT1阳性表达率61.90%(26/42),高于癌旁组织的23.81%(10/42),差异有统计学意义(P<0.05)。胃癌组织中STMN1阳性表达率35.71%(15/42),高于癌旁组织的7.14%(3/42),差异有统计学意义(P<0.05)。见表1、2。
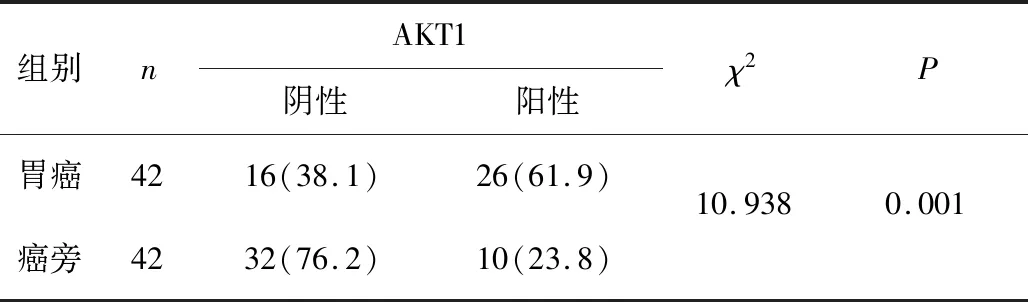
表1 AKT1在胃癌及其对应癌旁组织中的表达 n(%)

表2 STMN1在胃癌及其对应癌旁组织中的表达 n(%)
2.2 胃癌组织中AKT1、STMN1阳性表达与临床病理学参数的关系胃癌组织中AKT1阳性表达与TNM分期、T期有关(P均<0.05),而与性别、年龄、肿瘤部位、淋巴结转移无关(P均>0.05)。胃癌组织STMN1阳性表达与肿瘤部位有关(P<0.05),而与性别、年龄、TNM分期、T期及淋巴结转移无关(P均>0.05)。见表4。
2.3 胃癌组织中AKT1与STMN1表达的相关性胃癌组织中AKT1与STMN1的表达呈正相关(r=0.380,P<0.05)。见表3。
3 讨论
胃癌发病率高,早期诊断难度大,多数患者确诊时已是中晚期,丧失了根治机会。充分了解胃癌发生、发展的分子机制对实现胃癌的精准诊断、精准治疗及改善预后具有重要意义[8]。
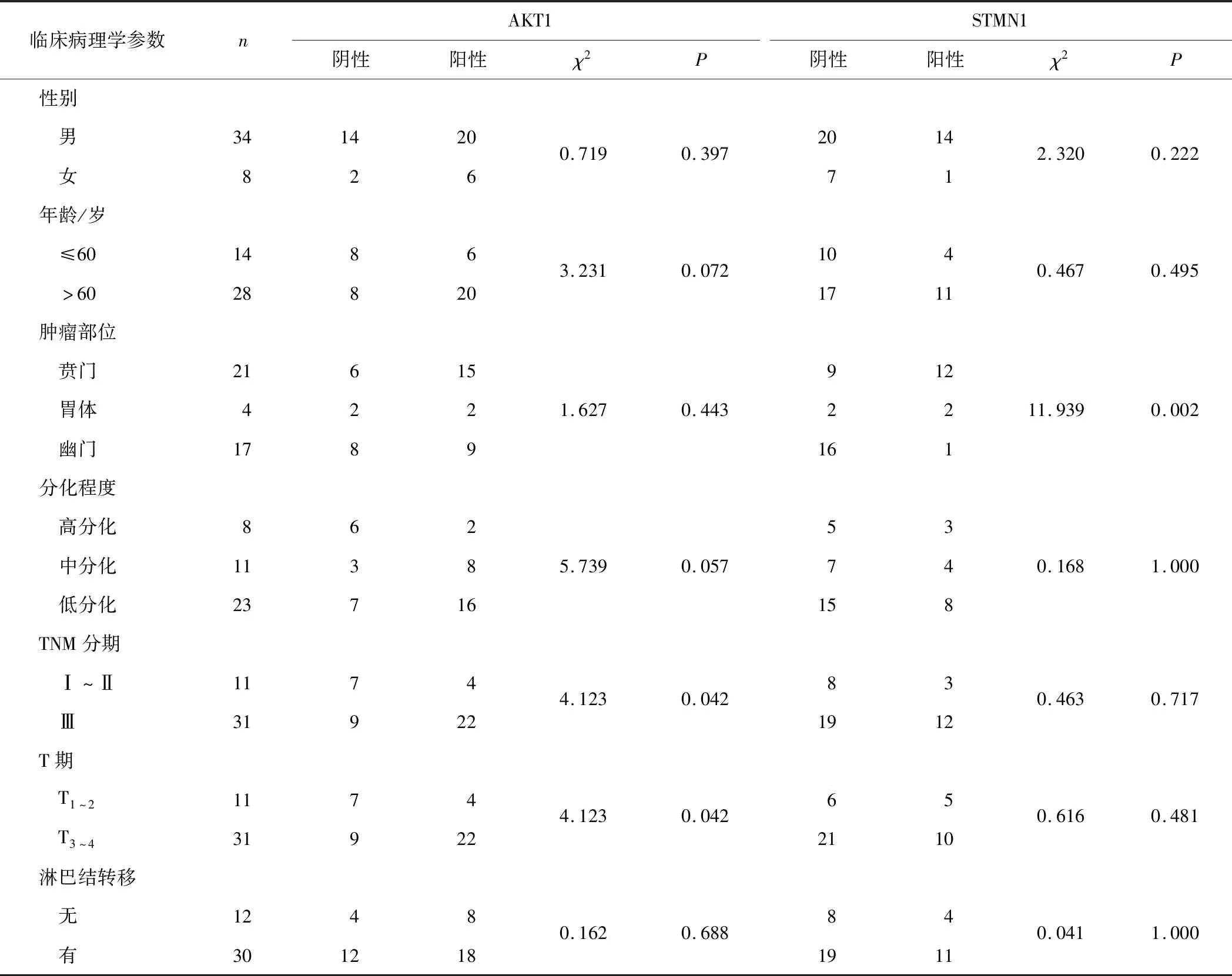
表3 胃癌组织中AKT1、STMN1阳性表达与临床病理学参数的关系

表4 AKT1和STMN1在胃癌组织中表达的相关性 n
AKT信号通路在调节肿瘤细胞生长、增殖、代谢等生物学功能中发挥重要作用,已成为备受关注的抗肿瘤治疗靶点[9]。我们前期的研究[2-3]也发现AKT信号通路参与了胃癌细胞增殖和药物敏感性调节。AKT有3个同源异构体,即AKT1、AKT2和AKT3,分别具有不同的生物学作用,而肿瘤细胞增殖和凋亡调节主要与AKT1有关[10-11]。抑制AKT1表达能逆转胃癌细胞的多药耐药[12]。本研究结果显示,胃癌组织中AKT1阳性表达率61.9%,显著高于癌旁组织,AKT1阳性表达与TNM分期及T分期有关,提示AKT1可能主要参与胃癌的发生、发展。
STMN1是一种微管不稳定蛋白,在有丝分裂的调控中起着重要作用,在多种肿瘤中存在高表达。STMN1高表达与多种恶性实体肿瘤密切相关,可促进肿瘤细胞恶性行为,不仅是一种肿瘤预后标志物,也是一个有价值的治疗靶点[13],并已尝试用于复发肿瘤的治疗[14]。STMN1高表达与胃癌的发生、发展、化疗耐药和不良预后相关,其高表达可促进胃癌细胞增殖[4,15]。本研究结果显示,胃癌组织中STMN1阳性表达率35.7%,显著高于癌旁组织;STMN1阳性表达仅与肿瘤部位有关,这提示STMN1与胃癌原发部位相关,可能有助于原发肿瘤起源部位确定;STMN1阳性表达与TNM分期、T分期、淋巴结转移等无关,这提示STMN1仅参与胃癌的发生,可能是一个早期分子事件。值得说明的是,本研究中STMN1阳性表达率低于文献[15]报道,这可能主要是所采用免疫组化阳性判断标准的不同所致,也可能存在病例的区域性和个体性差异影响。
有研究[16]显示,AKT1可能是一个区分胃癌和胃炎的生物标志物。STMN1在早期结肠癌中高表达,可能是区分结肠良恶性病变的鉴别诊断标志物[17]。本研究结果表明,胃癌组织中AKT1与STMN1呈高表达且存在正相关关系,提示两者共同参与胃癌的发生,在胃癌组织良恶性鉴别中两者联合使用可能具有辅助鉴别诊断价值。研究[5-7]发现,AKT1和STMN1在肿瘤细胞增殖调控中存在共同机制,STMN1可通过AKT1信号通路调节胃癌细胞的增殖、侵袭和转移,AKT1信号通路的激活也可调节STMN1促使肺癌细胞产生耐药,而两者的相互调控机制尚未阐明。进一步揭示胃癌中AKT1和STMN1之间相互作用的分子机制,可能为胃癌精准诊疗提供新的靶点。
综上所述,AKT1和STMN1蛋白在胃癌组织中高表达并呈正相关性,提示两者共同参与了胃癌的发生,联合检测对胃癌的诊断和鉴别诊断有一定辅助价值,其共同的分子机制还需要进一步研究。
