EFhd1蛋白在非小细胞肺癌组织中的表达及临床意义
2019-04-24许立芹吕梦源
许立芹 吕梦源 冯 健
肺癌是一种起源于支气管黏膜或腺体的恶性肿瘤,每年新发病例超过160万,每年有130万人死于该病,是目前世界范围内发病率及病死率均位居首位的肿瘤疾病,其诊疗已经成为人们关注的焦点[1-2]。肺癌根据其组织学特征,一般分为小细胞肺癌(small-cell lung cancer, SCLC)和非小细胞肺癌(non-small-cell lung cancer, NSCLC)两种类型,其中NSCLC约占80%~85%[3]。由于缺乏特征性的临床表现,确诊的患者约有80%已处于肺癌晚期,多已错过最佳的手术治疗时机,然而即便是早期发现并行手术切除肿瘤的患者,由于肿瘤的转移性质,症状可能很快复发[4]。肺癌的5年生存率只有16.8%左右[5]。如今靶向治疗在肺癌领域发展迅速,在对EGFR、ALK突变敏感的NSCLC中显示出高达70%的临床有效性,但后期耐药不可避免,中位耐药时间9~13个月,新一代酪氨酸激酶抑制剂(TKI)类药物仍同样面临再次突变耐药的问题[6-7]。肿瘤耐药是当今临床面临的重点问题,虽然已有新型靶向药物的研发、免疫疗法等治疗策略,但这一问题仍未得到妥善解决。因此,临床迫切需要不断探索新的治疗靶点,进一步提高患者生存质量,改善预后。
钙是人体内最重要的元素之一,广泛分布于人体各组织器官中,细胞内的许多生理反应以及细胞间的交流都是由细胞内的Ca2+信号引起的。这些过程包括转录、细胞周期调节、分化、细胞运动/迁移、程序性细胞死亡、肌肉收缩/松弛、神经传递、分泌、学习和记忆[8]。虽然只有一小部分离子钙(即1%)具有生理活性,但它在生物系统中起着最重要的作用,被认为是一种准通用信号分子[9]。基于对钙信号传导、钙稳态失衡的研究,目前认为这种普遍存在的二价阳离子以钙储存依赖性和钙通量依赖性两种途径参与了癌症的发生、促进和发展[10-11]。钙离子结合蛋白是一类包含200多个成员的蛋白超家族,该家族成员对钙离子高度敏感,与钙离子结合后,促使蛋白构象发生改变,从而能与多种蛋白质相互作用,产生一系列生物学效应。目前已证实钙离子结合蛋白与人类多种疾病的发生发展紧密相关,如心肌病、高血压病、神经性老年退化性疾病以及多种肿瘤,包括乳腺癌、胰腺癌、胃癌、食管癌、肺癌、黑色素瘤等。EFhd家族包括EFhd1和EFhd2两名成员,是EF家族中保守且高度同源的钙结合蛋白,由一个n端无序区域、两个Ca2+结合EF-hands中心区域和一个c端卷曲线圈区域组成,两者在AA 20-80区域差别最大[12-14]。有研究证明,EFhd1在肾癌细胞 (RCC)中的表达受到抑制,并可作为HNF4A的一个靶基因[15-16]。相反,EFhd1在乳腺癌及结直肠癌的异常DNA甲基化中高表达,同时在Ⅲ期和Ⅳ期黑色素瘤患者的肿瘤[18]组织中高水平表达并与患者的生存期缩短显著相关,提示预后不良[17-18]。另外,有实验证明,EFhd1在胰腺癌中的表达受SOD2,一种能使超氧化物歧化酶失活以保护细胞免受氧化损伤的线粒体酶的调控[19]。
目前,EFhd1基因在肺癌的作用尚未有研究报道,本文选取临床病理标本,通过免疫组化方法检测其在肺癌组织及癌旁组织中的表达,并分析其与肺癌患者临床病理参数之间的相关性,同时分析其与患者预后的关系,旨在探讨其作为肺癌预后判断和潜在基因治疗靶点的可能性。
资料与方法
一、研究资料
选择南通大学附属医院病理科档案库中心胸外科2004年1月至2011年4月间收治的NSCLC手术患者标本,共获得178例肿瘤组织蜡块标本及51例癌旁正常组织蜡块标本。临床资料包括性别、年龄、肿瘤直径、组织学类型、TNM分期、分化程度、淋巴结转移、远处转移等,术后随访满5年,随访资料完整,期间失访或死亡原因为非肺癌的患者被排除。所有患者在术前均未接受新辅助放化疗、靶向治疗及免疫治疗。纳入实验的178例患者的,癌组织其中男性137例,女性41例,平均年龄为62.61岁;癌旁组织中男性33例,女性18例,平均年龄为62.39岁;按照2009年第七版NSCLC病理诊断TNM分期标准:癌组织 T1期59例;T2期99例;T3-4期共20例;癌旁组织 T1期24例;T2期24例;T3~4期共3例;癌组织中 鳞癌96例,腺癌55例,其他类型27例;组织分化程度划分为低分化、中分化、高分化和未知,癌组织依次为43例、30例、97例、8例;癌旁组织依次为4例、11例、35例、1例;肿瘤直径以3 cm为界分为两组,癌组织 ≤3 cm有82例,>3 cm有96例;癌旁组织 ≤3 cm有0例,>3 cm有51例。本文经过南通大学附属医院伦理委员会批准。
二、研究方法
1. 制备组织芯片: 肿瘤组织178例和癌旁正常组织51例,所有标本均经病理诊断为NSCLC。标本被制作成厚度为4 μm厚的组织芯片,置于冰箱4 ℃冷藏室备用。
2. 免疫组化方法: (1)烤片:将组织芯片置于60 ℃恒温箱中,烘烤20 min;(2)脱蜡水化:将烘烤后组织芯片浸于二甲苯中脱蜡10 min×3次,取出后梯度乙醇水化,100%、90%、80%、70%由高到低每缸浸泡5 min,蒸馏水清洗片刻;(3)抗原修复:将组织芯片放入0.01 mol/L柠檬酸盐缓冲液中,放入高压锅中,待煮沸后沸腾5 min,室温冷却。蒸馏水洗3 min×3次,PBS水洗5 min×3次;(4)阻断:在组织芯片中滴加3%过氧化氢,避光室温孵育10 min,PBS水洗5 min×3次;(5)在组织芯片上滴加山羊血清封闭液体150 μl,在室温条件下,孵育1 h,甩去多余液体;(6)150 μl兔抗人EFhd1单克隆抗体工作液,在4 ℃条件下过夜,然后用PBS水洗5 min×3次;(7)滴加150 μl山羊抗兔通用抗体工作液,37 ℃孵育,20 min。PBS水洗5 min×3次;(8)显色剂显色:滴加DAB显色,镜下观察细胞膜染色即可,蒸馏水清洗;(9)复染细胞核:用苏木素复染2 min,再使用蒸馏水水洗至水澄清。1%盐酸乙醇分色2 s,水洗;(10)脱水透明;(11)封片:将组织芯片风干后,滴加中性树胶,封片。
3. 观察标准: 免疫组化结果由全自动病理成像系统成像,采用双盲法评分,由两位有经验的病理科医师对组织芯片上每个位点的染色情况进行评价,观察EFhd1蛋白的分布,分别记录染色阳性细胞百分比及强度。主要表达部位:EFhd1阳性表达主要定位于细胞质中,出现黄色、黄褐色、棕色颗粒为阳性细胞。每张切片随机选择10个高倍视野(×400),每个视野至少查1 000个细胞。根据切片中染色强弱程度评分:没有染色为0分;浅黄色为1分;黄褐色为2分;棕色为3分。根据切片中阳性细胞比率评分如下:少于5%,0分;5%~25%,1分;26%~50%,2分;51%~75%,3分;大于75%,4分。染色强弱程度所得分加上阳性细胞比率所得分为总得分,最小值为0分,最大值为12分。例如,一个标本包含75%的肿瘤细胞中等强度染色(3×2=6分),另外的25%的肿瘤细胞是弱强度的(1×1=1)最后得到的结果是6+1=7。数据分析的时候,0~7分被认为是低表达而8~12分被认为是高表达。
三、统计学方法
所获数据采用SPSS 23.0软件对数据进行统计分析,癌组织与癌旁组织中EFhd1蛋白表达及EFhd1表达与各临床参数间的分析采用χ2检验;采用Cox单因素及多因素分析临床病理参数与预后之间的关系,Kaplan-Meier法制作生存曲线。P<0.05为差异有统计学意义。
结 果
一、EFhd1在NSCLC组织中的表达
免疫组化方法检测了EFhd1蛋白在NSCLC组织及对应癌旁组织中的表达,结果显示,EFhd1蛋白阳性表达于NSCLC组织细胞质,呈淡黄色、黄褐色、棕色颗粒,见图1;EFhd1蛋白在NSCLC组织中高表达占比43.3%(77/178),癌旁组织中高表达占比仅有2.0%(1/51),癌组织中EFhd1高表达者显著高于癌旁组织(P=0.001),差异有统计学意义。

图1免疫组化方法检测EFhd1在NSCLC组织中的表达;注:A:鳞癌(×40);B:腺癌(×40);C:癌旁组织(×40)
二、EFhd1蛋白的表达与NSCLC患者临床病理参数之间的关系
EFhd1的高表达与肿瘤T分期(P=0.025)有关,而与患者年龄(P=0.187)、性别(P=0.533)、组织学类型(P=0.385)、分化程度(P=0.920)、淋巴结转移(P=0.312)、远处转移(P=0.381)、TNM分期(P=0.236)及肿瘤大小(P=0.228)无关,见表1。
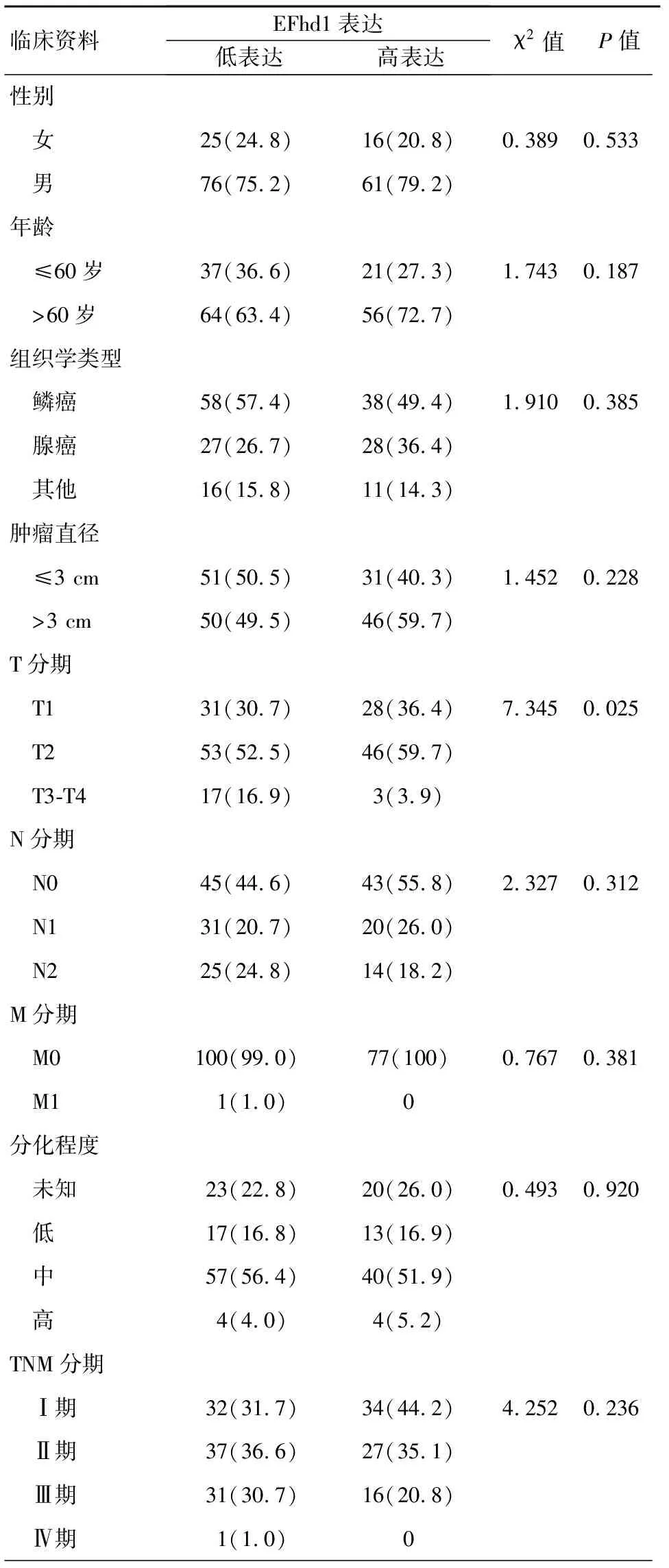
表1 癌组织中EFhd1蛋白表达程度的单因素分析[n(%)]
三、单因素及多因素分析
单因素分析结果显示TNM分期(P=0.001)、T分期(P=0.006)、N分期(P=0. 0.001)与NSCLC患者的预后相关,而EFhd1表达程度与预后无关(P>0.05)。为了排除混杂因素的影响,纳入Cox比例风险多因素模型分析,结果证实EFhd1表达程度以及TNM分期为独立预后因素 (P<0.05),见表2。

表2 NSCLC患者预后单因素和多因素分析
四、生存分析
生存曲线显示EFhd1高表达对应患者的短生存期和较差预后,TNM分期越晚则生存时间越短,差异有统计学意义,见图2。
讨 论
肿瘤的发生发展是一个多因素参与、多信号通路交错调控的复杂过程,近几年来,随着肿瘤分子生物学的发展,及对肿瘤发展机制研究的不断深入,越来越多的驱动基因及抑癌基因被发现。分子靶向治疗除了可以直接对促进肿瘤生长的特异性细胞受体及信号传导通道发挥作用,还可以参与新生血管形成及细胞周期的调节,从而有效抑制肿瘤细胞的增殖、迁移,诱导癌细胞凋亡。

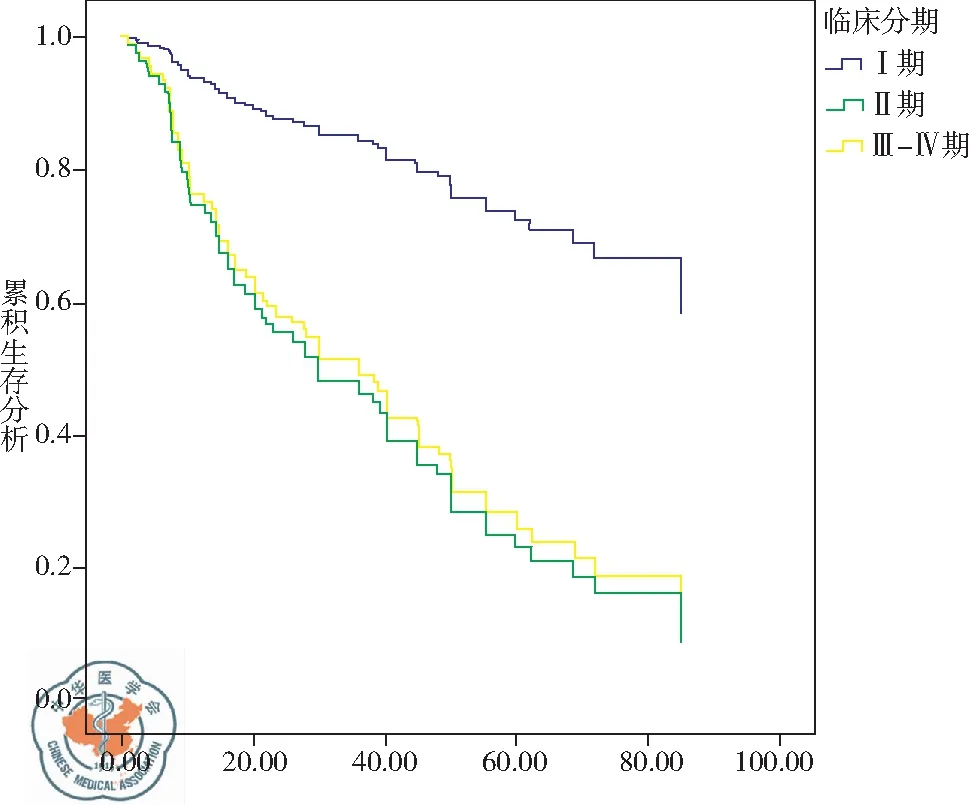
图2生存曲线
本文探讨了EF手型钙结合蛋白家族成员之一EFhd1在NSCLC中的表达及临床意义。通过采用高通量组织芯片技术结合免疫组化法检测EFhd1在NSCLC和癌旁组织的蛋白表达水平,发现EFhd1阳性表达主要在NSCLC细胞的细胞质中,结果显示EFhd1蛋白在NSCLC癌组织表达水平明显高于癌旁组织,两者差异有统计学意义(P<0.01)。Davidson等[17]研究发现,EFhd1在乳腺癌中表达增高,在肺腺癌的胸腔积液中,EFhd1的表达无明显上调,产生这种不一致的原因一方面可能是在实体肿瘤中存在大量基质相关基因,而渗出标本中没有这些基因,另一方面可能是渗出液与原发性肿瘤中的癌细胞之间的具有真实的分子差异。有研究表明,对原发性乳腺癌和乳腺癌渗出物的阵列分析支持这两个因素对基因表达差异有影响[20]。考虑也可能与胸腔积液中细胞数较少有关,无法全面表现出该基因的表达,而直接采用肿瘤组织标本进行实验,因此得到阳性结论。Takane等[21]进行了甲基化DNA免疫沉淀芯片分析,并结合基因再表达分析,得出在结直肠癌异常甲基化DNA中EFhd1存在表达,并可联合PPP1R3C作为早期诊断的有效生物学标记物。相反的是,在肾癌细胞中EFhd1的表达程度较正常肾组织减少[15]。研究发现EFhd1可能是HNF4A的一个作用靶点,而HNF4A具有肿瘤抑制功能,如果诱导EFhd1在肾癌细胞中的表达反而可以增加肿瘤增殖,可见EFhd1本身的作用似乎与HNF4A的增殖抑制相抗衡[16]。同时猜测EFhd1的表达还可能与肿瘤类型、细胞内环境等因素有关。
本文运用单因素及多因素分析了EFhd1的表达与NSCLC患者预后之间的相关性。单因素结果发现TNM分期、T分期、N分期与患者的预后有关,但是EFhd1表达程度与生存预后无关。本文再一次把全部临床病理参数纳入Cox比例风险模型进行多因素分析,结果提示TNM分期和EFhd1的表达程度是预后的独立危险因子。生存曲线也证实EFhd1高表达对应患者的短生存期和较差预后, TNM分期越晚则生存时间越短,该研究结果与Ⅲ期和Ⅳ期黑色素瘤组织中所测的结果相一致。本文在单因素分析中,EFhd1的表达与生存预后无关,考虑可能是单因素分析中未能排除混杂因素的交互作用对统计结果的影响,因此应以多因素模型分析结果为准。
EFhd1是一种定位于线粒体内膜的钙结合蛋白,是参与B细胞识别和控制早期B细胞发育的TFs的靶基因。Urbanczyk等[22]在一项关于早期B细胞发育的研究中发现,在从pro-B到pre-B细胞的转化过程中,后者需要下调EFhd1的表达,而pre-B细胞中SOD2的上调与其抑制EFhd1表达的功能密切相关,这与在胰腺癌中所观察到的结果相一致[19,23]。EFhd1的表达显著增强了PGC-1α,PGC-1α是参与线粒体生物发生的PPAR的共同激活剂,提示EFhd1表达有利于线粒体作为优先的能量来源。线粒体功能障碍是癌细胞的主要特征之一,线粒体功能障碍导致的代谢异常、ROS生成增加、mtDNA基因突变以及钙离子稳态失衡广泛参与了癌细胞的无限增殖、凋亡抵抗、侵袭及转移。研究表明,EFhd1可以上调PGC-1α的表达,而PGC-1α超表达在主要骨胳肌管和Hela细胞增加了线粒体体积,导致线粒体Ca2+积累过程中线粒体Ca2+浓度的减少,这一现象可能导致细胞对Ca2+介导的凋亡敏感性降低[24]。另一个有趣的发现是,线粒体中的EFhd 1与雌激素受体α链(ESR 1)相互作用,而ESR 1和PGC-1α存在双向依赖[25]。因此EFhd 1可能通过ESR1影响PGC-1α及其靶基因的表达,进一步的实验表明,在转化的pro-B细胞系38B9中通过Crispr-Cas9介导的EFhd1敲除及其shRNA介导的基因敲除,可导致糖酵解、糖酵解速率以及糖酵解能力储备的增加。因此,EFhd1上调PGC-1α及其对糖酵解的负作用表明EFhd1是一种潜在的分解代谢因子。此外,Tominaga等研究认为EFhd 1参与神经元的分化,并通过线粒体发挥作用。
近年来,一种新型的动态线粒体活动被研究发现,即线粒体闪光,这是一种在健康和疾病状态下控制线粒体代谢和信号传递的具有生物能量的线粒体事件,其既是一个耗能的过程,又存在对细胞产生氧化应激损伤的风险,它们广泛存在于从蠕虫到人类的各种不同种类的细胞和组织中。线粒体闪光发生率受到代谢状态、氧化应激、发育阶段和衰老等因素的调控,并与线粒体功能以及其他核心线粒体信号密切相关。研究表明,EFhd1通过选择性地调控Ca2+来调节线粒体闪光,而不影响线粒体Ca2+的升高、线粒体ROS的产生和线粒体呼吸功能。他们生成了一个EFhd1突变体(mtEFhd1),其两个EF-hand结构域均被破坏,结果完全丧失了调节线粒体闪光活性的能力。这一结果表明EF-hand结构域是EFhd1激活Ca2+依赖型线粒体闪光所必需的,从而证实了EFhd1作为线粒体Ca2+传感器激活Ca2+依赖型线粒体闪光的观点。
综上所述,本文探讨了EFhd1在NSCLC中的表达及其临床意义,结果表明EFhd1在NSCLC中的表达远较癌旁组织明显增高,且其高表达与NSCLC患者的不良预后可能有关,提示EFhd1有可能作为临床检测或联合检测的指标,提高临床诊断率,可能作为肺癌精准治疗的潜在靶点之一,其具体作用机制及通路仍需后续大量的基础及临床实验研究进行验证。
