基因工程抗体在微囊藻毒素检测分析中的应用研究
2019-04-08徐重新李建宏刘贤金
徐重新,刘 媛,李建宏,刘贤金*
(1.江苏省农业科学院 农产品质量安全与营养研究所,省部共建国家重点实验室培育基地——江苏省食品质量安全重点实验室,江苏 南京 210014;2.南京师范大学 生命科学学院,江苏 南京 210023)
微囊藻毒素(Microcystin,MC)是由微囊藻(Microcystis)、鱼腥藻(Anabaena)、束丝藻(Aphanizomenon)、拟柱胞藻(Cylindrospermopsis)以及颤藻(Oscillatoria)等蓝藻在水华过程中产生的一种由环状七肽组成的小分子剧毒致癌性生物毒素,普遍存在于富营养化水体中,是威胁水资源安全的最主要危害因素之一[1]。目前,被发现和鉴定的微囊藻毒素亚型已经超过200种,其分子量多在1 000 Da左右,其中LR是最常见、分布最广也是毒性最强、危害最大的一种亚型[2-3]。微囊藻毒素-LR(MC-LR)是一种典型的肝毒素,通过靶向抑制蛋白磷酸酶1 和2A的活性,引起细胞凋亡,诱发癌变,导致肝功能衰竭坏死;同时还对肾脏、心脏、免疫系统和生殖系统等组织具有较强的生物毒性[4-7]。微囊藻毒素具有水溶性极好、化学性质稳定、耐高温、不易变性等特点,且能够通过生态系统和食物链循环在水体、土壤、水产品和农作物中蓄积,从而危害人类及动物健康[1-2,8-9]。MC-LR现已经被国际癌症研究署(International Agency for Research on Cancer,IARC)列为2B类致癌物质,国际卫生组织(World Health Organization,WHO)将其在饮用水中的最大残留限量标准(Maximum residue limit standard,MRLs)设定为1.0 μg/L,且规定每日允许摄入量(Acceptable daily intake,ADI)不得高于0.04 μg/(kg bw·d)[10-11]。因此,为确保饮用水资源和农产品(特别是食用农产品)质量安全,建立可用于快速高灵敏度分析微囊藻毒素残留的检测方法,对保障人和动物的健康极其必要。
目前,可用于微囊藻毒素分析的检测方法众多,主要可分为以下几种:基于动物毒理实验的生物测定法、基于毒素物理化学性质的仪器分析法(如高效液相色谱法(HPLC)、高效液相色谱-串联质谱法(LC-MS)、气相色谱-串联质谱法(GC-MS)和基质辅助激光解析串联飞行时间质谱法(MDLDI-TOF MS)等)、基于“抗体-抗原”或蛋白质酶学识别原理的生物化学检测法(如免疫学分析法(Immunoassay)和蛋白磷酸酶抑制法(PPIA)),以及基于毒素基因的分子生物学检测方法(如PCR检测法、实时定量PCR(qPCR)检测方法和基因芯片技术)等[12-13]。其中,以酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)为代表的免疫学分析法因具有反应快速灵敏、抗原特异性强、样品处理简单、操作和使用方便、适用性广等优点,具有广阔的应用价值和商业前景,已成为当今小分子生物毒素快速检测研究的热点[14-15]。本文从当前热门的基因工程抗体创制技术入手,着重梳理了国内外基因工程抗体在微囊藻毒素检测应用上的最新研究状况,并就基因工程抗体的发展及应用前景进行探讨和展望,旨在为推进基因工程抗体在微囊藻毒素检测上的应用提供有价值的参考资料和辅助建议。
1 微囊藻毒素产生的主要因素
微囊藻毒素作为蓝藻水华时产生的一种危害最大的有毒次生代谢产物,其产生因素不仅跟产毒藻类内在有关基因的表达及藻细胞特殊的生理生态特征有关,还受到引起蓝藻水华外在自然因素的诱导和调控。关键的内在因素:目前普遍认为产毒藻类均含有mcy家族基因且主导了微囊藻毒素肽链的复杂转录合成过程,其中mcyG、mcyJ、mcyD、mcyE、mcyF、mcyA、mcyI、mcyB、mcyC和mcyH等基因型先后协同参与微囊藻毒素关键多肽的转录合成及修饰,并在聚酮合酶(Polyketide synthase,PKS)和非核糖体合酶(Non-ribosomal peptide synthase,NRSP)等特殊酶的共同作用下,利用氨基酸或者化合物,绕开核糖体,最终经非核糖体合成途径完成微囊藻毒素的合成[16];此外,产毒藻类具有的独特生理生态特性,也是维系和促进微囊藻毒素产生的重要内在因素,如产毒藻类普遍存在伪空泡(气囊)和较厚的胶质鞘等结构,以及高效的CO2吸收、氮固定能力和适应低光强、防晒等特性[17-19]。主要的外在因素:有利的综合环境因子是诱导和刺激蓝藻水华从而释放微囊藻毒素的必要条件,其中氮磷营养盐的富营养化(N>0.5 mg/L,P>0.02 mg/L)和恰当的配比(N/P=16~29)是最关键的催化诱因,适合的水体温度(25~35 ℃)是水华发生的主要孵育温床,此外适宜的水文(水力滞留时间>2周)和气象(风速<3 m/s)条件、光照强度和日照时间,以及微量元素等都是蓝藻水华发生的重要环境因素[17,20-21]。
2 微囊藻毒素的致毒机理及主要危害风险
微囊藻毒素是一类具有共性环状七肽结构的小分子生物毒素。在目前已经发现和鉴定的近200种亚型中,MC-LR、MC-RR和MC-YR 3种亚型是蓝藻水华水体中最常见也是毒性最强的微囊藻毒素类型,其中又以MC-LR亚型在环境中最普遍、毒性最强、危害最大也就关注最多、研究得最透彻;MC-LA和MC-WR毒性中等,而其余亚型则较为少见且毒性相对较弱(表1)[22-24]。以MC-LR亚型为典型代表的微囊藻毒素的最大危害风险是严重损伤动物肝脏,同时对动物免疫和神经系统以及肠、胃、肾、脑等组织或器官具有多重损伤,甚至能够抑制多种微生物生长,打破环境微生态群落平衡。在细胞水平上,大剂量微囊藻毒素暴露在细胞表面,能提高细胞乳酸脱氢酶(Lactate dehydrogenase,LDH)渗出率,短时间即可破坏细胞膜的稳定性和完整性,引起细胞形变、失活,导致坏死[5];进入胞内后,微囊藻毒素通过靶向抑制蛋白磷酸酶1 和2A的活性,使骨架蛋白过磷酸化,引起变性,扰乱细胞骨架系统[6];同时,微囊藻毒素在胞内还能引发活性氧自由基(Reactive oxygen species,ROS)快速产生,引起系列氧化应激级联反应,从而扰乱信号传导,影响胞内细胞器正常功能,导致细胞凋亡或增殖[25]。在基因水平上,微囊藻毒素及其在胞内诱导产生的某些衍生物(如ROS)均能在一定程度上诱导DNA发生不可逆突变,主要体现在改变细胞核形态、破坏DNA结构和抑制DNA修复等[26-27],此外还有研究显示微囊藻毒素能改变致癌基因和肿瘤抑制基因的表达等[28-29]。

表1 微囊藻毒素结构通式、主要亚型及其危害风险Table 1 Chemical structure,main subtypes and hazard risk of microcystin
3 基因工程抗体及其创制技术
基因工程抗体是相对于传统动物免疫产生的多/单克隆抗体而言的,伴随现代基因工程和分子改造技术发展而来的具有抗体功能的人工生物肽链或多肽。目前,报道可查的基因工程抗体类型主要有抗原结合片段(Fragment of antigen binding,Fab)、单链抗体(Single-chain variable fragment,scFv)、单域抗体(Single-domain antibody,sdAb)以及具有模拟抗体功能的特殊小分子多肽(Polypeptide)等(表2)。其中,单链抗体是目前研究最多、应用最广的基因工程抗体,它由抗体的重链(VH)和轻链(VL)经特殊设计的Linker序列拼接而成,具有较为完整的抗体功能和生物活性,现已在生物医药、生物诊断和免疫检测等领域具有较为成熟的应用[15,30];同时,单域抗体中的驼源纳米抗体(VHH)因其天然特殊的分子结构特征,具有稳定性和穿透性强、可容性好、免疫原性低以及更易表达等独特优势,已日趋成为基因工程抗体创制的新热点[31-32]。基因工程抗体一般借助抗体展示系统(如噬菌体、酵母、核糖体及细菌等(表2))形成抗体库,然后通过固相化包被抗原,经多轮“投入-吸附-洗脱-扩增”步骤从库中靶向淘筛具有抗原特异性的基因工程抗体[33];也有将经抗原免疫制备的单克隆抗体重轻链基因反转录拼接成为完整的单链抗体基因,然后直接进行克隆表达的报道[34]。噬菌体表面展示系统是当前基因工程抗体库构建和应用领域研究最早、技术最为成熟和应用最广的可用于基因工程抗体展示的系统[35-36],目前已经商品化的噬菌体基因工程抗体库有英国剑桥大学蛋白质工程中心研发的人源化的Tomlinson(I+J)单链抗体库和人源重链半合成的Domain antibody 单域抗体库,以及NEB 公司推出的随机十二肽库(ph.D.-12)和七肽库(ph.D.-7)等[37],此外还有众多鼠源、兔源、鸡源以及驼源噬菌体基因工程抗体库构建或应用的报道[15,38-40]。

表2 基因工程抗体主要形式及其常用展示系统Table 2 Main forms and display systems of genetically engineered antibodies
4 基因工程抗体在微囊藻毒素检测上的应用
基于噬菌体表面展示基因工程抗体库及配套的抗原特异性抗体高通量淘筛方法,是快速靶向获得微囊藻毒素基因工程抗体的最主要手段。本文作者借助ISI Web of Science网站(http://isiknowledge.com/)和中国知网(http://www.cnki.net/)数据库搜索了2000年以来国内外有关微囊藻毒素基因工程抗体创制及应用研究的文献报道,共统计论文总数接近20篇,涉及的基因工程抗体均为噬菌体表面展示形式,其中单链抗体占绝对多数,其次是纳米抗体,此外还有零星小分子多肽抗体的报道(表3)。McElhine等[41]率先将微囊藻毒素偶联到牛血清蛋白(BSA)上形成MC-BSA作为包被抗原,然后通过富集筛选,从人源半合成的单链抗体库(Tomlinson I)中成功获得了具有MC-LR识别能力的单链抗体,并建立了微囊藻毒素的间接竞争酶联免疫检测方法(Indirect competitive enzyme-linked immunosorbent assay,IC-ELISA),其半抑制浓度(Half-maximum inhibition,IC50)为4 μg/mL;Zhao等[42]将微囊藻毒素与生物素偶联并作为包被抗原,从随机12肽库中筛选到了多个具有MC-LR的多肽抗体,并建立了间接非竞争酶联免疫检测方法(Indirect non-competitive enzyme-linked immunosorbent assay,INC-ELISA);Lawton等[43]则利用单链抗体建立了针对MC-LR快速检测的侧流免疫分析方法(Lateral flow immunoassay,LF-IA),其最低检测灵敏度(Limit of detection,LOD)达到了0.1 μg/L。此外,本实验团队成员刘媛等[44]利用从鼠源合成库噬菌体抗体库中筛选到的单链抗体,建立了针对MC-LR的时间分辨荧光免疫分析法(Time-resolved fluoroimmunoassay,TRFIA),最低检测灵敏度达13 ng/mL;Xu等[39]以微囊藻毒素和血蓝蛋白(Keyhole limpet hemocyanin,KLH)的偶联物作为包被抗原,从驼源天然纳米抗体库中成功筛选到了高灵敏识别MC-LR的纳米抗体,建立的IC-ELISA显示,其IC50和LOD值分别达到了0.87 μg/L和0.06 μg/L,且其对MC-RR、MC-YR、MC-LW和MC-WR均具有一定的交叉识别能力。
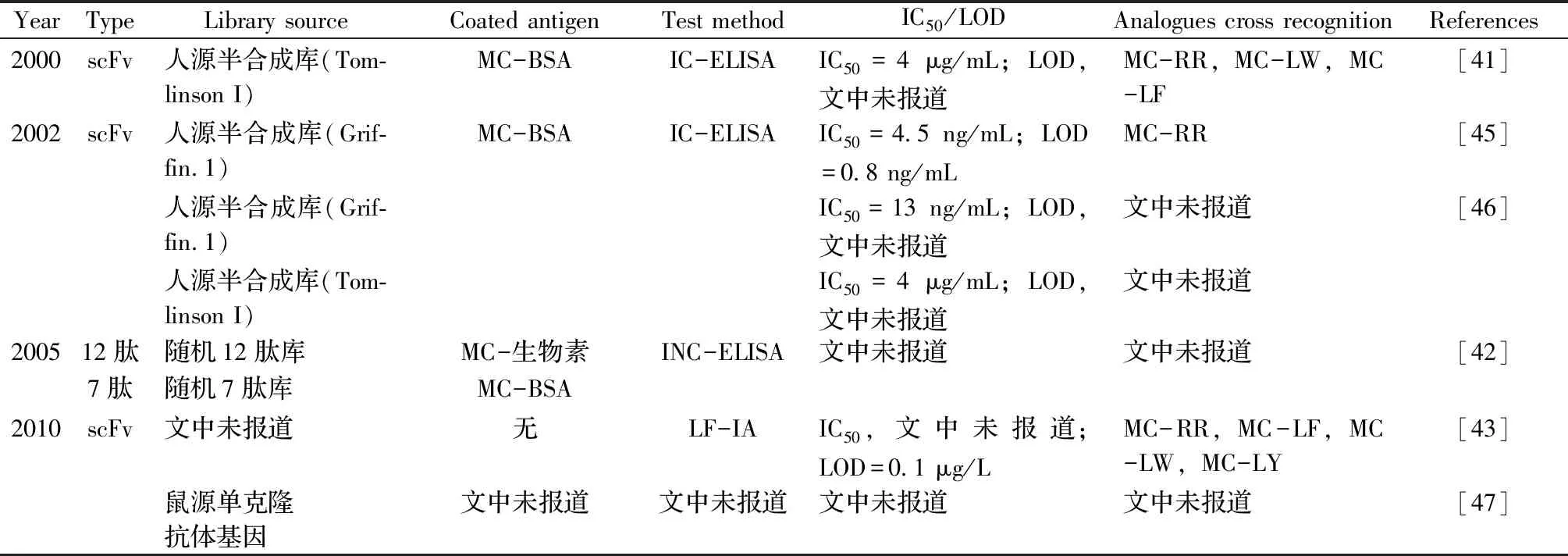
表3 基因工程抗体在微囊藻毒素-LR免疫检测上的研究报道Table 3 The reports of genetically engineered antibodies used for MC-LR determination
(续表3)

YearTypeLibrary sourceCoated antigenTest methodIC50/LODAnalogues cross recognitionReferences2012scFv鼠源合成库MC-生物素-磁珠TRFIAIC50=435 ng/mL;LOD=13 ng/mL文中未报道 [44]2013scFv鼠源合成库MC-生物素-磁珠TRFIAIC50=2.1 ng/mL;LOD,未见报道文中未报道 [48]2014scFv人源半合成库(Grif-fin.1)MC-OVAIC-ELISAIC50=2.97 μg/mL;LOD=0.25 μg/mL文中未报道[49]2015scFv鼠源免疫抗体库MC-OVAIB-ELISAIC50=4.8 ng/mL;LOD=0.19 ng/mLMC-LW,MC-RR,MC-YR,MC-LA,MC-LF [50]2016scFv鼠源单克隆抗体基因MC-OVAIC-CLISAIC50=0.81 μg/L;LOD=0.13 μg/LMC-RR,MC-YR,MC-LW [34]文中未报道MC-链亲和素INC-TRFIAIC50,文中未报道;LOD=0.026 μg/LMC-RR,MC-YR,MC-LA,MC-LY,MC-LF,MC-LW,MC-WR [51]2017scFv文中未报道MC-链亲和素INC-ELISAIC50,文中未报道;LOD=0.2 μg/LMC-RR,MC-YR,MC-LA,MC-LY,MC-LF,MC-LW,MC-WR [52]VHH驼源免疫抗体库MC-BSA IC-ELISAIC50=0.28 μg/L;LOD=0.05 μg/LMC-RR,MC-YR [53]2018VHH驼源天然抗体库MC-KLHIC-ELISAIC50=0.87 μg/L;LOD=0.06 μg/LMC-RR,MC-YR,MC-LW,MC-WR [39]
5 结语与展望
微囊藻毒素污染及其引起的安全危害风险是世界性问题,备受国际社会关注,因此研发一种快速、简单、灵敏的可用于微囊藻毒素监测的检测方法及其产品,不仅具有重要的社会和科学意义,同时还具有广阔的市场前景,蕴含着巨大的商业价值。基于“抗体-抗原”识别的免疫学检测方法,特别是商品化的快速检测试剂盒(如检测试纸),因其低成本、高灵敏、操作简单、实用性强、适用性广等优势,在分子诊断和有毒有害物检测分析领域备受科研工作者、政府监管部门以及广大普通消费者青睐。基因工程抗体作为抗体创制领域最新研究的热点,摆脱了创制抗体需由动物免疫产生的制约,通过依托抗体表面展示技术形成大容量和多样性强的抗体库,再经抗原特异性高通量靶向筛选,获得抗体及其基因,实现了基因工程抗体的可人工多系统克隆表达,甚至还可在基因水平上分析和改造抗体特性,应用前景势不可挡[15,54];但是,作为新兴的抗体类型,基因工程抗体及其创制技术并没有像传统多克隆抗体和单克隆抗体那样发展到足够成熟,仍然普遍存在筛选随机性强、抗原亲和力不够高、抗体稳定性较差以及半衰期短等问题,严重限制了其应用[55-56]。截至目前,针对微囊藻毒素检测的基因工程抗体创制研究已接近20年,基因工程抗体类型涵盖单链抗体、多肽抗体以及纳米抗体,库源涉及人源、鼠源、驼源以及随机合成多肽等,但这些研究仅停留或受限制在实验室内,尚属于初步探索阶段,均未转化成为可推广应用的商品化试剂盒产品。
为推进基因工程抗体及其创制技术在微囊藻毒素检测上的应用,解决基因工程抗体在活性和稳定性上的不足是首要问题。首先需要改进传统筛选方法:采用多次交替多种微囊藻毒素偶联载体(如MC-BSA/OVA/KLH/生物素/磁珠等)作为富集、分离及鉴定等过程的包被抗原,充分规避可能由大分子载体导致的假阳性现象干扰,是从抗体库获取微囊藻毒素高活性基因工程抗体较为简单和可行的筛选方法[39];其次构建免疫抗体库:通过微囊藻毒素免疫动物(如鼠、兔、羊驼等),刺激动物脾脏等免疫系统特异性富集针对微囊藻毒素的抗体基因大量表达,然后构建免疫抗体库用于库筛选,以期大幅提高筛选获得微囊藻毒素高活性基因工程抗体的概率和效率,该方法已有多种毒素高活性基因工程抗体成功创制的报道[15,57];再次是采用分子改造技术进行亲和成熟:借助生物信息学手段辅助预测和分析基因工程抗体与毒素蛋白结合的热点区域,进行定点突变、DNA改组以及链置换等改造,均是大幅改进母本基因工程抗体亲和力活性以及进行特性修饰的常见有效方法[58-59]。最后是借助标记特殊发光基团:在抗体-抗原亲和力无法改进的条件下,对抗体进行特殊发光基团(如Sm3+、Eu3+)标记,建立的免疫学检测方法在特殊仪器中对抗原的检测灵敏度可提高成百上千倍,是提高小分子生物毒素检测灵敏度较为常见的手段[60]。
