QuEChERS/超高效液相色谱-串联质谱法同时测定水产品中四溴双酚A与六溴环十二烷
2019-04-08于紫玲马瑞雪朱晓辉朱俊彦陈希超刘立婷向明灯于云江
于紫玲,左 优,2,马瑞雪,朱晓辉,朱俊彦,2,陈希超,刘立婷,3,向明灯*,于云江*
(1.环境保护部华南环境科学研究所 国家环境保护环境污染健康风险评价重点实验室,广东 广州 510535; 2.长安大学 环境科学与工程学院 旱区地下水文与生态效应教育部重点实验室,陕西 西安 710064;3.锦州医科大学 公共卫生学院,辽宁 锦州 121001)
四溴双酚A(Tetrabromobisphenol A,TBBPA)和六溴环十二烷(Hexabromocyclododecane,HBCD)作为添加型阻燃剂,广泛应用于电子产品、塑料、纺织品和建筑材料等[1-2]。其中,HBCD主要有α-HBCD、β-HBCD和γ-HBCD 3种同分异构体。近年来,TBBPA和HBCD对人体健康的影响备受关注。美国国家毒理学计划(NTP)的研究显示,TBBPA暴露能增加雌性大鼠的子宫肿瘤发生率[3]。此外,国际癌症研究中心也将TBBPA提升为2A类致癌物[4]。欧洲化学品管理署指出HBCD是一类具有持久性、生物累积性和毒性的化合物,并将其列入《斯德哥尔摩公约》禁止在全球范围内使用[5]。目前,各环境介质和生物样本中均检出TBBPA和HBCD[6-8]。Schecter等[9]对美国市场310份食品中HBCD的调查显示,HBCD的含量范围为23~593 pg/g。Shi等[10]对中国16个省份人体母乳中TBBPA和HBCD的检测结果显示,其平均含量分别为7.58 ng/g(脂重)和10.1 ng/g(脂重)。欧洲食品安全局(EFSA)呼吁各成员国提供食品中TBBPA和HBCD的研究数据,以评估两者的环境风险[11-12]。但提供的652份样品中TBBPA的分析结果大多低于检出限,且未检出的样品类型主要为鱼类等水产品(n= 465)[11]。因此,迫切需要建立更为准确可靠的水产品中TBBPA和HBCD的分析方法。
目前,单独对TBBPA和HBCD的仪器分析技术已相对成熟,主要采用液相色谱-质谱联用仪测定[13-14],TBBPA和HBCD作为溴代阻燃剂的添加剂,通常同时存在,且分析检测方法相近,因此可将这两类物质进行同时分析[15-16]。通常这两类物质的前处理主要采用索氏提取法、超声提取法和加速溶剂萃取法等提取后,再经层析柱、自动凝胶渗透色谱(GPC)等净化手段,操作过程繁琐,无法满足常规监测的时效性要求[6-10,17]。施致雄[17]建立了同时测定动物源性食品中TBBPA和HBCD的超高效液相色谱-质谱方法,其中前处理采用传统的索氏提取法,样品净化采用GPC结合浓硫酸除脂,该方法虽能达到很高的回收率,但操作复杂,耗时(20 h)且所耗溶剂较多(150 mL)。QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)方法是美国农业部Anastassiades教授等[18]提出的一种新的快速样品前处理技术,具有准确、简便、快速、高效、成本低等优点。但该方法主要针对农产品中农药残留的高效分析,应用于水产品中TBBPA和HBCD的分析检测报道甚少[19-21]。本文建立了基于QuEChERS提取和净化为一体的水产品中TBBPA和HBCD的超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法,通过快速、有效的样品前处理步骤,保证TBBPA和HBCD的有效提取,为水产品健康风险评估提供了更为简便、灵敏和可靠的分析方法。
1 实验部分
1.1 仪器与试剂
Agilent 1260 超高效液相色谱(美国安捷伦科技有限公司),AB SCIEX4000Qtrap MS三重四极杆串联质谱仪(SCIEX 公司);E-916/914加速溶剂萃取仪、R-215旋转蒸发仪(瑞士Buchi公司);N-EVAPTM112氮吹仪(美国Oranomation Associates);Milli-Q超纯水器(美国Millipore公司);R-470C冷冻干燥机(美国SP Scientific公司);SX-13-10马弗炉(沪越科学实验仪器厂);Model 945617涡旋混合器(美国Talboys公司);高速离心机(美国赛默飞世尔科技公司)。
甲醇(色谱纯,德国Merck公司);丙酮、二氯甲烷、正己烷、乙腈(色谱纯,德国CNW科技公司);N-丙基乙二胺(PSA)、C18(天津博纳艾尔杰公司);无水硫酸钠(广州市化学试剂厂)。
TBBPA、α-HBCD、β-HBCD、γ-HBCD、13C-TBBPA标准物质(美国Cambridge Isotope Laboratories),D18-α-HBCD、D18-β-HBCD、D18-γ-HBCD内标(美国AccuStandard公司)。
1.2 仪器条件
1.2.1液相色谱条件CORTECS®C18色谱柱(4.6 mm×100 mm×2.7 μm,美国Waters公司);流动相:A为甲醇,B为超纯水。梯度洗脱程序为:0~4.5 min,90% A;4.5~5.5 min,90%~100% A;5.5~6.5 min,100% A;6.5~10 min,100%~90% A。流速为0.7 mL/min,进样量为10 μL,柱温为40 ℃。
1.2.2质谱条件采用电喷雾离子源(ESI),在负离子模式下以多反应监测(MRM)方式分析。电喷雾电压为-4 500 V;入口电压为-10 V;碰撞室出口电压为-15 V;TBBPA和HBCD各单体的母离子、子离子、去簇电压和碰撞能量见表1。

表1 TBBPA和HBCD优化的质谱条件Table 1 MS parameters for the analysis of TBBPA and HBCD
* quantitative ion
1.3 样品前处理
准确称取1 g(精确至0.001 g)样品至15 mL离心管中,加入20 μL 2.5 mg/L13C-TBBPA 和D18-HBCD混合内标,加入2 mL饱和氯化钠和4 mL乙腈,涡旋振荡10 min,7 500 r/min离心5 min,转移上清液至15 mL离心管中。重复萃取2次,氮吹定容至1 mL后转移溶液至2 mL装有50 mg无水硫酸镁和50 mg C18的离心管中,涡旋振荡10 min,10 000 r/min离心5 min,上清液过0.22 μm亲水聚四氟乙烯(PTFE)滤膜,待测。
2 结果与讨论
2.1 质谱与液相色谱条件的优化
2.1.1质谱条件的优化采用针泵进样的方式,将500 μg/L 的TBBPA和HBCD各单标溶液以20 μL/min的流速连续注入ESI源中,在负离子监测模式下分别进行Q1和Q3扫描确定母离子和子离子对,然后优化各化合物的去簇电压和碰撞能量等质谱参数。TBBPA和HBCD的最佳质谱条件如“1.2.2”所示。
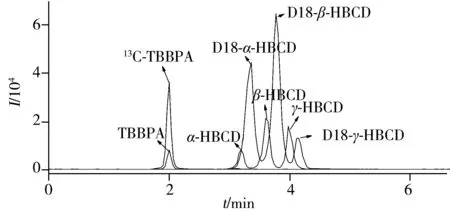
图1 TBBPA和HBCD单体的总离子流图Fig.1 Total ion chromatograms(TIC) of TBBPA and HBCD isomers
2.1.2液相色谱条件的优化采用CORTECS®C18(4.6 mm×100 mm×2.7 μm)为分离色谱柱,比较了乙腈-水和甲醇-水溶液作为流动相的分离效果。结果表明,此2种流动相均能达到良好的分离效果,但乙腈-水作流动相时目标峰的响应值较低,因此本研究选用甲醇-水为流动相。10 μg/L 加标贝肉组织匀浆样品中TBBPA和HBCD各单体的总离子流图见图 1。
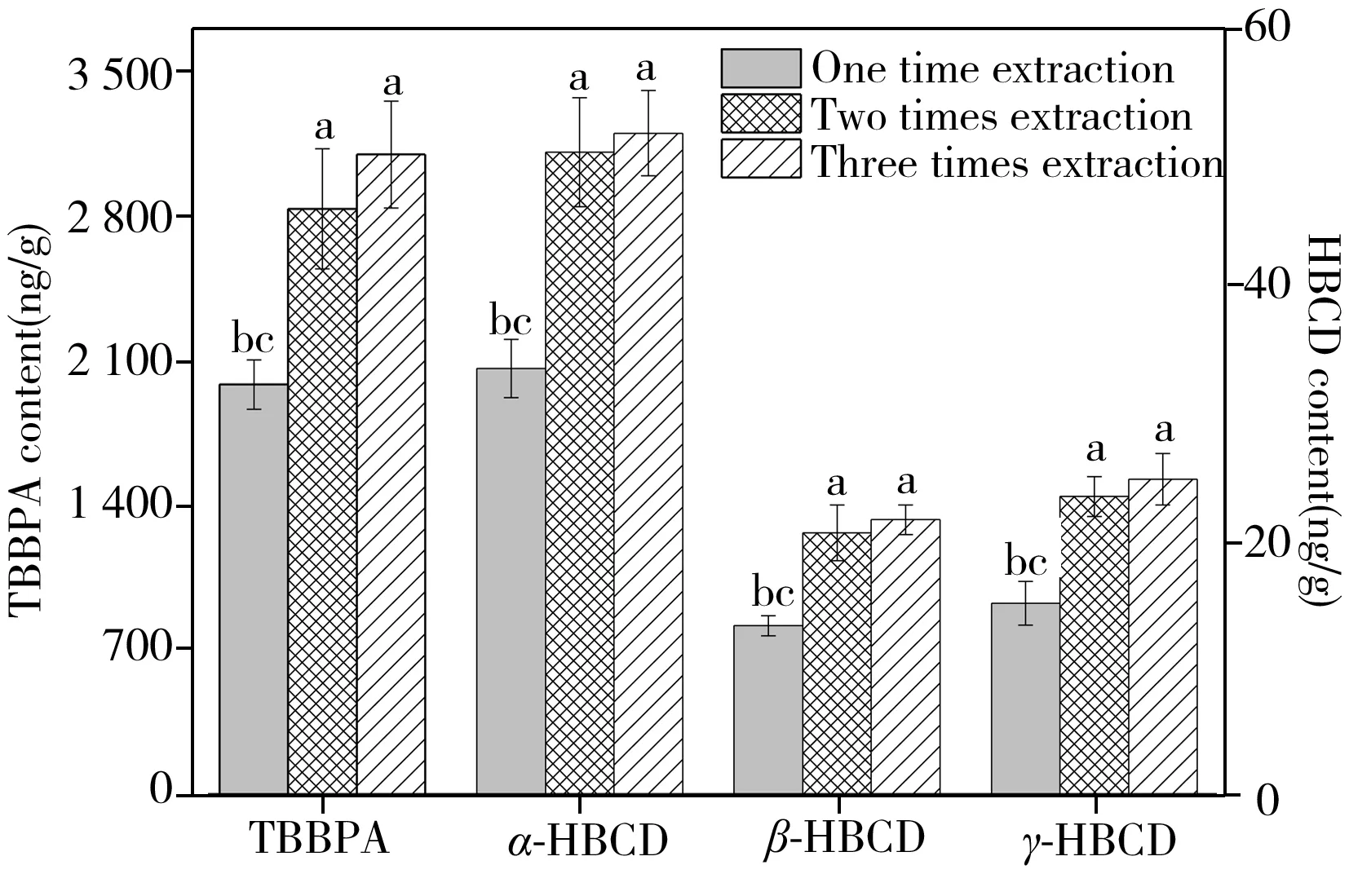
图2 不同萃取次数对TBBPA和HBCD提取效果的影响Fig.2 Effects of extraction time on extraction efficiencies of TBBPA and HBCD isomers compare with one time(a),two times(b) and three times(c) extraction,p<0.05

图3 不同C18用量对TBBPA和HBCD回收率的影响Fig.3 Effects of C18 content on recoveries of TBBPA and HBCD isomers compare with C18 of 25 mg(a),50 mg(b) and 100 mg(c),p<0.05
2.2 提取条件的优化
2.2.1萃取次数的影响以1 μg/L HBCD和0.5 μg/L TBBPA暴露7 d后的河蚌组织匀浆样品为研究对象,选用QuEChERS样品提取方法,比较了不同萃取次数对TBBPA和HBCD各单体的提取效率(图2)。结果表明,样品萃取1、2和3次时,TBBPA的含量分别为1 984±119、2 833±291和3 097±259 ng/g(干重),其中萃取2次和3次提取出的TBBPA含量显著高于萃取1次(p<0.05),而萃取2次和3次提取的含量不存在显著差异(p>0.05)。萃取次数对HBCD各单体提取效率的影响与TBBPA类似。因此,为减少溶剂消耗以及提高处理效率,本研究选择萃取次数为2次。
2.2.2与加速溶剂萃取方法的比较对比了QuEChERS法和加速溶剂萃取法(ASE)对样品中TBBPA和HBCD的提取效率。ASE法参照文献[22]:以正己烷-二氯甲烷(体积比1 ∶ 9)为提取溶剂,萃取温度为90 ℃,静态提取时间为4 min,循环3次。结果表明,ASE法提取的TBBPA含量(2 919±146 ng/g)略高于QuEChERS法(2 833±291 ng/g),但差异不显著(p>0.05);ASE法提取的HBCD各单体含量略高于QuEChERS法,也不存在显著差异(p>0.05)。因此,QuEChERS方法用于提取水产品中TBBPA和HBCD基本能满足分析需要。
2.3 净化方法的优化
2.3.1吸附填料的选择QuEChERS法的常用净化剂为C18、PSA及石墨化炭黑(GCB)等吸附填料[23-24]。C18主要去除脂肪等弱极性的干扰物;PSA主要去除极性物质、有机酸、碳水化合物及少量色素;GCB主要去除色素成分,但同时也对苯环官能团具有较强的吸附能力。因此本研究比较了PSA、C18以及PSA+C18组合对TBBPA和HBCD净化回收率的影响。结果表明,PSA和PSA+C18均能完全吸附TBBPA,C18对TBBPA的回收率则为(86.6±7.2)%。对于HBCD,使用PSA时,α-HBCD、β-HBCD和γ-HBCD的回收率分别为(84.9±2.8)%、(79.0±2.8)%和(78.4±0.83)%;使用PSA+C18时,各单体的回收率分别为(88.3±4.9)%、(79.8±2.6)%和(84.1±2.8)%;而使用C18时,各单体的回收率可达到80%~100%。综上,C18净化对TBBPA、α-HBCD、γ-HBCD的回收率显著高于PSA(p<0.5),而PSA对β-HBCD的回收率无显著影响。因此,本研究选用C18作为净化剂。
2.3.2C18用量的选择考察了C18用量(25、50、100 mg)对TBBPA和HBCD净化回收率的影响(图3)。结果显示,25、50、100 mg C18对TBBPA和HBCD各单体净化的回收率均可达到81%~116%;其中50 mg 和100 mg的C18对β-HBCD净化的回收率显著高于25 mg C18(p<0.05);而C18不同用量对TBBPA、α-HBCD和γ-HBCD的净化回收率则无显著差异(p>0.05);进一步增加C18用量对净化效果并无明显改善,因此本研究选用50 mg C18进行净化。
2.3.3与GPC净化方法的比较对比了QuEChERS法和GPC法对样品中TBBPA和HBCD的净化效果。GPC法参照文献[25-27]方法并做了优化:先将GPC柱中溶剂放出至填料露出液面,上样后用70mL正己烷-二氯甲烷(1 ∶ 1)淋洗,最后用50 mL正己烷-二氯甲烷(1 ∶ 1)洗脱。结果表明,采用QuEChERS法对TBBPA的回收率为(118±7.5)%,GPC法的回收率为(110±11.2)%;对于HBCD各单体,QuEChERS法的回收率为(102±1.6)%~(120±2.3)%,GPC法则为(113±10.6)%~(123±12.5)%。两种方法无显著差异(p>0.05),但由于GPC法涉及样品转移、旋蒸浓缩、氮吹浓缩等步骤,过程相对繁琐,因此本研究选择QuEChERS方法净化。
2.4 基质效应评价
基质效应(Matrix effect,ME)可通过ME=(基质标准溶液所作曲线的斜率/无基质标准溶液所作曲线的斜率-1)×100% 进行评价,ME为负值表示存在基质抑制效应,正值表示存在基质增强效应,其绝对值越大则基质效应越强[20-21,24,28]。当|ME|<20% 时,为弱基质效应,可忽略;20%≤|ME|≤50% 时,为中等程度基质效应;|ME|>50% 时,为强基质效应,需对基质效应进行补偿[29]。本研究采用空白鱼肉样品制备的萃取液和乙腈溶剂分别配制待测物的基质匹配标准曲线和无基质匹配的标准曲线,质量浓度分别为0.5、1、5、25、50、100、200、300、500 μg/L,用于评价本方法的基质效应。结果显示,TBBPA、α-HBCD、β-HBCD和γ-HBCD的ME分别为-0.30%、-34.5%、-2.17%和-7.37%,表现为弱到中等的基质抑制效应。因此,本研究采用基质匹配标准曲线,以降低基质效应的影响。
2.5 线性范围、检出限与定量下限
在优化实验条件下,用空白鱼肉样品提取液配成0.5、1、5、25、50、100、200、300、500 μg/L的基质匹配标准溶液,采用本方法进行分析,以目标物的质量浓度(X,μg /L)为横坐标,相应的峰面积与对应内标峰面积的比值(Y)为纵坐标绘制基质匹配标准曲线。结果显示,TBBPA和HBCD各单体在0.5~500 μg/L范围内呈良好的线性关系(r>0.998)。分别以目标物母离子的3倍信噪比(S/N=3)和10倍信噪比(S/N=10)确定方法检出限(LOD)和定量下限(LOQ),得到TBBPA、α-HBCD、β-HBCD和γ-HBCD的LOD分别为0.08、0.07、0.04、0.16 μg/kg;LOQ分别为0.25、0.25、0.12、0.55 μg/kg。
2.6 回收率与相对标准偏差
选用鱼、虾和贝肉3种空白样品,对TBBPA和HBCD进行加标回收试验,加标水平为5、20、50 μg/kg,每个加标水平重复测定6次,采用内标法定量。结果表明,TBBPA和HBCD的回收率为74.0%~121%,相对标准偏差(RSD)为 0.20%~23%(表2)。

表2 TBBPA和HBCD的回收率及相对标准偏差(n=6)Table 2 Average recoveries and relative standard deviations of TBBPA and HBCD(n=6)
2.7 实际样品的测定
采用该方法对清远采集的鲤鱼、日本沼虾和田螺3种淡水生物体中TBBPA和HBCD含量进行分析(表3)。结果表明,上述样品中TBBPA的含量为26.0~370 ng/g(干重,下同),α-、β-和γ-HBCD的含量分别为8.64~38.3 ng/g、2.01~22.9 ng/g和3.70~16.2 ng/g。
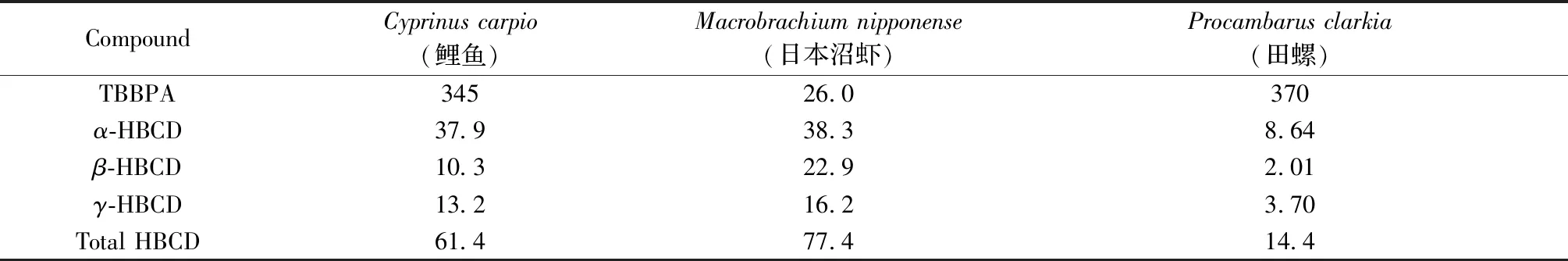
表3 实际样品中TBBPA和HBCD的分析结果(ng/g,干重)Table 3 Contents of TBBPA and HBCD in real samples(ng/g dry weight)
3 结 论
本文建立了快速分析水产品中TBBPA和HBCD含量的QuEChERS/UPLC-MS/MS方法,检出限为 0.04~0.16 μg/kg,定量下限为0.12~0.55 μg/kg,实际样品的加标回收率为74.0%~121%,RSD为 0.20%~23%。该方法简便、快速、灵敏度高,可满足批量水产品中TBBPA和HBCD的定量分析需求。
