碘普罗胺对HK⁃2 细胞凋亡及对Klotho/Wnt/β⁃catenin信号通路的影响
2019-04-02陈燕玲罗婷高昕乐许志威凡栋吴秀香靳俊峰王智赵晓朵庄晓东
陈燕玲 罗婷 高昕乐 许志威 凡栋 吴秀香 靳俊峰 王智赵晓朵 庄晓东
1遵义医科大学珠海校区病理生理学教研室(广东珠海519041);2中山大学北校区中山医学院(广州510080);3遵义医科大学珠海校区病理学教研室(广东珠海519041);4中山大学附属第一医院心血管内科(广州510080)
造影剂肾病是指静脉注射造影剂后48~72 h内出现血清肌酐值升高≥0.5 mg/dL 或血清肌酐水平相对升高≥25%,并且排除其他原因引起的急性肾功能损伤[1]。造影剂肾病是医源性急性肾功能损伤的第三大主因,虽然随着含碘造影剂安全性的改进以及采取水化、抗氧化剂等预防措施后,造影剂肾病的发生率已经有所下降。但由于依赖造影剂的诊疗操作不断增加,其潜在的危害仍不容忽视。关于造影剂肾病的发病机制目前尚未完全阐明,但是很多学者认为造影剂肾病的发生与造影剂对肾小管细胞的直接和间接毒性作用有关[2]。造影剂可诱导肾小管上皮细胞损伤及凋亡,但具体的信号通路还不是十分清楚。本实验以HK⁃2 细胞作为研究对象,观察碘普罗胺对HK⁃2细胞凋亡及Klotho/ Wnt/β⁃catenin 信号通路的影响,探讨造影剂引起肾小管上皮细胞凋亡的可能机制,为临床治疗造影剂肾病提供新的思路。
1 材料与方法
1.1 细胞及主要试剂来源 HK⁃2 细胞株由中山大学王蔚东教授提供;胎牛血清、碘普罗胺(碘浓度为370 mgI/mL)、DAPI、CCK⁃8 检测试剂盒分别购自美国Gibco 公司、拜耳医药保健有限公司、美国Sigma公司及日本同仁化学研究所;一抗:Bax、Bcl⁃2、Cleaved⁃caspase⁃3、Wnt、p⁃β⁃catenin、β⁃catenin、GAPDH 及辣根过氧化物标记山羊抗兔Ⅱ抗均为美国Cell Signaling Technology 公司产品。Klotho 一抗为上海Absin 公司产品。
1.2 细胞培养及分组 HK⁃2 细胞用DMEM/F12培养基(内含10%胎牛血清)培养,置于37 ℃、5%CO2及饱和湿度的恒温培养箱中培养。隔天传代一次,取处于对数生长期并且状态良好的细胞进行后续实验。实验分为五组,分别为正常对照组、37、74、111 及148 mgI/mL 碘普罗胺组。浓度梯度设置参考以往的文献报道[3]。
1.3 CCK⁃8 细胞活力的检测 取对数生长期的HK⁃2 细胞接种于96 孔板,对照组加入正常培养基培养,各碘普罗胺处理组分别给予不同浓度的碘普罗胺(37、74、111、148 mgI/mL)处理,同时设置空白组(在96孔板中直接加入培养基),每组设置5个复孔,药物处理24 h 后弃培养基,每孔加入100 μL 内含10%CCK⁃8的无血清培养基,于37 ℃培养箱中孵育1.5 h,酶标仪检测各样品在450 nm处的吸光度值(OD值)。细胞存活率=(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.4 DAPI 染色观察细胞核形态 将HK⁃2 细胞按照3×107个/L 的密度均匀接种于6 孔培养板内,按照上述实验分组加入不同浓度的碘普罗胺处理24 h 后,吸出培养基,每孔加入1 mL 4%多聚甲醛进行固定,固定10 min 后,PBS 洗3 次,每孔加入1 mL 浓度为1 μg/L 的DAPI 染色液,37 ℃避光孵育20 min 后,吸出DAPI 染色液,PBS 洗3 次,用日本奥林巴斯公司的荧光显微镜观察并拍照,每组随机选取五张照片,计算各组细胞的凋亡率。
1.5 Western Blot法检测HK⁃2细胞中Bax、Bcl⁃2、Cleaved⁃caspase⁃3、Klotho、Wnt、p⁃β⁃catenin、β⁃catenin 蛋白表达水平 HK⁃2 细胞经不同浓度的碘普罗胺处理24 h 后倒掉培养液,用预冷的PBS洗3 遍,尽量吸走残余的PBS,每皿加入200 μL 混有PMSF 的RIPA 细胞裂解液(强)提取细胞总蛋白(RIPA 裂解液与PMSF 的比例为1∶1 000),冰上裂解20 min,然后将蛋白收集到1.5 mL 的EP 管中,13 255 g 离心10 min 后取上清,BCA 蛋白定量试剂盒测定蛋白浓度后,每组取60 μg 蛋白,加入上样缓冲液混匀(蛋白与上样缓冲液体积之比为1∶4),100 ℃加热5 min,进行SDS⁃PAGE 电泳。电泳条件:前30 min,80 V 恒压,后60 min,100 V 恒压。转膜条件:200 mA 恒流,60 min(Klotho 蛋白转膜时间为150 min,β⁃catenin 蛋白转膜时间为120 min)。转膜完毕后,在室温下用5%TBST 脱脂奶粉溶液将转膜后的PVDF 膜封闭60 min。然后加入一抗,Bax、Bcl⁃2、Cleaved⁃caspase⁃3、Klotho、Wnt、p⁃β⁃catenin、β⁃catenin、GAPDH 一抗滴度均为1∶1 000,4 ℃冰箱内孵育过夜。一抗孵育完毕后,TBST 洗膜3 次,每次10 min,加入二抗室温孵育60 min,TBST 洗膜3 次,每次10 min,二抗滴度为1∶5 000。在暗室中加入ECL 发光液胶片显影或使用美国Analytik Jena 公司的成像仪扫描目的条带,再用ImageJ 软件对条带灰度值进行半定量分析,并与同组GAPDH 条带的灰度值相比,确定各组之间的差异。
1.6 统计学方法 正态分布的计量资料以均数±标准差表示,用SPSS 20.0 软件对数据进行分析,组间比较采用单因素方差分析(one⁃way ANOVA),组间均数比较采用LSD⁃t法,以P<0.05 为差异具有统计学意义。
2 结果
2.1 碘普罗胺对HK⁃2 细胞存活率的影响 为检测碘普罗胺对HK⁃2 细胞增殖的影响,本研究设置37、74、111、148 mgI/mL 不同浓度的碘普罗胺处理组,以CCK⁃8 法检测HK⁃2 细胞的存活率。结果显示,对照组及37、74、111、148 mgI/mL 碘普罗胺处理组细胞存活率分别为(100 ± 2.17)%、(93.61 ±1.89)%、(74.65 ± 3.36)%、(65.22 ± 2.36)%、(48.97± 2.73)%。不同浓度的碘普罗胺处理组细胞存活率均较对照组降低,且差异具有统计学意义(P<0.05),见图1。
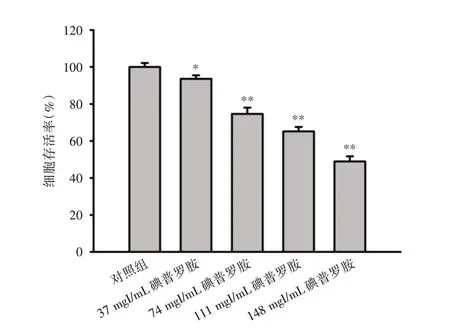
图1 碘普罗胺对HK⁃2 细胞细胞活力的影响Fig.1 Effect of iopromide on cell viability of HK⁃2 cells
2.2 碘普罗胺对HK⁃2 细胞凋亡率的影响 DAPI染色后于荧光显微镜下观察,可见碘普罗胺处理组的部分细胞细胞核密度明显增高,出现明显的核固缩或核分裂等凋亡特征,见图2。并且经统计发现,对照组细胞凋亡率为(1.78 ± 0.10)%,碘普罗胺处理组细胞凋亡率分别为(7.32 ± 2.34)%、(9.18±2.10)%、(14.19±2.39)%、(20.68±4.69)%,碘普罗胺处理组细胞凋亡率均比对照组升高(P<0.05),见图3。
2.3 碘普罗胺对HK⁃2 细胞Bcl⁃2 及Bax 蛋白表达的影响 与对照组相比,37mgI/mL 碘普罗胺组Bax/Bcl⁃2 比值虽然较对照组增高,但差异无统计学意义。其余浓度的碘普罗胺组Bax/Bcl⁃2 比值均较对照组升高,且差异具有统计学意义(P<0.05),见图4。

图2 显微镜观察各组细胞细胞核形态的变化(×400)Fig.2 The changes in nuclear morphology of cells in each group observed by Microscopic(×400)

图3 碘普罗胺对HK⁃2 细胞凋亡率的影响Fig.3 Effect of iopromide on the apoptosis rate of HK⁃2 cells
2.4 碘普罗胺对HK⁃2 细胞Cleaved⁃caspase⁃3 蛋白表达的影响 与对照组相比,不同浓度的碘普罗胺处理24 h 后,Cleaved⁃caspase⁃3 蛋白表达均明显增高,且差异具有统计学意义(P<0.05),见图5。
2.5 碘普罗胺对HK⁃2 细胞Klotho/Wnt/β⁃catenin信号通路蛋白表达的影响 与对照组相比,HK⁃2细胞经不同浓度的碘普罗胺处理24 后,Klotho 表达水平均降低,而Wnt、p⁃β⁃catenin 及β⁃catenin 蛋白表达水平均较对照组升高,且差异具有统计学意义(P<0.05),见图6。

图4 碘普罗胺对HK⁃2 细胞Bcl⁃2 及Bax 蛋白表达水平的影响Fig.4 Effect of iopromide on the expression of Bcl⁃2 and Bax in HK⁃2 cells

图5 碘普罗胺对HK⁃2 细胞Cleaved⁃caspase⁃3 蛋白表达水平的影响Fig.5 Effect of iopromide on the expression of Cleaved⁃caspase⁃3 in HK⁃2 cells
2.6 NAC 对碘普罗胺诱导的HK⁃2 细胞Klotho/Wnt/β⁃catenin 信号通路蛋白表达的影响 与对照组相比,111 mgI/mL 碘普罗胺处理24 h 后,Klotho表达水平明显降低,Wnt、p⁃β⁃catenin 及β⁃catenin蛋白表达水平明显升高,而加入不同浓度的NAC后可以逆转碘普罗胺对Klotho/Wnt/β⁃catenin 信号通路蛋白表达的影响(P<0.05),见图7。
3 讨论
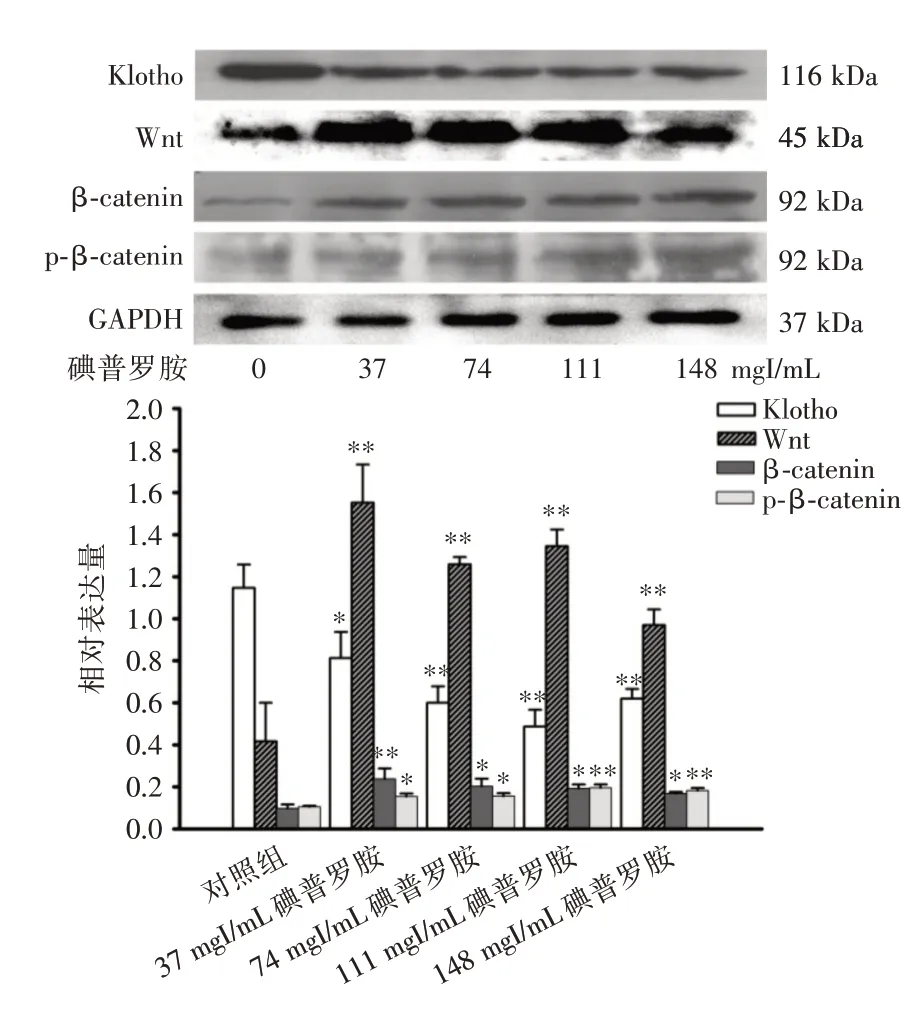
图6 碘普罗胺对HK⁃2 细胞Klotho/Wnt/p⁃β⁃catenin 及β⁃catenin 蛋白表达水平的影响Fig.6 Effect of iopromide on the expression of Klotho/Wnt/p⁃β⁃catenin and β⁃catenin in HK⁃2 cells
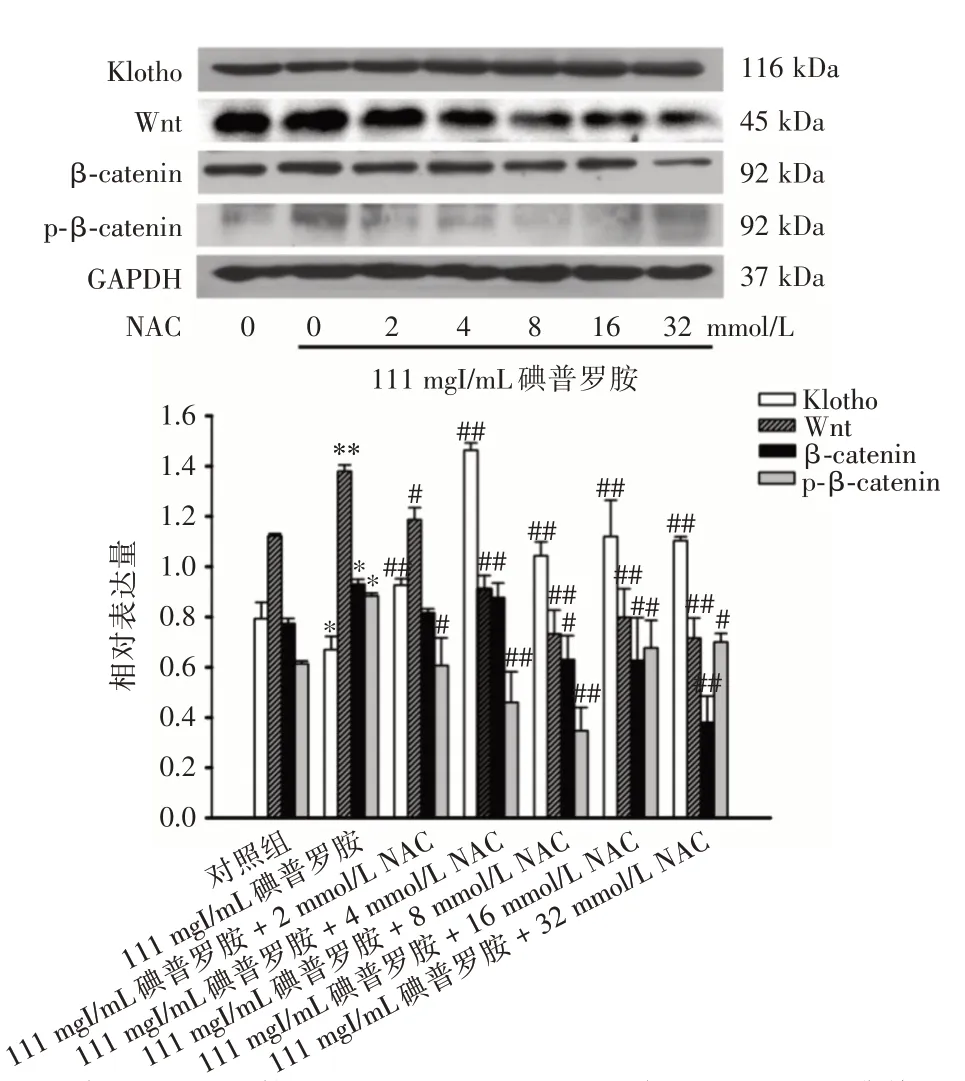
图7 NAC 对碘普罗胺诱导的HK⁃2 细胞Klotho/Wnt/p⁃β⁃catenin 及β⁃catenin 蛋白表达水平的影响Fig.7 Effect of NAC on the expression of Klotho/Wnt/p⁃β⁃catenin and β⁃catenin in HK⁃2 cells induced by iopromide
肾小管上皮细胞损伤是造影剂肾病发生的主要机制之一。在本实验中,HK⁃2 细胞经不同浓度的碘普罗胺处理后,细胞活力明显降低,细胞凋亡率明显增高,说明碘普罗胺可诱导肾小管上皮细胞损伤。
Bcl⁃2家族及Caspase家族在细胞凋亡中具有重要作用。Bax蛋白表达上调或Bcl⁃2蛋白表达下调,导致Bax 与Bcl⁃2两者之间的比例增高,可促进细胞凋亡的发生。Caspase⁃3作为执行凋亡的重要蛋白,当其受到凋亡信号刺激时,可剪切为活化形式的Cleaved⁃caspase⁃3,Caspase⁃3 的激活可致细胞DNA断裂,促进细胞凋亡[4]。本实验中,HK⁃2 细胞经不同浓度的碘普罗胺处理后,Bax/Bcl⁃2 比值上调,Cleaved⁃caspase⁃3表达增高,细胞凋亡率明显增加,说明碘普罗胺可诱导肾小管上皮细胞凋亡。
Klotho(编码基因为KL)是一种与衰老相关的基因[5]。人类Klotho 基因编码的蛋白包括膜型和分泌型Klotho 蛋白两种形式,其中膜型Klotho 蛋白主要在肾脏表达[6]。近年来,研究[7]发现Klotho 蛋白的水平与肾功能密切相关。在肾脏出现功能障碍的早期,Klotho 蛋白的表达即开始发生变化。研究报道,在缺血再灌注损伤所导致的急性肾损伤模型小鼠中,再灌注3 h 后血浆及肾脏的Klotho 蛋白表达开始持续降低,而5 h 后血浆中的中性粒细胞明胶酶相关脂质运载蛋白、血肌酐才会出现轻度升高[8]。慢性肾脏病患者血清Klotho 水平随肾功能下降而降低[9]。Klotho 蛋白还与细胞凋亡密切相关,通过转基因使人脐静脉内皮细胞过表达Klotho 蛋白后,内皮细胞内过氧化物的生成及脂质过氧化产物减少,细胞线粒体内MnSOD 水平升高,Caspase⁃3、Caspase⁃9 的活性降低,P53、P21 的表达下调,细胞凋亡数目减少[10]。
Wnt/β⁃catenin 信号通路广泛存在于多细胞真核生物中,在胚胎发育过程中起重要作用,与肾脏疾病的发生密切相关。在单侧输尿管结扎及阿霉素诱导的慢性肾脏疾病模型小鼠中,研究发现TGF⁃β1 可以抑制Klotho 的表达,Klotho 的表达缺失,继而激活β⁃catenin,最终导致肾脏损伤,Klotho可能是Wnt/β⁃catenin 内源性的拮抗剂[11]。Wnt/β⁃catenin 信号通路的激活可以促进细胞凋亡的发生,而阻断Wnt/β⁃catenin 信号通路可减轻肾缺血再灌注所致慢性肾间质纤维化[12-13]。本实验结果显示,加入不同浓度的碘普罗胺处理后,HK⁃2 细胞Klotho 蛋白表达水平均明显降低,Wnt、p⁃β⁃catenin及β⁃catenin 蛋白表达水平明显升高,而加入临床上常用的具有防治造影剂肾病作用的NAC后,可以逆转碘普罗胺的上述效应[14-15]。笔者分析Klotho/Wnt/β⁃catenin 通路在碘普罗胺诱导的肾小管上皮细胞凋亡中具有重要作用,碘普罗胺可能通过抑制Klotho 蛋白表达,进而激活Wnt/β⁃catenin 信号通路,使Bax、Cleaved⁃caspase⁃3 表达上调,Bcl⁃2 表达下调,继而诱导肾小管上皮细胞发生凋亡。
综上所述,碘普罗胺可诱导肾小管上皮细胞发生凋亡,其机制可能与其下调Klotho 蛋白表达,激活Wnt/β⁃catenin 信号通路有关。
