丝/苏氨酸蛋白激酶DNA 甲基化在同型半胱氨酸致血管内皮细胞凋亡中的作用
2019-04-02车双双徐华郭伟孙磊张鸣号杨晓玲姜怡邓刘志宏
车双双 徐华 郭伟 孙磊 张鸣号 杨晓玲 姜怡邓 刘志宏
宁夏医科大学1公共卫生与管理学院,3基础医学院(银川750004);2宁夏血管损伤与修复研究重点实验室(银川750004)
丝/苏氨酸蛋白激酶(mammalian sterile 20⁃like kinase 1,MST1)是酵母Ste20 的哺乳动物同源物,具有高度的保守性。研究表明,MST1 可以在多种促凋亡刺激如十字孢碱、紫外线、血清饥饿以及抗肿瘤的药物等情况下激活,引起下游信号分子活化,进而导致细胞凋亡[1],但有关其在人脐静脉血管内皮细胞(HUVECs)中的功能研究报道甚少。同型半胱氨酸(homocysteine,Hcy)是甲硫氨酸代谢的中间产物,在体内参与一碳单位的转移。循证医学证据显示高同型半胱氨酸血症是动脉粥样硬化(atherosclerosis,As)的独立危险因子[2]。近年来,基础研究证实Hcy 可以损伤血管HUVECs 功能,加速动脉粥样硬化的发生和发展[3]。Hcy 通过甲硫氨酸循环影响基因DNA 甲基化水平参与疾病的发生,并已有文献报道DNA 甲基化在Hcy 引起As 中起到重要作用[4]。但其是否影响MST1 的启动子区甲基化水平,进而影响其表达变化目前仍不清楚。因此,本研究主要探讨MST1 在Hcy 致HUVECs 损伤中的作用及其启动子区DNA 甲基化的调控机制,为防治As 提供全新的视角及实验依据。
1 材料与方法
1.1 主要实验仪器和试剂 人脐静脉内皮细胞株(HUVECs,中国科学院细胞生物学研究所,中国);超净工作台(苏州安泰,中国);CO2培养箱(Heraeus,德国);实时荧光定量PCR 仪(Bio⁃Rad,美国);电泳仪(Bio⁃Rad,美国);凝胶成像仪(Bio⁃Rad,美国);RPMI1640 培养基、胎牛血清(Gibco,美国);青链霉素(碧云天生物技术研究所,中国);Hcy(Sigma,美国);Annexin V⁃FITC/PI 细胞凋亡检测试剂盒(贝博公司,中国);总RNA 提取试剂盒(北京天根生物技术有限公司,中国);DNA 甲基化修饰试剂盒(ZYMORESEARCH,美国);逆转录和qRT⁃PCR 试剂盒(Thermo 公司,美国);蛋白提取试剂盒、蛋白定量试剂盒(南京凯基有限公司,中国);MST1 兔抗人、鼠一抗(Abcam 公司,美国),辣根过氧化物酶(HRP)标记的羊抗兔二抗(北京博奥森生物技术有限公司,中国);引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 细胞分组及处理 用含10%胎牛血清及1%双抗的RPMI1640 培养液,于37 ℃、含5%CO2的培养箱中培养HUVECs。当细胞密度达到85%左右时,将细胞分为正常对照组(Control)组、Hcy 组(在培养液中加入Hcy,使其终浓度为100 μmol/L),每组为3 瓶,48 h 后收集细胞,用于后续实验。
1.2.2 MTT 法检测HUVECs 的活性 取对数生长期的细胞,制成1×105个/mL 细胞的悬液接种于96 孔板中,培养24 h 后,各组分别加入相应药物孵育48 h,加入MTT继续培养4 h,吸弃液体,每孔加入150 μL DMSO 微量震荡10 min,于酶标仪上490 nm测定各孔OD值,通过与Control 组比较求出存活率。存活率(%)=实验组吸光度(A)值/Control 组吸光度(A)值×100%。
1.2.3 Hoechst染色法检测细胞凋亡 生长融合后,按实验分组并每组设3 个复孔,继续培养48 h;吸尽培养液,用PBS 洗3 次,每次5 min,加入250 μL预冷的4%多聚甲醛室温固定细胞20 min;用PBS洗涤3 次,每次5 min,吸尽液体;加入Hoechst 33258 染色液(2 μg/mL),室温避光孵育5 min;去染色液,PBS 洗3 次,每次5 min,在激光共聚焦显微镜下观察细胞核形态改变。
1.2.4 Western blot 检测MST1、DNMT1、Bcl⁃2 及BAX 蛋白表达 按照试剂盒说明书提取HUVECs的总蛋白,各组样本分别取30 μg 总蛋白,经SDS⁃PAGE 电泳、转膜、封闭2 h 后,与MST1、DNMT1、Bcl⁃2 及BAX 抗体均匀混合后4 ℃孵育过夜。PBST洗涤3 次,与辣根过氧化物酶标记的羊抗兔或鼠IgG 室温下孵育2 h,加入ECL 显色底物,凝胶成像分析仪上成像。设β⁃actin 为内参,计算目的基因与β⁃actin 灰度值的比值,并进行分析。
1.2.5 巢式降落式甲基化特异性PCR(nMS⁃PCR)检测MST1 启动子区DNA 甲基化 按DNA提取试剂盒说明书提取各组细胞全基因组DNA,检测OD260/OD280 值,分析全基因组DNA 样品纯度和浓度。亚硫酸盐修饰法对全基因组DNA 进行甲基化修饰。nMS⁃PCR 法检测MST1 启动子区DNA 甲基化改变。针对MST1 启动子区,设计外引物及两对内引物:外引物:上游5′⁃AAAAATCTAC⁃TCATCAAATAAATAACTAAA⁃3′,下游5′⁃TTGTTG⁃GATAGT ATAAAGGTAGAA⁃3′;甲基化引物:上游5′⁃CGTTTGGGAGTTTAAGGACG⁃3′,下游5′⁃TAAA⁃CCTAACGAATTCCGACT⁃3′;非甲基化引物:上游5′⁃TGTTTGGGAGTTTAAGGATGG⁃3′,下游5′⁃CTC⁃TAAACCTAACAAATTCCAACT⁃3′。扩增反应条件:95 ℃5 min,95 ℃30 s,65 ℃30 s,72 ℃30 s,20 个循环,每个循环降0.5~56 ℃,72 ℃7 min。以外引物的PCR 产物为模板,进行内引物的扩增,反应条件同外引物。取5 μL PCR 产物于2%的琼脂糖凝胶上电泳,用凝胶成像分析仪成像并分析甲基化条带及非甲基化条带的光密度,按如下公式进行结果的计算:非甲基化(%)=非甲基化(OD值)/[甲基化(OD值)+非甲基化(OD值)],每组实验重复3 次。
1.3 统计学方法 采用SPSS 20.0 统计软件进行统计学分析,计量资料以均数±标准差表示,两样本均数间比较采用两独立样本t检验,两个变量相关性分析采用Pearson 相关系数分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 Hcy 对HUVECs 存活率的影响 100 μmol/L Hcy 干预细胞48 h 后,MTT 法检测各组细胞存活率。结果显示:与Control 组比较,Hcy 组细胞增殖受到明显抑制,其细胞存活率明显降低,差异具有统计学意义(P<0.01),结果提示Hcy 对HUVECs生长有抑制作用,见图1。

图1 Hcy 对人脐静脉内皮细胞存活率的影响Fig.1 Effect of Hcy on survival rate of HUVECs
2.2 Hoechst 33258 染色观察HUVECs 核形态改变 细胞经DNA荧光染料Hoechst 33258染色5 min后,于共聚焦显微镜下观察细胞核形态改变。结果发现:Control 组细胞核大小均一、核圆且规整,核膜光滑无皱缩;Hcy 组细胞核与细胞质边界模糊,胞核固缩,大小不一,呈现不规则形状改变,见图2。
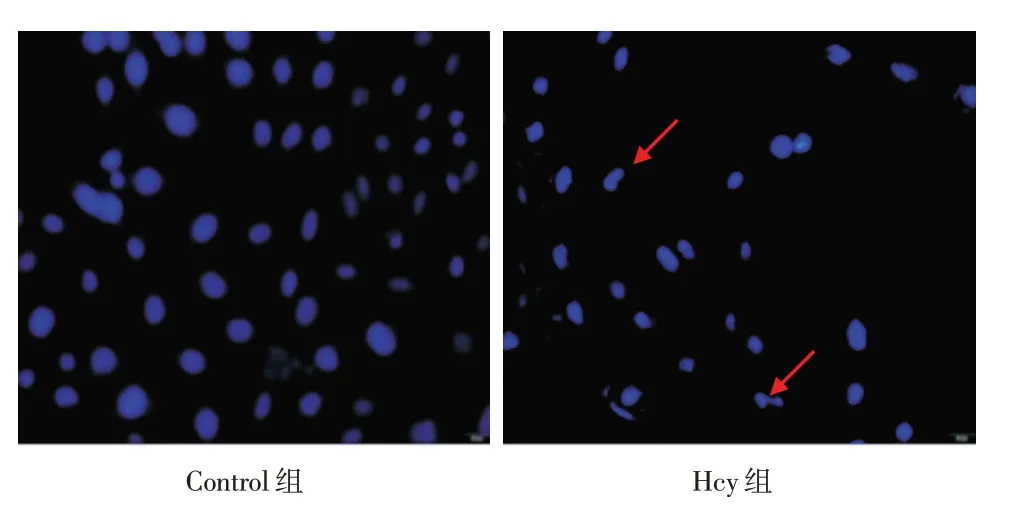
图2 各组核形态通过Hoechst 33258 染色检测(×400)Fig.2 Nuclear morphology stained by Hoechst 33258 staining in each group
2.3 Hcy 对HUVECs 中Bcl⁃2 和BAX 表达的影响 为了进一步明确Hcy 在HUVECs 凋亡中的作用,Western blot 检测了各组细胞中Bcl⁃2 和BAX 的蛋白表达水平(图3A)。与Control 组相比,Hcy 刺激后,Bcl⁃2 的蛋白表达降低了11.04%,差异有统计学意义(P<0.05),BAX 的蛋白表达增加了1.23倍,差异具有统计学意义(P<0.05),Bcl⁃2 与BAX的比率降低,差异具有统计学意义(P<0.05),提示Hcy 可能介导HUVECs 凋亡(图3B)。
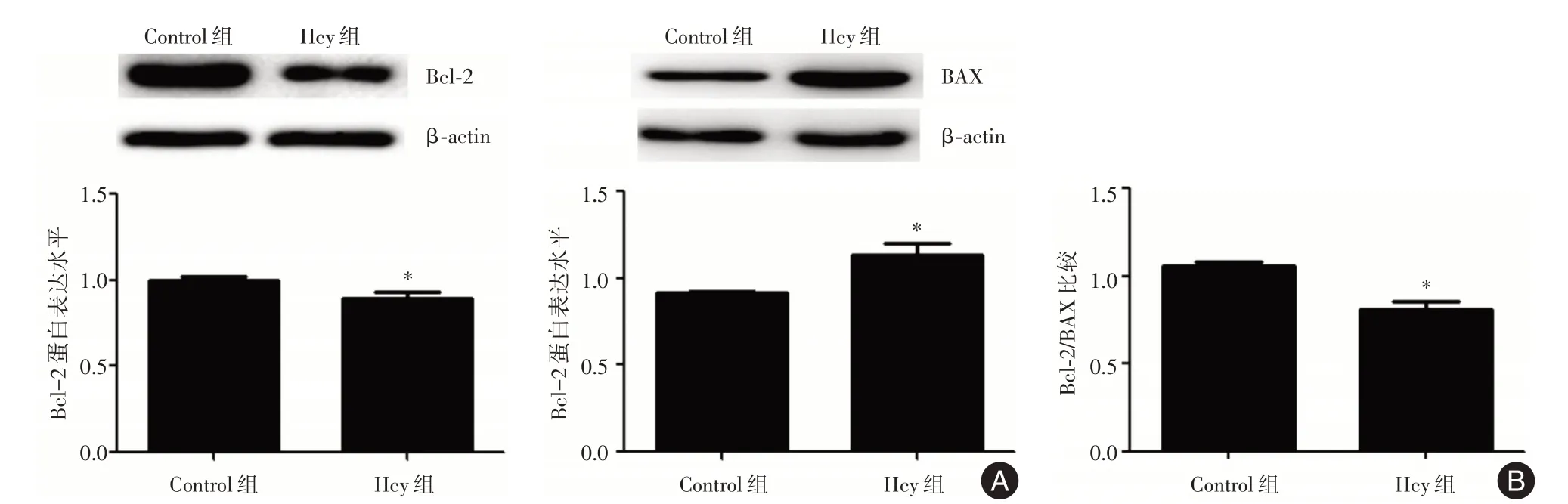
图3 HUVECs 中Bcl⁃2 和BAX 的蛋白表达Fig.3 The protein expression of Bcl⁃2 and BAX in HUVECs
2.4 Hcy 干预HUVECs 后MST1 的蛋白表达 为了探讨MST1 在Hcy 介导HUVECs 凋亡中的作用,Hcy 干预细胞后检测MST1 的表达。结果显示,与Control 组比较,Hcy 组MST1 蛋白表达水平为Con⁃trol 组的1.13 倍(P<0.01),表明MST1 的表达上调可能在高Hcy 介导HUVECs 凋亡中发挥着重要的作用,见图4。
2.5 HUVECs 中MST1 表达与Bcl⁃2/BAX 的相关性分析 为进一步验证MST1 与HUVECs 凋亡的相关性,将MST1 蛋白表达水平与Bcl⁃2/BAX 进行了相关性分析,结果显示:细胞MST1 表达水平与Bcl⁃2/BAX 呈负相关(r2=0.844 6,P<0.001),提示MST1 与HUVECs 凋亡密切相关,见图5。

图4 HUVECs 中Hcy 对MST1 蛋白表达的影响Fig.4 The effect of Hcy on the protein expression of Bcl⁃2 and BAX in HUVECs

图5 MST1 水平与Bcl⁃2/BAX 比值的相关性分析Fig.5 Analysis of correlation between MST1 protein levels and the ratio of Bcl⁃2/BAX
2.6 MST1 生物信息学分析 利用生物信息学软件MethPrimer 分析MST1 启动 子 区CpG 岛,选取MST1 基因上游2 500 bp 作为研究对象,发现MST1启动子区含有CPG岛,分别位于⁃1516/⁃1459、⁃1368/⁃871、⁃850/⁃682,提示MST1 基因很可能受到甲基化的调控,见图6。
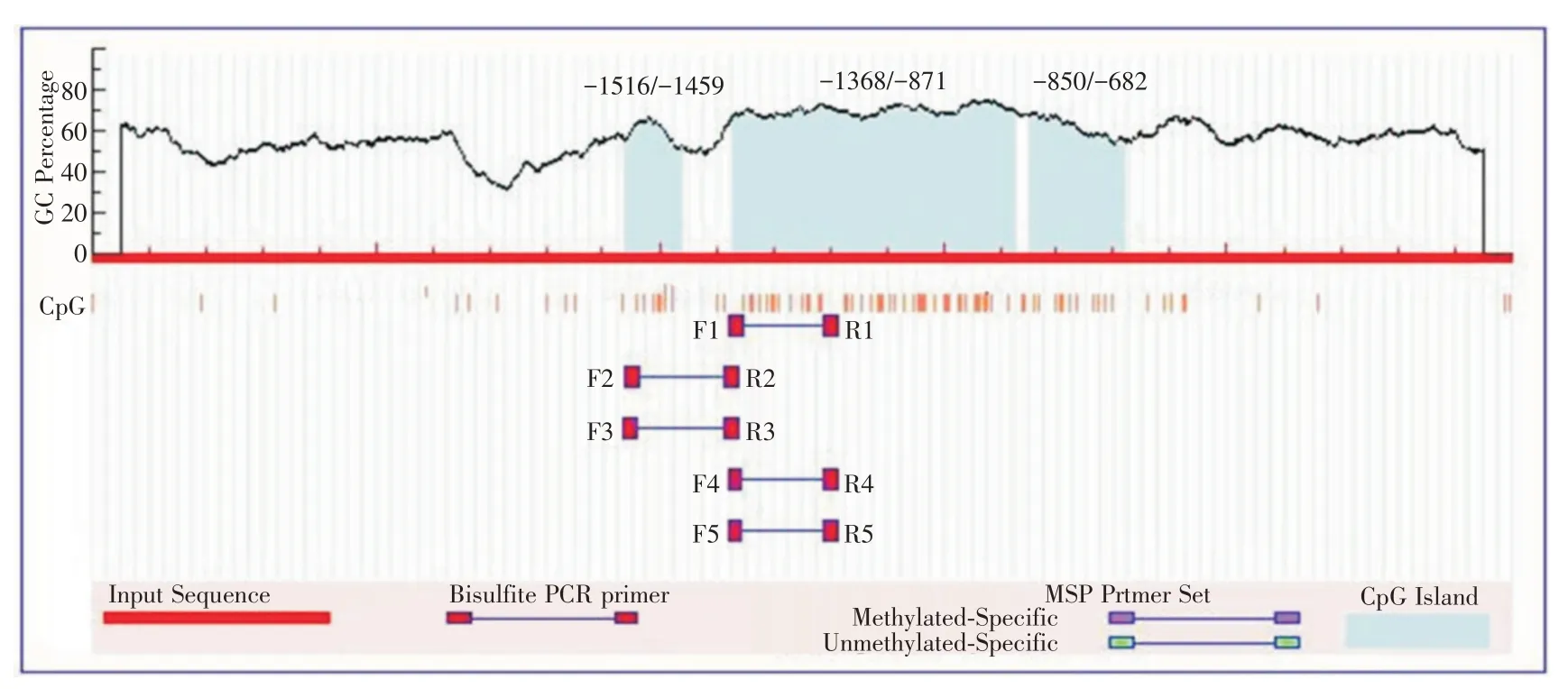
图6 MST1 启动子区的生物信息学分析Fig.6 Bioformatics analysis of MST1 promoter region
2.7 Hcy 对HUVECs 中MST1 启 动 子 区DNA 甲基化的影响 为探讨Hcy 致HUVECs 凋亡中调控MST1 表达的机制,Hcy 干预HUVECs 后nMS⁃PCR法检测MST1 启动子区DNA 甲基化水平。结果显示:与Control 组相比,Hcy 组MST1 DNA 甲基化水平明显降低18.39%,差异具有统计学意义(P<0.01),提示DNA 甲基化参与了MST1 的表达调控,见图7。
2.8 Hcy 干预后DNMT1 蛋白表达的改变 100 μmol/L Hcy 处理HUVECs 48 h 后,Western blot 检测了Control 组和Hcy 组中DNMT1 的蛋白表达。结果显示:Hcy 干预后,DNMT1 蛋白表达显著降低,差异具有统计学意义(P<0.01),提示DNMT1 可能在MST1 的表达调控中发挥重要作用,见图8。
3 讨论
动脉粥样硬化(As)是心脑血管疾病共同的病理基础,严重危害人类健康[5]。Hcy 是As 的独立危险因子。研究报道,Hcy 致As 的机制涉及内皮细胞损伤、VSMCs 增殖以及泡沫细胞的形成[6]。内皮细胞损伤是As 形成的早期始动环节,同时也是发生As 的必备条件。引起内皮功能损伤的因素众多,其中内皮细胞凋亡是重要因素之一[7]。因此,深入研究其功能的改变及机制,具有潜在的临床应用前景。
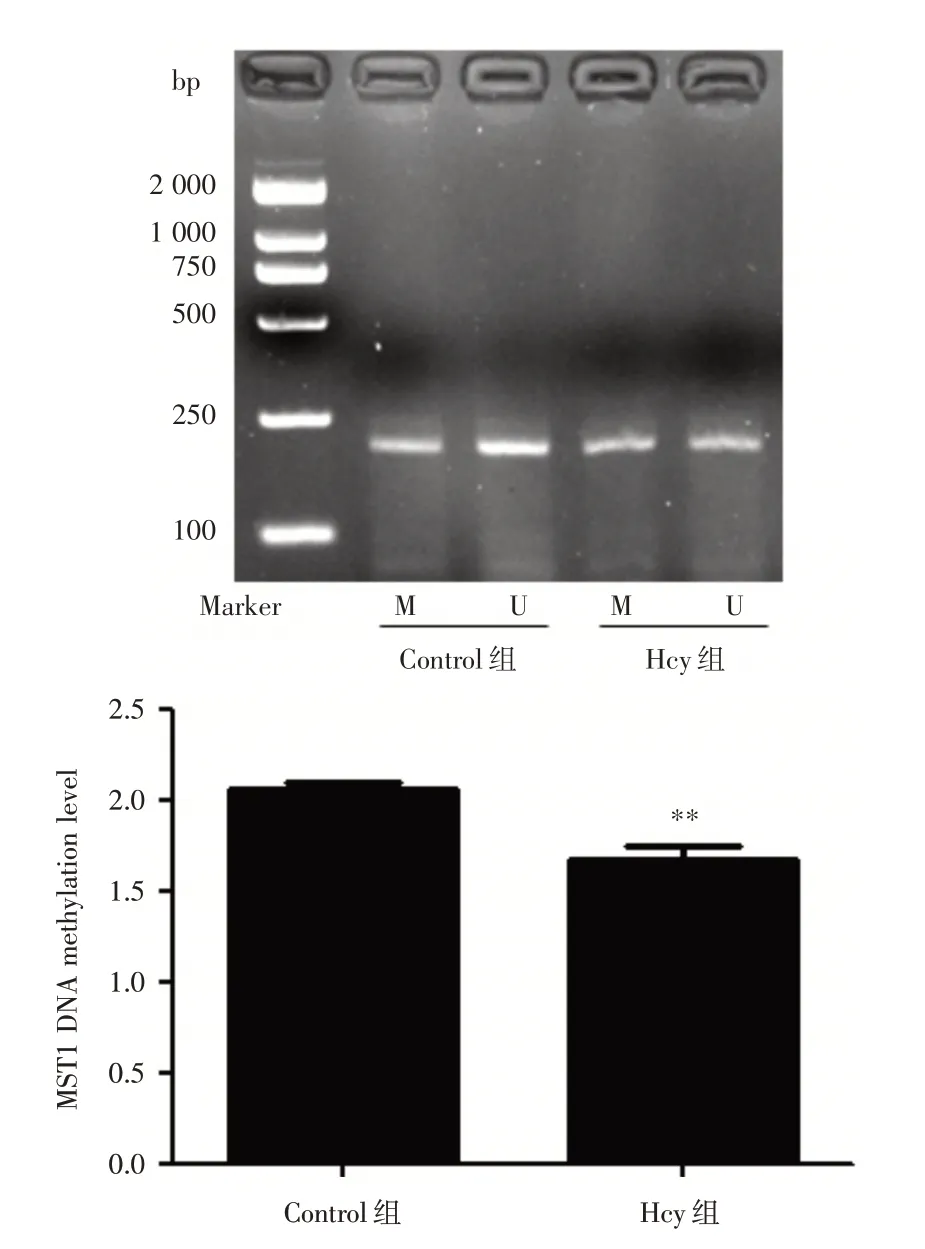
图7 在HUVECs 中Hcy 诱导MST1 甲基化水平改变Fig.7 Hcy induced change of MST1 DNA methylation level in HUVECs
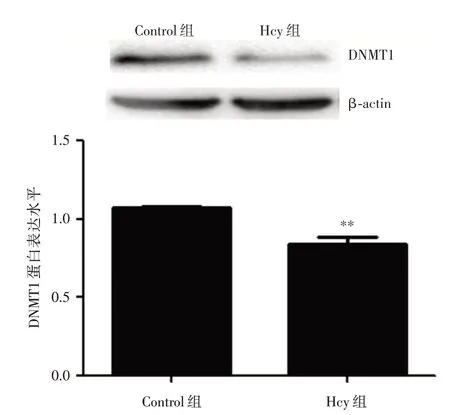
图8 HUVECs 中Hcy 对DNMT1 表达的影响Fig.8 The effect of Hcy on the expression of DNMT1 in HUVECs
本文在前期研究的基础上,筛选出100 μmol/L Hcy 的浓度对内皮细胞增殖抑制率明显升高[8],采用该浓度Hcy干预HUVECs 建立As体外实验模型,以观察Hcy 对HUVECs 凋亡的影响,并从内皮细胞凋亡的角度探讨Hcy 在As 中作用。实验中可观察到Hcy 能够使HUVECs 存活率降低,对HUVECs 损伤具有促进作用。采用Hoechst 33258 细胞核荧光染色和Western blot 技术进一步观察细胞的凋亡情况,结果发现:Control 组细胞核呈微弱均匀蓝色荧光;Hcy 组细胞核显示较深蓝色荧光状,可见核固缩、凋亡小体等典型的凋亡形态学特征。细胞凋亡是一系列基因活动引起的级联反应的结果,由诱导基因和抑制基因共同调控。Bcl⁃2 具有抗细胞凋亡的功能,它能通过抵抗多种形式的细胞凋亡延长细胞寿命。而BAX是Bcl⁃2的同源基因,其表达上调可拮抗Bcl⁃2 的保护效应使细胞趋于凋亡。细胞凋亡是否发生是由Bcl⁃2 和BAX 决定的[9]。Western blot 结果显示,与Control 组比较,加入Hcy后,Bcl⁃2 的蛋白表达显著降低,而Hcy 组中BAX的蛋白表达明显增高,以上结果提示:Hcy 能够诱导HUVECs 的凋亡。
MST1 是体内普遍表达的一种丝/苏氨酸蛋白激酶,主要参与细胞生长发育、细胞迁移和分化、增殖、凋亡以及器官大小等的调控[10]。有研究[11]表明,多种促凋亡刺激和细胞应激如紫外线照射、TNF⁃α 及抗肿瘤药物可激活MST1,引起下游信号分子活化,进一步导致细胞凋亡。张辉等[12]研究发现,MST1 基因在肾癌组织中表达明显下调,过表达MST1 后,可使肾癌凋亡明显升高;有学者的研究也发现,在稳定转染MST1 的HeLa 细胞中,可以加速caspase⁃3 的激活使得细胞对死亡受体介导的凋亡更敏感[2,13]。本研究结果发现,与Control 组比较,Hcy 组细胞中MST1 蛋白表达明显升高,与HUVECs 中Bcl⁃2 蛋白水平呈负相关,而与BAX 蛋白水平呈正相关,提示MST1 可能是促进HUVECs凋亡的重要调节因子。
Hcy 是一种含硫的非必需氨基酸,其作为甲硫氨酸代谢的中间产物,参与体内甲硫氨酸循环的关键环节,通过将甲基转移至DNA、蛋白质等物质发挥生物学效应[14]。DNA 甲基化是一种重要的表观遗传学修饰,以未改变核苷酸顺序及其组成的方式,影响DNA 构象稳定性,从而调控基因表达。一般情况下,DNA 甲基化诱导基因的表达沉默,而去甲基化则激活基因的表达[15]。前期研究发现,在As 中Hcy 参与多种基因甲基化修饰状态的改变。生物信息学分析发现MST1 启动子区富含CpG 位点,因此笔者推测,DNA 甲基化这一表观遗传学机制参与了Hcy 调控MST1 的表达进而促进HUVECs 凋亡,为了验证这一假设,本课题组进一步检测Hcy 干预后MST1 启动子区甲基化程度的改变。结果显示,Hcy 组细胞中MST1 启动子区DNA 甲基化程度明显降低,DNA 低甲基化作为基因转录增强的重要标志之一,与MST1 表达水平上调相一致。同时,本研究发现Hcy 干预后HUVECs中DNMT1 表达降低,其主要原因是DNA 甲基化主要是通过DNA 甲基转移酶家族(DNMTs)催化发生并维持的,而DNMT1 是哺乳动物体内含量最多的一种DNMTs[3,16],其表达降低,会导致DNA 低甲基化、基因的表达激活,从而诱导细胞的凋亡改变。
综上所述,本研究结果表明,Hcy 通过下调DNMT1 表达导致MST1 基因启动子区DNA 甲基化水平降低,进而引起MST1 的表达升高,促进HU⁃VECs 凋亡。因此,继续对MST1 在Hcy 诱导的HU⁃VECs 凋亡调控机制中的深入研究,将有望为防治As 找到新的靶点和方向。
