大黄游离蒽醌纳米乳的制备工艺及对白粉病和红蜘蛛的防治效果
2019-03-25李倩牛婧娥李金成郑果刘映前杨志刚张智军史彦斌
李倩,牛婧娥,李金成,郑果,刘映前,杨志刚,张智军,史彦斌
(1.兰州大学药学院,甘肃 兰州 730000;2.甘肃省农业科学院植物保护研究所,甘肃 兰州 730000)
大黄(Rhubarb)为蓼科植物掌叶大黄(RheumpalmatumL)、唐古特大黄(RheumtanguticumMaxim.ex Balf.)或药用大黄(Rheum officinale Baill.)的干燥根及根茎,广泛分布在我国陕西、甘肃、青海、四川等地[1].大黄的主要化学成分为蒽醌类化合物,此外还含有鞣质、多糖等.大黄蒽醌大部分与葡萄糖结合成苷,在酸溶液中加热水解使其转化为苷元,游离蒽醌(RhA)主要包括大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚(图1)[2-3].

芦荟大黄素 Aloe emodin(R1-CH2OH,R2-H);大黄酸 Rhein(R1-COOH,R2-H);大黄素 Emodin(R1-CH3;R2-OH);大黄酚 Chrysophanol(R1-CH3;R2-H);大黄素甲醚 Physcion(R1-CH3;R2-OCH3).图1 大黄游离蒽醌的化学结构Figure 1 The chemical structure of rhubarb free anthraquinones
本研究组采用酸水解,乙醇超声提取,再结合氯仿萃取、碱溶酸沉淀和甲醇溶解过程,可获得高纯度(> 96%)的大黄游离蒽醌,其中蒽醌含量占大黄粉末的(15.56±1.13) mg/g[4].,化学药剂是防治黄瓜等农作物白粉病的有效措施之一,但化学药剂长反复大量使用,植物病原菌就会对部分药剂产生不同程度的抗药性,从而使防效降低,且化学药剂可引起环境污染,危害人畜健康,因此人们开始倡导生物农药的研发和应用[5].近年来,文献报道大黄提取液或其蒽醌单体对黄瓜和小麦白粉病具有明显的防治效果,如杨宇红等报道了大黄素甲醚防治黄瓜白粉病的研究[6-8],任红敏报道了大黄酚对黄瓜白粉病的生物活性及内吸传导性研究[9],Yang等报道大黄酚和大黄素甲醚对白粉病的协同对抗作用,且随着大黄酚比例的增加,防效增强[11].本研究组在进行大黄游离蒽醌防治植物白粉病试验的同时,发现其对植物红蜘蛛也有很好的防效.考虑到大黄游离蒽醌的主成分均具有类似的蒽醌骨架,推测它们或具有不同程度的抗植物害虫作用,且因协同作用或可防止植物病虫的变异和耐药性的产生[6,10].
药物剂型对药物的防治效果可产生显著影响.文献报道的大黄游离蒽醌单体大黄素甲醚的试验剂型主要为水剂[5,11],因大黄素甲醚不溶于水,药物主要以混悬的固体粒子存在,喷雾时容易堵塞喷头.纳米乳由油相、乳化剂、助乳化剂和水组成的透明或半透明液体制剂,因其相对普通乳剂和微乳剂,乳滴粒径更小(约1~100 nm),能更有效地展布于植物叶表面以及促进药物渗入至植物叶茎内[12],更好地发挥药物的生物活性,且制备工艺简单、能与水以任意比例混合,不堵塞喷头,使用方便.近年来已有一些单体药物或植物提取物制成纳米乳用于植物病虫害的文献报道[13-14].截至目前,除了本课题组发表的文献[5]和报道的专利论文[15],尚未见将大黄游离蒽醌作为整体制成纳米乳剂防治植物病虫害的研究报道.现将大黄游离蒽醌纳米乳(RhA-NE)的制备及田间防治白粉病和红蜘蛛的效果在本文中一并报道.
1 材料与方法
1.1 仪器与试剂
Agilent 1260高效液相色谱仪(包括G1311B四元泵、G1316A柱温箱、G1329B自动进样器、G1315D二极管阵列检测器),美国安捷伦有限公司;HH-2数显恒温水浴锅,国华电器有限公司;ZEN 3600马尔文激光粒度仪,英国马尔文仪器有限公司;Sartorius CPA225D电子分析天平,赛多利斯(北京)科学仪器有限公司;NDJ-8S数控黏度计,上海上天精密仪器有限公司;UV-2501PC/2550紫外可见分光光度计,岛津(上海)国际贸易有限公司;JEM-1230透射电子显微镜,日本株式会社日立制作所(HITACHI);WD-A药物稳定性检查仪,天津药典标准仪器有限公司.
掌叶大黄(RheumpalmatumL.)块状根茎,来源:甘肃礼县,存样凭证:No.856002,鉴定人:李建银(兰州大学药学院生药学研究所).芦荟大黄素对照品(PubChem CID:10207,批号:110795)、大黄酸对照品(PubChem CID:10168,批号:110756)、大黄素对照品(PubChem CID:3220,批号:110757)、大黄酚对照品(PubChem CID:10208,批号:110796)和大黄素甲醚对照品(PubChem CID:10639,批号:110758)均购自中国药品生物制品检定所.15% 三唑酮可湿性粉剂(批号:20150504),江苏剑牌农化股份有限公司生产,0.05%生物苄呋菊酯乳液(批号:20150103),东阳联丰生物技术有限公司,100%三硅氧烷助剂(批号:14041),浙江世佳科技有限公司.丙二醇单辛酸酯(capryol 90,批号:146642)、二乙二醇单乙基醚(transcutol HP,批号:139125),嘉法狮(上海)/Gattefossé(Shanghai)贸易有限公司;聚氧乙烯-40-氢化蓖麻油(cremophor RH 40,批号:81088756p0),BASF公司;色谱纯甲醇,山东禹王实业有限公司;去离子水,杭州娃哈哈集团有限公司;油酸、油酸乙酯等,甘肃宜平实验室仪器测试技术服务有限公司.
1.2 大黄游离蒽醌的制备
掌叶大黄根茎粉碎,粉末与20%硫酸溶液按照1∶5(W/V)混合,70 ℃酸解,抽滤,滤渣水洗至中性后干燥.混合滤渣按照原生药计算与90%乙醇1∶30(W/V)比例混合,50 ℃条件下,70%功率超声提取20 min×3次,抽滤,滤液减压浓缩回收乙醇.残留水混悬液用氯仿萃取,有机层用5%氢氧化钠溶液萃取,加入浓盐酸调pH值至2.0,离心,沉淀用水洗至中性,真空干燥得粗提物.粗提物甲醇复溶,过滤,减压旋干得到大黄游离蒽醌提取物.高效液相色谱(HPLC)外标一点法定量分析.色谱条件为:色谱柱为Diamonsil-C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.1%磷酸(88∶12,V/V),流速1 mL/min,紫外检测波长254 nm,柱温40 ℃,进样体积:20 μL.分析结果显示,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚各占总游离蒽醌的质量百分比(%,W/W)分别为(11.26±1.04)(3.89±0.41)(7.52±0.70)(60.24±6.45)和(16.06±1.58)[5].
1.3 纳米乳的制备
按课题组之前大黄游离蒽醌的纯化工艺及优化的纳米乳处方和制备工艺,按滴定法制备纳米乳[5,17].准确称取大黄游离蒽醌样品(每毫升混合油相含大黄游离蒽醌5.1 mg),加入配方量的丙二醇单辛酸酯和油酸乙酯(3∶1,W/W,油相,占总质量的19.5%),超声溶解得含药油相;取配方量的聚氧乙烯氢化蓖麻油于35℃条件下加热融化,加入二乙二醇单乙基醚,于室温下搅拌均匀,得混合乳化剂(1∶1,W/W,混合乳化剂,42.50%).将1%油酸(稳定剂,1.5%)加入到混合油相中,搅拌混合5 min,加入混合乳化剂,搅拌混合15 min,然后逐滴加入配方量的蒸馏水(水相,36.5%),磁力搅拌10 min,即得大黄游离蒽醌纳米乳.
1.4 纳米乳的表征
通过马尔文激光粒度仪测定纳米乳的平均粒径(MDS)、多分散指数(PDI)和ξ电位.MDS和PDI的测定温度为25 ℃,波长为633 nm,散射角为173°.大黄游离蒽醌纳米乳样品用去离子水以1∶100(V/V)比例稀释,获得适当的液滴浓度,以避免多散射效应.使用数显粘度计测量大黄游离蒽醌纳米乳的粘度,紫外可见分光光度计分析透光率(T%),检测波长设定为700 nm.所有测量重复3次.
使用透射电子显微镜观察纳米乳的形态.纳米乳用蒸馏水以1∶100(V/V)比例稀释后,取1滴于碳涂覆的铜网上,然后用2.0% 磷钨酸染色,将涂覆的网格干燥,于显微镜下观察并拍照.
1.5 游离蒽醌的含量测定
准确称取5种大黄游离蒽醌对照品适量,溶于色谱级甲醇中,制备成对照品混合储备液,再经甲醇稀释后配制成系列对照品溶液,经HPLC分析,建立5种游离蒽醌的标准曲线.检测限(LOD)的计算方法为LOD= 3×SD×C/Am,定量限(LOQ)的计算方法为LOQ= 10×SD×C/Am,其中Am是连续进样10次试验样品峰面积的平均值,SD为连续进样10次峰面积的标准偏差,C为试验样品的真实浓度[4].取1 mL大黄游离蒽醌纳米乳置于10 mL容量瓶中,加入5 mL甲醇超声15 min,再加入甲醇定容至10 mL.平行制备三批样品溶液,经0.45 μm 有机微孔滤膜过滤后,HPLC法分析,代入对应的游离蒽醌标准曲线,计算大黄游离蒽醌纳米乳中各游离蒽醌的含量.色谱条件同上.
1.6 稳定性试验
酸碱稳定性:大黄游离蒽醌纳米乳的pH约为6.0,取适量分装于带塞玻璃试管中,分别用1.0 mol/L HCl或NaOH调pH值至5、7、9,石蜡膜密封,于强光下(4 500±500) lx放置24 h后,测定大黄游离蒽醌纳米乳的平均粒径、多分散指数、大黄游离蒽醌含量.
热稳定性:参考GB/T 19136-2003(农药热贮稳定性测定方法).量取约 30 mL试样置于带塞的玻璃试管中,石蜡膜密封,称质量,将此试管置于(54±2)℃的恒温箱中放置14 d.取出,将试管外面拭净后称量,质量未发生变化的试样,于24 h内完成对规定指标进行检查,检查指标同上.
光稳定性:因之前的预试验表明,大黄游离蒽醌纳米乳对光不稳定,故将其分装于带塞玻璃试管中,石蜡膜密封,外用黑色塑料袋包裹,避光贮存,于(4 500±500)lx 条件下放置10 d,分别于第5、10天,测定指标同上[17].
常温贮存稳定性:参考NY/T1427-2007(农药常温贮存稳定性试验通则)和《药剂学》稳定性试验方法[18].量取约 30 mL试样置于带塞的玻璃试管中,石蜡膜密封,外覆黑色塑料袋避光贮存,称重,将此试管置于(30±2)℃的恒温箱中放置,分别于第30、60、90天对规定指标进行检查,检查指标同上.
1.7 田间药效试验
1.7.1 大黄游离蒽醌纳米乳对白粉病的田间药效试验 试验地点选择在甘肃武威凉州区农户辣椒温室中进行.土壤质地为黄土,地势平坦,肥水条件良好.对照药剂采用15%三唑酮可湿性粉剂,是一种低毒、内吸性三唑类杀菌剂,可有效防治小麦的白粉病.另设大黄游离蒽醌纳米乳100、250和500倍液,15%三唑酮800倍液及空白对照5个处理组.试验前,每处理均加入三硅氧烷助剂适量(5 mL 三氧化二硅/15 kg 乳液),以增强叶面附着力.选择辣椒白粉病始发期进行试验,每处理4个重复,每处理小区喷40 m2(4沟),于喷药后第7天,每重复随机选定2株辣椒,调查选定的2株辣椒全部叶片,以每片叶上的病斑面积占整个叶面积的百分率来分级.分级标准如下:0级,无病斑;1级,病斑面积占整个叶面积5%以下;3级,病斑面积占整个叶面积6%~10%;5级,病斑面积占整个叶面积11%~20%;7级,病斑面积占整个叶面积21%~40%;9级,病斑面积占整个叶面积40%以上.
病情指数(%)=[Σ(各级病叶数×各级代表值)/(调查总叶数×5)]×100%
防治效果(%)=(1-处理区施药后病情指数/对照区施药后病情指数)×100%
1.7.2 大黄游离蒽醌纳米乳对红蜘蛛的田间药效试验 试验地点选择在甘肃兰州城关区农户茄子田间中进行.土壤质地为黄土,地势平坦,肥水条件良好.对照药剂采用0.05%生物苄呋菊酯乳液(商品名:花虫净),由原料,Span-30、Tween-80和蒸馏水按一定比例混合而成的乳液,可有效防治植物害虫.试药组设大黄游离蒽醌纳米乳100、250和500倍稀释液,0.05%生物苄呋菊酯乳液的800倍稀释液,用喷洒自来水为空白对照.试验前,每处理均加入三硅氧烷助剂适量(5 mL三氧化二硅/15 kg乳液),以增强叶面附着力.红蜘蛛发生期,每处理3个重复,每处理小区喷10 m2,喷药前每处理小区随机选定2株茄子,喷药前在每株不同部位各选红蜘蛛发生中等数量的2张完整叶片,挂标签并查数活动红蜘蛛数.喷药后第5天调查活动活动红蜘蛛数,计算虫口减退率和防治效果[19].
虫口减退率率(%)=(施药前活虫数-施药后活虫数)×100%/施药前活虫数
防治效果(%)=(处理区虫口减退率-对照区虫口减退率)×100%/(1-对照区虫口减退率)
1.8 数据统计

2 结果与分析
2.1 纳米乳的一般性质
大黄游离蒽醌纳米乳的MDS为(25.37±0.55)nm,PDI为(0.136±0.012),ξ电位为(-17.6±1.0) mV,pH值为(5.95±0.09),粘度值为(73.3±1.4)cP,在波长700 nm的纳米乳T %为(88.1±1.9)%.大黄游离蒽醌纳米乳的粒径分布如图2所示.
大黄游离蒽醌纳米乳在自然光下观察,澄清透明均一,外观呈橙黄色.透射电镜下观察,形态呈圆球形,粒径小于50 nm,粒度分布均匀(图3).

图2 大黄游离蒽醌纳米乳的粒径分布图Figure 2 Size distribution of RhA-NE
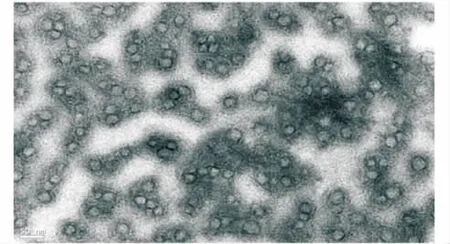
图3 大黄游离蒽醌纳米乳的透射电镜图(50 000×)Figure 3 Transmission electron microscopy of RhA-NE (50 000×)
2.2 大黄游离蒽醌的含量
空白纳米乳与大黄游离蒽醌纳米乳的色谱图如图4所示.芦荟大黄素色谱峰的保留时间(TR)为(5.16±0.26) min,大黄酸、大黄素、大黄酚和大黄素甲醚的色谱峰TR分别为(6.42±0.35)(8.85±0.38)(11.24±0.43)(15.04±0.52) min.对比分析可知,纳米乳辅料对大黄游离蒽醌的定量分析无干扰.

A:空白纳米乳;B:载药纳米乳.A:Blank nanoemulsion;B:Drug loaded nanoemulsion.图4 大黄游离蒽醌纳米乳供试液的高效液相色谱图Figure 4 HPLC chromatogram of RhA-NE
5种大黄游离蒽醌的标准曲线(y代表峰面积,x代表对照液浓度)的相关系数均大于0.999,线性范围介于(0.122~21.20) μg/mL,LOD介于(0.025~0.055) μg/mL,LOQ介于(0.084~0.177) μg/mL(表1).
纳米乳中大黄游离总蒽醌的含量为(962.54±25.13)μg/mL,其中芦荟大黄素浓度为(106.86±6.80)g/mL,大黄酸浓度为(59.43±3.22)g/mL,大黄素浓度为(70.72±5.21)g/mL,大黄酚浓度为(532.66±17.32)g/mL,大黄素甲醚浓度为(192.86±13.02)g/mL.

表1 大黄游离蒽醌高效液相色谱法定量的线性、最低检测限和最低定量限
2.3 稳定性
大黄游离蒽醌纳米乳在pH值分别为5、7、9条件下于强光放置24 h,其MDS和PDI值变化见表2.在pH 5.0条件下,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量分别下降约2.7%,2.5%,2.4%,2.4%,0.0%;在pH 7.0条件下,分别比试验前下降约4.8%,7.8%,6.7%,3.1%,4.8%;在pH 9.0条件下,分别下降约9.6%,12.0%,10.4%,8.3%,11.0%.提示大黄游离蒽醌在酸性环境下稳定,碱性环境下不稳定.
密封于带塞玻璃管中的大黄游离蒽醌纳米乳于54 ℃放置14 d后,颜色稍有加深,MDS及PDI变化如表3示.芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量分别下降约7.8%,8.9%,9.6%,4.8%,2.7%.提示密封包装于带塞玻璃管中的大黄游离蒽醌MDS有增大趋势,游离蒽醌含量有下降趋势.

表2 大黄游离蒽醌纳米乳在不同pH条件下的MDS和PDI值(n=3)

表3 大黄游离蒽醌纳米乳在高温和强光下的MDS和PDI值(n=3)
密封于避光带塞玻璃管中的大黄游离蒽醌纳米乳于(4 500±500) lx 条件下放置10 d后,颜色稍有加深,MDS及PDI变化如表3所示,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量分别下降约3.5%,5.6%,4.8%,2.7%,1.5%.提示密封包装于避光玻璃管中的大黄游离蒽醌对光稳定.
密封于避光带塞玻璃管中的大黄游离蒽醌纳米乳,常温暗处放置90 d后,颜变化不大,MDS及PDI变化如表4所示,大黄游离蒽醌含量降低不超过5.0%.提示常温暗处放置3个月以上,粒径有增大趋势,但含量基本稳定.
2.4 大黄游离蒽醌纳米乳对辣椒白粉病防治效果
大黄游离蒽醌纳米乳100倍液对辣椒白粉病的相对防效为82.44%,极显著于其他处理,大黄游离蒽醌纳米乳250倍液对辣椒白粉病的相对防效为72.47%,与对照药剂15%三唑酮800倍液的相对防效71.76%比较,差异不显著,较其他处理差异达极显著水平.大黄游离蒽醌纳米乳500倍稀释液对辣椒白粉病的相对防效为50.09%,显著低于对照药剂15%三唑酮800倍液的防效,与空白纳米乳的相对防效19.09%比较,达极显著水平,呈现出一定的防治效果.具体结果见表5.
2.5 对红蜘蛛的防治效果
在所用参试药剂中,大黄游离蒽醌纳米乳100倍稀释液喷雾处理区,第3 d红蜘蛛几乎均变为黑褐色而死亡,与其它组的防治效果比较,差异极显著.大黄游离蒽醌纳米乳250倍和0.05%生物苄呋菊酯800倍稀释液处理后第5 d的虫口减退率和防治效果相当,均在85%以上,可在生产中推广使用.大黄游离蒽醌纳米乳500倍稀释液的虫口减退率和防治效果显著不及其它施药组,不建议使用该浓度进行红蜘蛛防控.具体结果见表6.

表4 大黄游离蒽醌纳米乳在30 ℃避光贮存期的MDS和PDI值(n=3)

表5 不同试药对辣椒白粉病的防治结果
小写字母表示0.05水平上差异显著,大写字母表示0.01水平上差异显著.
Lowercase letters indicate significant differences at the 0.05 level, and uppercase letters indicate significant differences at the 0.01 level.
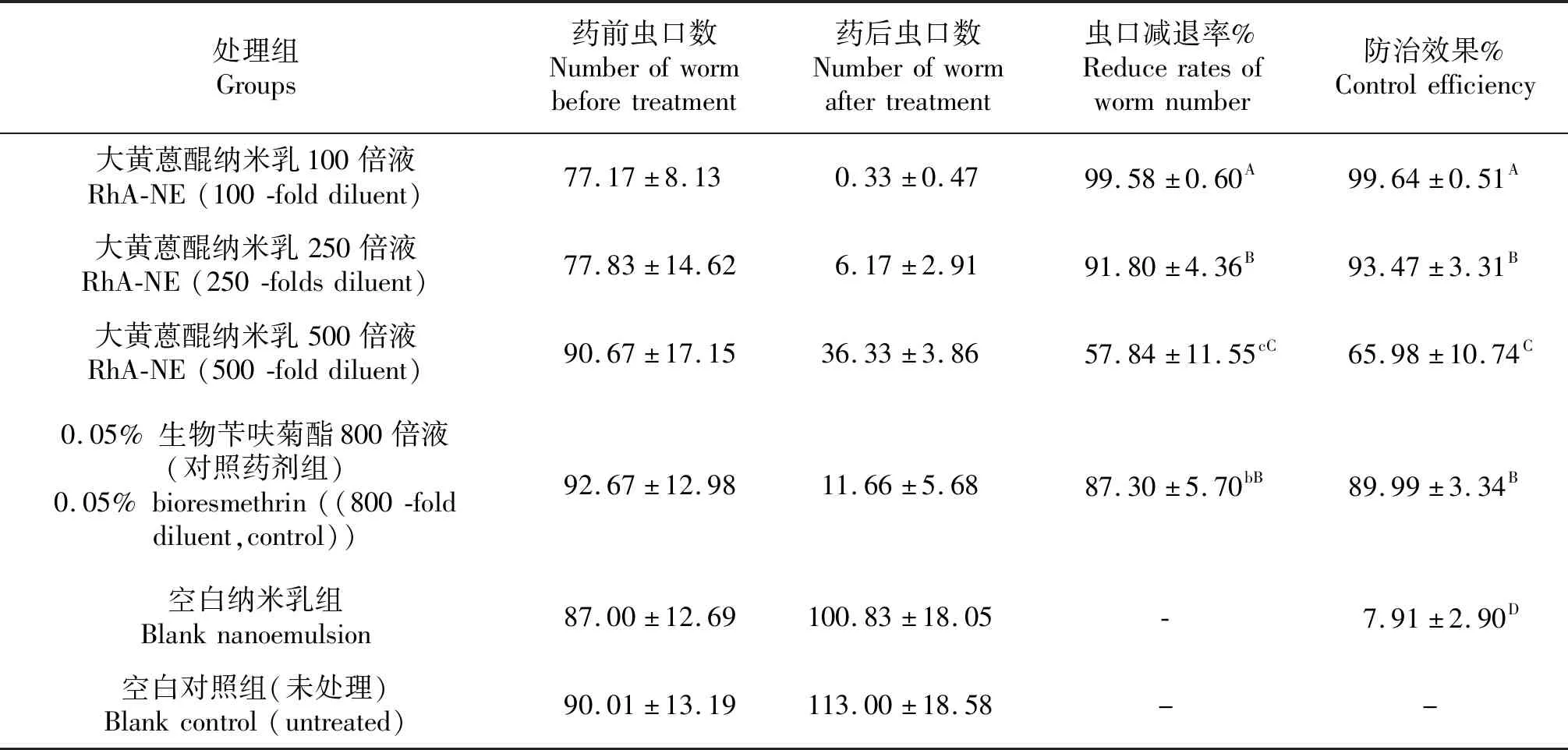
表6 不同试药对红蜘蛛施药后第5 d的虫口减退率和防治效果
小写字母表示0.05水平上差异显著,大写字母表示0.01水平上差异显著;-,表示虫口减退率小于零,无防治效果.
Lowercase letters indicate significant differences at the 0.05 level, and uppercase letters indicate significant differences at the 0.01 level.-Indicates that the larvae decay rate is less than zero and has no control effect.
3 讨论与结论
大黄游离蒽醌纳米乳粒径小,能以任意比例溶于水,不堵塞喷雾装置的喷头,使用方便,且能在一定程度上避免高温和光照对该类化合物结构的破坏.之前试制的大黄游离蒽醌在没有避光措施的玻璃管中于室温可见光下放置一周,可见乳液浊度增加,颜色加深,提示纳米乳滴平均粒径MDS增加,游离蒽醌发生了聚合或氧化.因此,光稳定性和常温贮存稳定性研究将试样置于带塞的玻璃试管中,石蜡膜密封,外覆黑色塑料袋避光放置观察.
防效调查过程中发现,空白纳米乳对辣椒白粉病也呈显出一定效果,这可能与纳米乳剂中含有高浓度的乳化剂聚氧乙烯氢化蓖麻油的生物膜损伤性有关[20],高浓度的助乳化剂二乙二醇单乙基醚可改变线粒体膜电位和细胞内活性氧水平,导致细胞核裂变和细胞凋亡[21].因为纳米乳中乳化剂和助乳化剂的总质量比在未稀释前达到了42.5%,即使大黄游离蒽醌纳米乳100倍稀释,也会对白粉病真菌产生一定的防治作用,同时也对植物组织产生毒性.大黄游离蒽醌纳米乳100倍稀释液对茄子红蜘蛛防治时,部分茄子的幼小叶片发生了枯萎和幼嫩茄子脱落,提示该纳米乳高浓度使用时具有一定的植物药害性.大黄游离蒽醌纳米乳250倍稀释液未发现明显的药害,防治效果明显,可作为植物源农药进一步研究开发.大黄游离蒽醌纳米乳对白粉病的防治期约为红蜘蛛的发病初期的防治期约5 d,之后视情况再行喷药或采取联合防治措施.
