全膜覆土栽培模式下冬小麦功能叶片泡状细胞形态变化规律
2019-03-25赵尚文王德贤岳维云王娜刘鸿燕王希恩周喜旺王孟孟蒲建刚陈荃
赵尚文,王德贤,岳维云,王娜,刘鸿燕,王希恩,周喜旺,王孟孟,蒲建刚,陈荃
(1.天水市农业科学研究所,甘肃 天水 741001;2.天水师范学院生物工程与技术学院,甘肃 天水 741001)
小麦是甘肃省最主要的口粮作物,目前种植面积已由多年的133万hm2降至100万hm2以下,“稳面积提单产”已成为确保主粮安全的策略,选育新优高抗品种,推广先进栽培技术势在必行.全膜覆土栽培技术因其显著的增产作用得到了大面积推广[1-2].天水作为旱作典型地区,全膜覆土栽培被大量采用[3],小麦采用全膜覆土栽培技术抗旱增产作用已被大量试验研究所证实[4],但是关于小麦在逆境胁迫下叶片,尤其旗叶等上层叶片作为小麦植株光合作用最重要的功能叶片,其抽穗期后表皮显微结构的变化,是目前植物生理研究的一个崭新方向.关于小麦叶片细胞及细胞器的研究也有不少报道[5],但是多集中在对小麦叶片细胞的种类、结构[6-10]和细胞器[11-13]分布等方面,泡状细胞是以小麦为典型代表的禾本科植物叶表皮的重要特征,一般认为它与叶片的卷曲和开张有关[14].近年来的研究表明,泡状细胞与植物的抗旱性有密切的关系[15].肖德兴等[16]、王晖等[17]分别对百喜草(Pasphannotatum)、狗牙根(Cynodondactylon)、假俭草(Eremochloaophiuroides)、结缕草(Zoysiajaponica)泡状细胞与抗旱性的关系进行了研究.本试验在国内率先比较了全膜覆土方式下抽穗期至灌浆期前后小麦功能叶片泡状细胞的微观形态差异,研究小麦功能叶片泡状细胞的功能与细胞微观形态数量特征的关系,利用显微摄影对小麦叶片表皮泡状细胞形态的数量特征进行分析,挖掘“源”“库”关系,探讨泡状细胞与叶片卷缩功能实现的关系,为小麦抗旱机理的研究和抗旱育种提供细胞学依据.
1 材料与方法
1.1 试验区概况
试验在天水市农科所中梁试验站小麦试验基地进行,该基地属于西北黄土高原丘陵沟壑区,是典型的干旱半干旱雨养农业区,海拔1 650 m,二阴山地,年无霜期约109 d,年降水量531.8 mm,季节分布不均,多集中在7、8、9三个月.试验地土壤类型为黄绵土,质地为粘壤土,肥力中等.土壤有机质含量14.5 g/kg、全氮1.35 g/kg、全磷0.56 g/kg、速效氮45.6 mg/kg、速效磷14.8 mg/kg、速效钾140.2 mg/kg.
1.2 试验设计与方法
试验于2017年9月至2018年6月进行.试验设2个处理:常规栽培露地穴播(CK)、全膜覆土穴播.以冬小麦‘中梁32号’为参试品种,播前施农家肥11 250 kg/hm2、尿素210 kg/hm2、磷二铵210 kg/hm2,机耕翻入.试验地前茬为小麦,土质黄绵土,肥力均匀.小区面积3 m×4 m =12 m2;地膜和露地小麦均采用小型穴播机点播,行距15 cm,穴距12 cm,每穴播8~12粒种子,覆膜小区先覆膜后播种,9月30日播种,6月30日收获.试验采用完全随机区组排列,重复3次,其他管理同当地大田.
1.2.1 覆膜方案 全膜覆土穴播(F):种植方式为全地面、全生育期地膜覆盖,铺膜时膜面要求平整,使地膜紧贴地面,同时在膜上覆一层薄土,覆土厚度以1~2 cm左右为宜,铺膜覆土1 d后采用穴播机播种,播种深度为3~5 cm,采用厚度0.008 mm、宽度120 cm的地膜覆盖,行距为15 cm,穴距为12 cm,播种密度为45万穴/hm2,每穴8~12粒,播种量225 kg/hm2左右.
露地穴播(L):种植方式为将地平整后,采用穴播机播种,播种量同上.
1.2.2 取样方案 于抽穗期后每隔15 d取样1次(分别为2018年5月10日、5月25日、6月10日),每小区(露地点播L和全膜穴播覆土F)取生长发育良好,长势一致的植株3株,剪掉旗叶(F1/L1),剪掉倒1叶(F2/L2)和剪掉倒2叶(F3/L3),装入液氮罐,及时带回天水师范学院生物技术学院实验室固定观察.
1.2.3 制片方案 样品取叶片中上部,经固定、脱水、透明后,用常规石蜡切片法包埋,切片、染色、封片后,制成小麦叶片上表皮横切装片[18],取效果较好切片用奥林巴斯显微镜,放大10倍和40倍观察及拍照,观察横切面上泡状细胞的数量和形态特征.
2 结果与分析
2.1 同一生育期不同叶位泡状细胞的差异
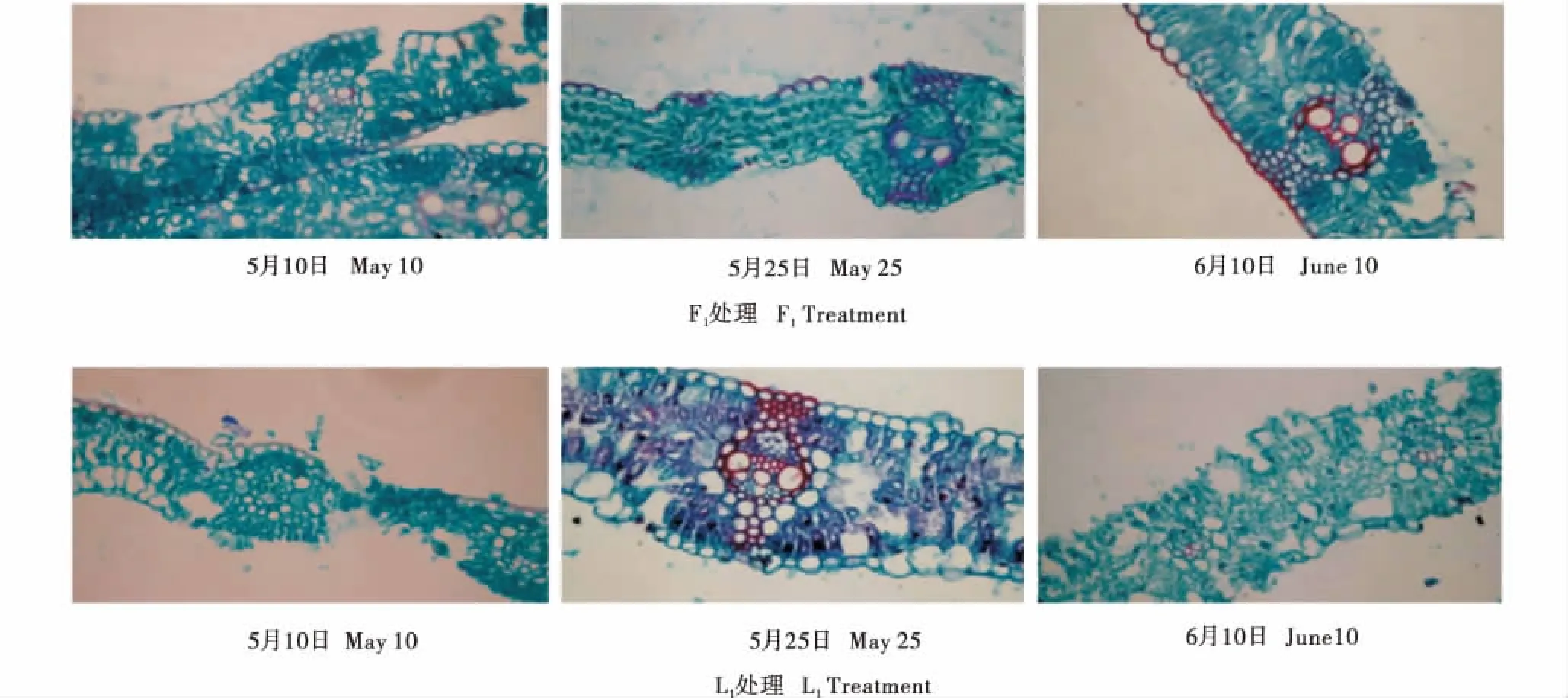
在叶片衰老过程中,光合作用是变化最大最明显的生理过程,叶片泡状细胞和叶绿素的降解作为叶片衰老的标志,往往导致光合作用能力的降低,而叶片的光合作用的能力是由净光合速率来体现的.由图1可见,比较抽穗前期5月10日所取材料显微结构发现,F1处理下叶肉组织发达,叶肉细胞排列更紧密,但L1的泡状细胞有比F1更大的趋势;F2与L2相比叶肉细胞情况与F1、L1相同,其大小相似的叶脉中L1的木质化成分更多,说明露地处理下在抽穗前期植株已经表现出衰老迹象;叶序之间相比,F3、L3叶肉细胞排列紧密程度均高于F1、L1,说明在抽穗前期,旗叶尚未发挥主要光合作用,旗叶蒸腾效率之间的差异尚不明显.

2018年5月10日;F:全膜覆土穴播;L:露地穴播;1、2、3分别表示旗叶、倒1叶、倒2叶. May 10,2018;F:Film mulched soil;L:Open field burrow seeding;1:flag leaf;2: the 2nd leaf;3: the 3rd leaf.图1 不同处理下冬小麦抽穗前期功能叶片表皮泡状细胞组(10×)Figure 1 Influence of film mulching on the bulliform cell group in wheat at early heading on leaf cross section(10×)
通过5月25日所取切片观察发现,各处理叶肉细胞均有不同程度增多,且更加紧密,不同处理之间旗叶的泡状细胞明显增加,但F处理下增加更加明显(图2).
通过6月10日灌浆后期所取材料处理F与L叶肉细胞的数量和形态变化特征表现为,但F细胞形态明显发生变化,类似于双子叶植物的栅栏组织的细胞形态,这种细胞为长柱型,细胞排列紧密,细胞中叶绿体含量较多,光合能力较强,但L叶肉细胞的形态没有这样明显的变化,而且L处理下叶肉细胞中小空泡明显增多,细胞中小空泡数量由开始的渐增到细胞死亡前的剧增,且下层叶片小空泡出现数量更多,这也说明水分胁迫越强,变化越大(图3).
2.2 不同生育期相同叶位泡状细胞变化规律
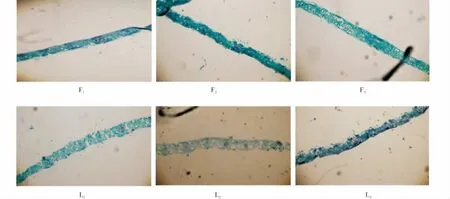
观察不同时期叶片显微结构可以发现,随着籽粒灌浆的进行,旗叶叶肉细胞的紧密程度和数量均有先增后减趋势,但F处理下增加较快,减少较慢,L处理旗叶细胞破碎明显,说明F处理下旗叶叶片衰老缓慢,可以为籽粒充分灌浆提供有利条件(图4).
不同时期倒一叶和倒二叶均有相同表现(图5~6),但衰老速率表现为L3>L2>L1,F3>F2>F1,相比F处理,L处理衰老速率明显更高,细胞空泡明显增多,叶肉细胞体积变小,开始大量解体,由此影响到整个植株的光合效能和灌浆效果,这说明全膜穴播覆土(F)种植方式与露地点播(L)相比水分的保持更好,小麦能获得到的水分更充足,叶肉细胞更多,叶绿体数量多,叶片卷曲防止水分散失的需求减少,光合时间增长,光合效能也会更大.

2018年5月25日;F:全膜覆土穴播;L:露地穴播;1、2、3分别为旗叶、倒1叶、倒2叶.May 25,2018;F:Film mulched soil;L:Open field burrow seeding;1:flag leaf;2: The 2nd leaf;3: The 3rd leaf.图2 不同处理下冬小麦灌浆前期功能叶片表皮泡状细胞组(10×)Figure 2 Influence of film mulching on the bulliform cell group in wheat at early filling on leaf cross section(10×)
2018年6月10日;F:全膜覆土穴播;L:露地穴播;1、2、3分别为旗叶、倒1叶、倒2叶.June 10,2018;F:Film mulched soil;L:Open field burrow seeding;1:flag leaf;2: The 2nd leaf;3: The 3rd leaf.图3 不同处理下冬小麦灌浆后期功能叶片表皮泡状细胞组(10×)Figure 3 Influence of film mulching on the bulliform cell group in wheat at late filling on leaf cross section(10×)
3 讨论
在小麦产量形成过程中,一般将生长和提供同化物的器官称为“源”,把消耗这些产物进行生长或储存养料的器官称作“库”.从生理的观点来看,产量是“源”、“库”相互作用的结果[19].光合产物的源主要是叶片,而旗叶的光合能力对产量的影响较大[20],同时灌浆结实期是影响小麦产量的关键时期[21].本研究表明,在灌浆结实期,各叶片均具有较高的泡状细胞表现,泡状细胞的形态和数量和抗旱性有正相关关系,而且泡状细胞可以让叶片适时内卷和折叠,减少蒸腾,但增加光合效能的具体机理还需通过超显微结构观察各细胞器的变化进一步研究,对泡状细胞形态数量特征与功能实现之间精确的数量关系本文并未论述,这方面的定量研究还需深入.
F:全膜覆土穴播;L:露地穴播;1:旗叶.F:Film mulched soil;L:Open field burrow seeding;1:flag leaf.图4 不同生育时期旗叶表皮泡状细胞动态变化(40×)Figure 4 Dynamic changes of bulliform cell in flag leaf at different growth stages(40×)

F:全膜覆土穴播;L:露地穴播;2:倒1叶.F:Film mulched soil;L:Open field burrow seeding;2: The 2nd leaf.图5 不同生育时期倒1叶表皮泡状细胞动态变化(40×)Figure 5 Dynamic changes of bulliform cell in the 2nd leaf ( from upper to lower) at different growth stages(40×)
水分胁迫越强,泡状细胞形态变化越大[22].随着细胞结构的破坏,细胞中小空泡数量由开始的渐增到细胞死亡前的剧增,这有可能是细胞组织对逆境的一种反应[15],对于小泡的形成机理有待于今后进一步研究.
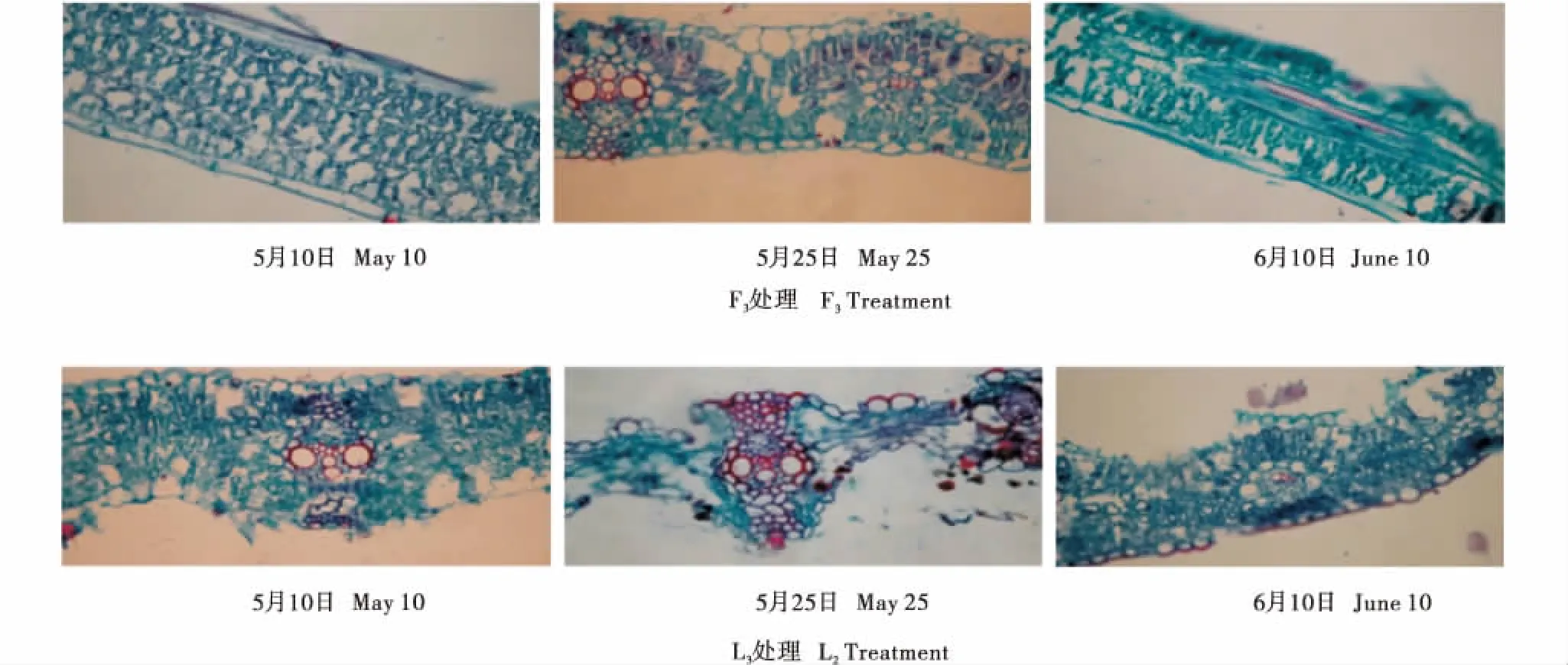
F:全膜覆土穴播;L:露地穴播;3:倒2叶.F:Film mulched soil;L:Open field burrow seeding;3:The 3rd leaf.图6 不同生育时期倒2叶表皮泡状细胞动态变化(40×)Figure 6 Dynamic changes of bulliform cell in the 3rd leaf ( from upper to lower) at different growth stages(40×)
叶片结构的变化与其生理功能的变化是相统一的[23].本研究发现从抽穗前期至灌浆初期,叶片结构变化不明显,叶肉细胞排列紧密有序,细胞间隙少,这些结构特点是其光合速率较高的结构基础.随着籽粒灌浆进行,各处理的小麦功能叶片迅速衰老,叶肉细胞和叶绿体开始解体,体积变小,排列紊乱,叶肉细胞数量呈下降趋势,这些结构特征变化是导致叶片光合速率迅速降低,但全膜覆土栽培模式下冬小麦旗叶表现出较强的叶肉细胞同化能力,使得叶片衰老变慢,这可能与旗叶延缓衰老的生化机制有关.
4 结论
在生产实践上,通过延缓叶片衰老来延长光合时间以提高冬小麦产量是可行的,相比露地栽培,全膜覆土处理下泡状细胞数量减少缓慢,功能叶片能保持更多水分,细胞衰老速率缓慢,尤其旗叶功能期较长,延长了叶片光合时间,小麦叶的此性状的确有助于更多的同化物积累,有效的增加籽粒质量,这为小麦籽粒的充分灌浆提供了较有利的条件,是全膜覆土栽培模式高产的细胞学依据之一.因此,通过选育“旗叶持绿型”品种是实现小麦高光效育种的有效途径,并结合全膜覆土栽培模式改良品种“库”容,提高西北旱区冬小麦的高产潜力.
