蟹黄糖蛋白提取工艺及抗氧化活性研究
2019-03-25相兴伟闻正顺曲有乐
薛 然,杜 明,郑 斌,2,相兴伟,2,闻正顺,曲有乐
(1.浙江海洋大学食品与医药学院,浙江舟山 316022;2.浙江省海洋开发研究院,浙江舟山 316021)
海蟹,即三疣梭子蟹Portunus trituberculatus,属甲壳动物,是深受我国消费者喜爱的特色水产品之一。由于海蟹特殊的生理特性——对自然繁殖条件和生存环境要求很高。我国处于亚热带和温带,气候适宜,有利于蟹类的生长繁殖,主要盛产于辽东半岛、山东半岛及江浙闽粤沿海一带[1-2]。海蟹不仅是鲜美佳肴——而且药用价值丰富,其性味咸、寒,具有清热散血——养筋益气的功效[2]。雌蟹性成熟后的卵巢和肝脏部分俗称“蟹黄”[3]。已有相关研究证明,蟹黄含有丰富的脂肪、蛋白质、不饱和脂肪酸、钙质等[4]。
糖蛋白是一类蛋白质与糖共价结合的复合物[5],其中糖链和肽链共同调节机体的各种生物活性[6]。已有研究表明翡翠贻贝糖蛋白[7]、蒲公英糖蛋白[8]、霍山石斛糖蛋白[9]等具有抗氧化、抗炎、抗肿瘤活性。目前,蟹黄的研究多集中在营养成分分析比较,以及其作为食品的加工工艺及配方研究等方面[10-11],对蟹黄的化学成分和生理活性研究较少,YANG Fang,et al[12]等人研究用含NaCL 的磷酸缓冲溶液提取蟹肉的肌原纤维蛋白;陶学明[13]采用酶解法从梭子蟹下脚料中提取蛋白质,但有关蟹黄糖蛋白的提取及其活性研究在国内外均未有相关文章发表。本实验将尝试利用盐提取技术从梭子蟹的蟹黄中提取糖蛋白,探讨其最佳提取工艺和抗氧化活性,对于更好地开发利用蟹黄这一宝贵的资源意义深远。
1 材料与方法
1.1 原料与试剂
蟹黄:为新鲜梭子蟹蟹黄,由浙江省海洋研究开发院赠送。
氯化钠、无水乙醇、无水乙醚、浓硫酸、丙酮、苯酚等试剂均购自国药集团化学试剂有限公司,均为分析纯;抗坏血酸(Vc)购于Sigma,分析纯。
1.2 仪器与设备
中药粉碎机(103 型):瑞安市永历制药机械有限公司;大容量低速离心机(TD5K 型):长沙东旺实验仪器有限公司;恒温水浴锅(HH-S 型):巩义市予华仪器责任有限公司;紫外-可见分光光度计(UV-1600 型):上海美谱达仪器有限公司。
1.3 方法
1.3.1 蟹黄粗糖蛋白提取工艺
取一定量的蟹黄冷冻干燥,粉碎,过筛除杂。称取蟹黄粉末1 g,按一定液料比加入不同浓度的NaCL溶液中,置于4℃条件下,浸提一段时间后,离心,取上清液,加入无水乙醇,使醇含量为70%,沉淀过夜,抽滤,依次用无水乙醇、丙酮洗涤2 次,挥干溶剂后,加少量水使其溶解,用Sevage 试剂(3 次)脱去蛋白[14],浓缩后加入乙醇进行二次醇沉。同样,沉淀依次用乙醇、丙酮淋洗2 次,挥干溶剂,加少量蒸馏水溶解,流水透析,进行冷冻干燥,即为蟹黄粗糖蛋白[15]。
1.3.2 蟹黄粗糖蛋白提取的单因素试验
称取1 g 蟹黄粉末,按照盐浓度(0.1~0.6 mol·L-1)、提取时间(1~6 h)、料液比(1:30~1:55) 3 个因素依次进行试验,每组重复3 次,冻干后获得蟹黄粗品,计算其占蟹黄原料的质量百分比作为蟹黄糖蛋白提取率,并以提取率为评价指标,筛选出单因素试验条件。
1.3.3 蟹黄粗糖蛋白提取的正交试验
根据单因素试验结果,选取盐浓度(A)、时间(B)、料液比(C) 3 个因素,每个因素3 个水平,进行蟹黄糖蛋白的L9(34)正交试验,正交试验设计如表1。
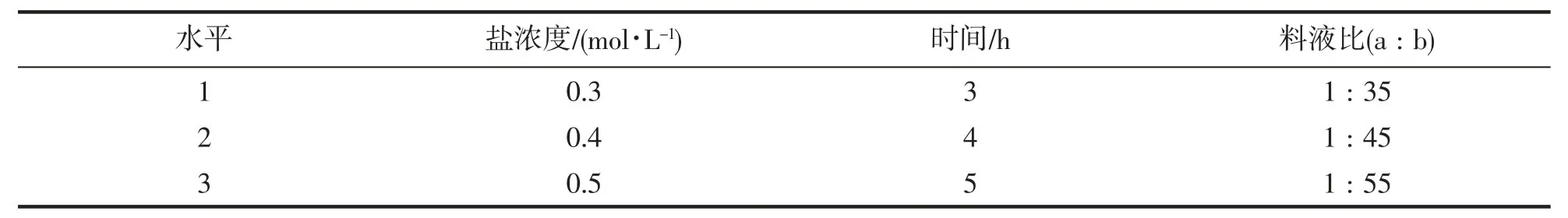
表1 蟹黄糖蛋白提取的实验设计Tab.1 Experimental design of microwave extraction of crab spawn glycoprotein
1.4 蟹黄糖蛋白中多糖含量的测定
多糖含量的测定采用苯酚-硫酸法[16],以D-无水葡萄糖为标准品。
配制浓度为0.1 mg·L-1的葡萄糖标准液,分别精确吸取0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL 的葡萄糖标准液,加蒸馏水补至2.0 mL,加入1.0 mL 质量分数为6%的苯酚,摇匀后迅速加入5 mL 浓硫酸,室温放置30 min,于波长490 nm 处测定吸光度,制作标准曲线,待测样品稀释若干倍后以同样的方法测定吸光度。
多糖含量计算公式如下:
多糖含量/%=(m×D×V/M)×100%
式中:m 为样品液OD 值对应标准曲线所得多糖含量,mg·mL-1;D 为稀释倍数;V 为样品液总体积,mL;M 为加入的蟹黄干粉质量,mg。
1.5 蟹黄糖蛋白中蛋白质含量的测定
蛋白含量的测定采用福林酚比色法[17],以牛血清白蛋白为标准品。
配制浓度为0.249 g·L-1的牛血清白蛋白标准液,分别精确吸取0、0.1、0.3、0.5、0.7、0.9 mL 的标准液,加蒸馏水补至1.0 mL,加入1.0 mL 碱性铜溶液摇匀后,迅速加入4 mL 福林酚溶液,混匀55℃水浴5 min 后冷却至室温,于波长650 nm 处测定吸光度,制作标准曲线,待测样品稀释若干倍后以同样的方法测定吸光度。
蛋白含量计算公式如下:
蛋白含量/%=(m×D×V/M)×100%
式中:m 为样品液OD 值对应标准曲线所得蛋白含量,mg·mL-1;D 为稀释倍数;V 为样品液总体积,mL;M为加入的蟹黄干粉质量,mg。
1.6 蟹黄糖蛋白的体外抗氧化实验
1.6.1 溶液配制
蟹黄糖蛋白溶液:称取一定量的蟹黄糖蛋白冻干粉沫,充分溶解于蒸馏水中,并依次稀释到10、8、6、4、2 mg·mL-1。
Vc 溶液:称取一定量Vc——充分溶解于蒸馏水中,并依次稀释到10、8、6、4、2 mg·mL-1。
1.6.2 抗脂质过氧化能力的测定
抑制率=(A对照-A样品)/A对照×100%
式中:A对照为不加样品管的吸光度;A样品为蟹黄糖蛋白溶液的吸光度。
1.6.3 DPPH 自由基清除能力的测定
测定方法[19]如下:取试管编号,分别加入1 mL 不同浓度(0,2,4,6,8 和10 mg·mL-1)糖蛋白溶液和4 mL 0.004% DPPH,摇匀后暗处放置30 min 后,以无水乙醇为对照管,在517 nm 处测定吸光度,以Vc 溶液作为阳性对照。
清除率=[(A对照-A样品)/A对照]×100%
式中:A对照为无水乙醇的吸光度;A样品为蟹黄糖蛋白溶液的吸光度。
1.6.4 超氧阴离子自由基清除能力的测定
测定方法[20]如下:取试管编号,依次加入3 mL Tris-HCl (0.05 mol·L-1,pH 为8.2)缓冲液和0.2 mL 的不同浓度(0、2、4、6、8 和10 mg·mL-1)蟹黄糖蛋白溶液,25℃水浴10 min 后,依次加入0.012 mL 浓度为30 mmol·L-1邻苯三酚溶液,晃动试管摇匀后,室温下放置4 min,之后依次加入0.5 mL 浓盐酸溶液停止反应,测定320 nm 处吸光度,以Vc 溶液作为阳性对照。
清除能力=(A1-A2)/(A1-A0)×100%。
式中:A0为加Tris-HCl 缓冲液的吸光度;A1为加蒸馏水的吸光度;A2为蟹黄糖蛋白溶液的吸光度。
2 结果与分析
2.1 蟹黄糖蛋白中的多糖含量和蛋白含量
苯酚-硫酸法测得多糖含量为74.60%±1.3%,福林酚比色法测得蛋白含量为16.25%±0.73%。
1.2.6.1 DNA提取 采取磁珠法利用致善Lab-Aid 820全自动核酸提取仪抽提目标外周血、羊水gDNA。通过Nanodrop微量紫外分光光度计将提取完的gDNA进行纯度和浓度检测,保证其A260/A280在1.8~2.0之间且总量达到单次建库量5 μg。
2.2 蟹黄糖蛋白提取的单因素试验优化
2.2.1 盐浓度对蟹黄糖蛋白提取率的影响
从图1 可以看出:盐溶液浓度在0~4mol·L-1范围内,蟹黄糖蛋白的提取率随着盐浓度的增加而增大;在盐浓度为0.4 mol·L-1达到最高提取率为4.94%;当盐浓度超过0.4 mol·L-1时,糖蛋白提取率有所下降,可能是由于此时提取溶剂浓度达到饱和状态,因此选择提取盐浓度为0.4 mol·L-1。
2.2.2 提取时间对蟹黄糖蛋白提取率的影响
从图2 可以看出:提取时间在1~5 h 范围内,蟹黄糖蛋白提取率随着时间的延长而相应提高,这是由于随着浸提时间延长,糖蛋白溶解越来越充分,溶出量也逐渐增多[21],所以糖蛋白提取率增加。其中在5 h时提取率达到最大5.09%,所以选择提取时间为5 h。
2.2.3 蟹黄与盐溶液的料液质量比对蟹黄糖蛋白提取率的影响
从图3 可以看出:在一定的范围内,蟹黄糖蛋白提取率随着料液质量比的增大而提高,是因为此时细胞内外浓度差变大,胞内浸出物增多[22]。当料液质量比为1:45 时,糖蛋白提取率达到最大为3.96%,当液固质量>1:45 时,提取率呈小幅度下降,可能是糖蛋白基本都溶出完全的原因,所以选择提取料液比为1:45。
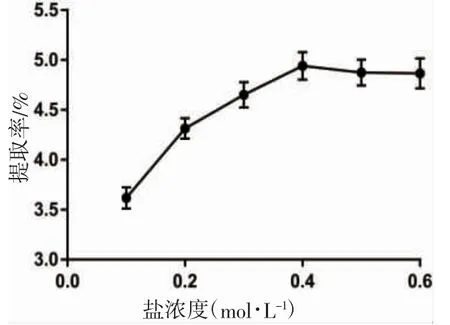
图1 盐浓度对蟹黄糖蛋白提率的影响Fig.1 Effect of salt concentration on the extraction rate of crab spawn glycoprotein
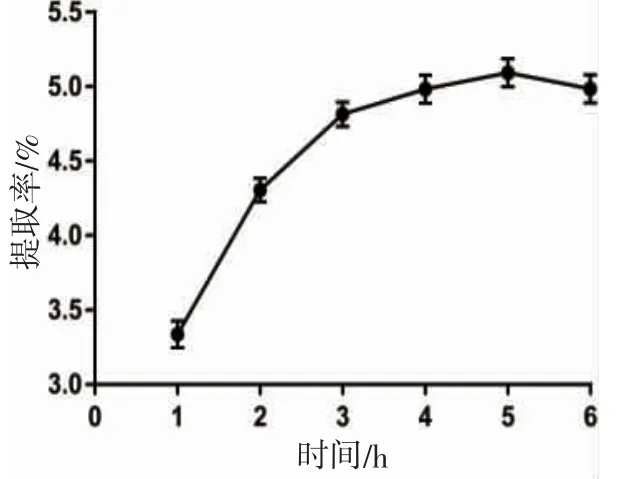
图2 提取时间对蟹黄糖蛋白提取率的影响Fig.2 Effect of extraction time on extraction rate of crab spawn glycoprotein
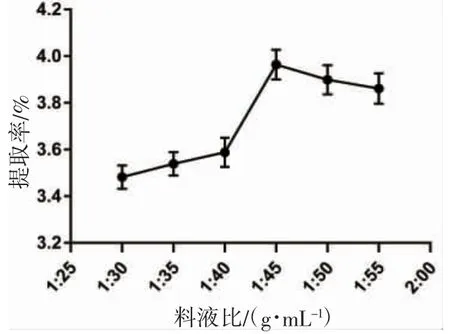
图3 料液质量比对蟹黄糖蛋白提率的影响Fig.3 Effect of ratio of material to liquid on the extraction rate of crab spawn glycoprotein
2.3 蟹黄糖蛋白提取工艺的正交试验优化
在单因素试验基础上,对影响蟹黄糖蛋白提取率的主要因素(盐浓度、时间、料液比)进行L9(34)正交试验,正交试验结果如表2。
由表2 可知——RB>RA>RC,各因素对糖蛋白提取率的影响程度依次为时间(B)>盐浓度(A)>料液比(C),由均值比较可知:盐浓度的均值最大为K2,时间的均值最大为K3,料液比的均值最大为K2,所以最优工艺为A2B3C2,即正交试验的最佳工艺为盐浓度0.4 mol·L-1,浸提时间5 h,料液比为1:45。
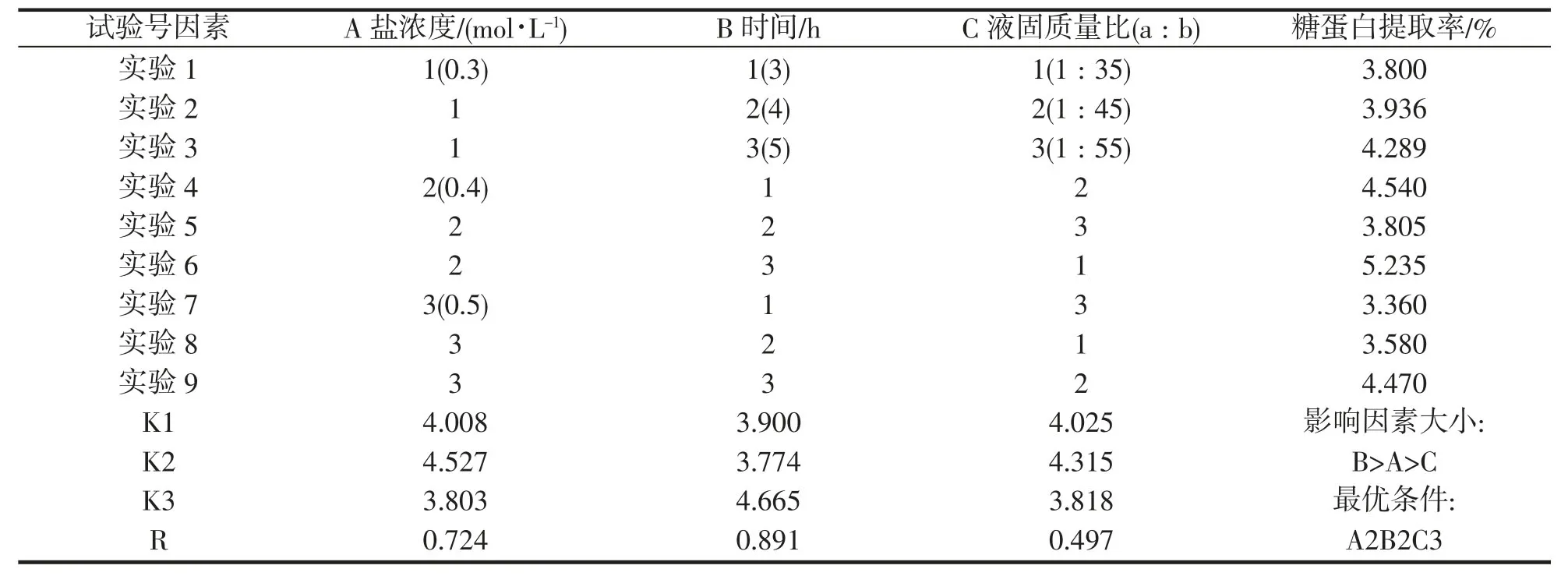
表2 蟹黄糖蛋白正交试验的结果Tab.2 Results of orthogonal test of crab spawn glycoprotein
由表3 可知,FB=37.703>FA=22.541>FC=11.054,同时查表可知,盐浓度、浸提时间对蟹黄糖蛋白提取率有显著影响,料液比对蟹黄糖蛋白提取率无显著影响。

表3 试验因素的显著性分析Tab.3 Significant analysis of experimental factors
2.4 蟹黄糖蛋白的体外抗氧化活性
2.4.1 抗脂质过氧化能力的测定
从图4 可以看出,蟹黄糖蛋白浓度在0~10 mg·mL-1间时,随着糖蛋白浓度的增加,抑制率逐渐升高即抗脂质过氧化能力逐渐增强。当糖蛋白浓度低于4 mg·mL-1时,抑制率随着浓度增加急剧升高;糖蛋白浓度高于4 mg·mL-1时,抑制率增长缓慢。糖蛋白浓度达到10 mg·mL-1时,抑制率达到55.37%。
2.4.2 DPPH 自由基清除能力的测定
从图5 可以看出,蟹黄糖蛋白具有一定的DPPH 自由基清除能力,当糖蛋白浓度低于4 mg·mL-1时,清除率随着浓度增加急剧升高;糖蛋白浓度在4~8 mg·mL-1间时,清除率曲线趋于平坦;糖蛋白浓度高于8 mg·mL-1时,清除率呈现上升趋势。
2.4.3 超氧阴离子自由基清除能力的测定
从图6 可以看出,蟹黄糖蛋白浓度在0~10 mg·mL-1间时,随着蟹黄糖蛋白浓度增加,清除率逐渐升高,即超氧阴离子自由基清除能力逐渐增强,但相比于抗脂质过氧化能力、DPPH自由基清除能力较弱。当蟹黄糖蛋白浓度为10 mg·mL-1时,超氧阴离子自由基清除率达到52.94%。
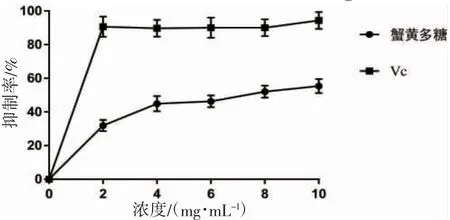
图4 蟹黄糖蛋白的抗脂质过氧化能力Fig.4 Anti-lipid peroxidation ability of crab spawn glycoprotein
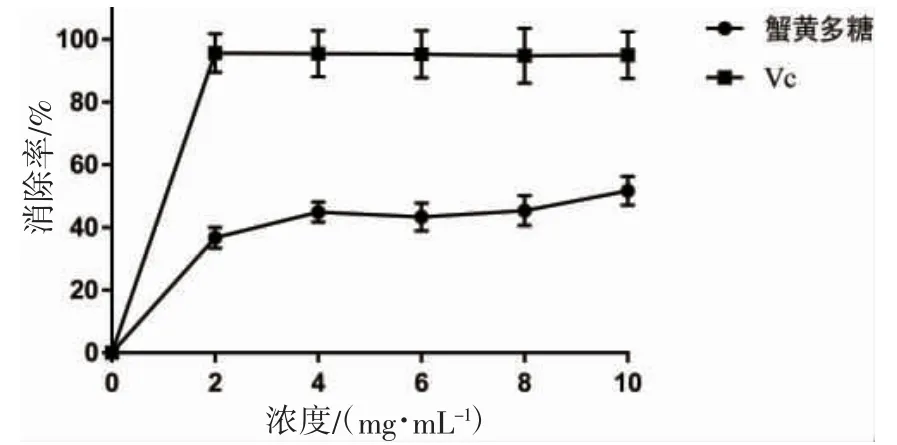
图5 蟹黄糖蛋白的DPPH 自由基清除能力Fig.5 DPPH free radical scavenging ability of crab spawn glycoprotein
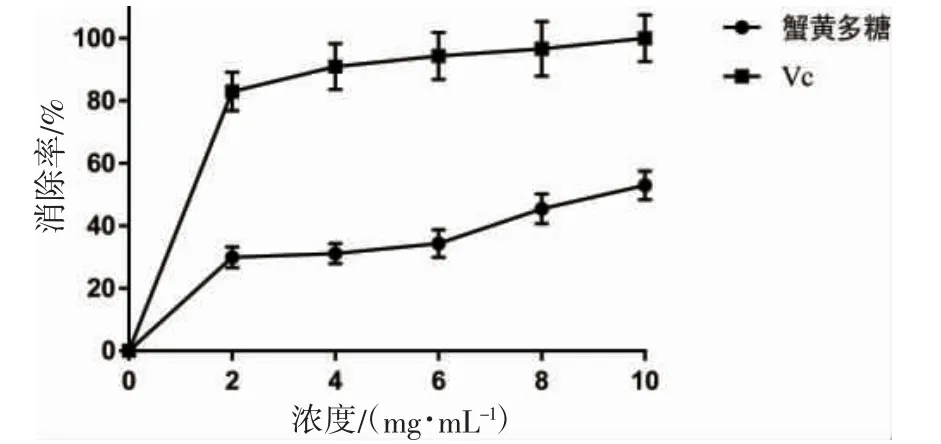
图6 蟹黄糖蛋白的超氧阴离子自由基清除能力Fig.6 Superoxide anion free radical scavenging ability of crab spawn glycoprotein
3 结论
(1)在前期的单因素试验优化蟹黄糖蛋白提取率的条件下,通过L9(34)正交试验优化提取工艺得出,最优方案为A2B3C2 即盐浓度为0.4 mol·L-1,浸提时间5 h,料液比为1:45。同时,方差分析表明:盐浓度、提取时间对蟹黄糖蛋白提取率影响显著。
(2)以Vc 作为对照组,通过对蟹黄糖蛋白的抗脂质过氧化能力、DPPH 自由基清除能力、超氧阴离子自由基清除能力来评价其体外抗氧化活性,结果表明蟹黄糖蛋白具有一定的体外抗氧化活性,但弱于Vc 抗氧化能力。
